晚期非小细胞肺癌患者接受盐酸安罗替尼一线和二线治疗的近期疗效观察
2024-01-23王敏,常宁,张勇,张艰
王 敏,常 宁,张 勇,张 艰
(空军军医大学西京医院呼吸与危重症医学科,陕西 西安 710032)
抗血管生成治疗在晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)治疗中的抗肿瘤效果已逐步获得认可。作为一种全新的靶向治疗策略,抗血管生成治疗主要通过抑制血管内皮生长因子(vascular endothelial growth factor,VEGF)等血管内皮生长相关信号阻断其与受体的相互作用,实现肿瘤血管正常化及抑制肿瘤新生血管生成等抗肿瘤作用。目前,NSCLC的抗血管生成治疗主要分为以下三类:以贝伐珠单抗为代表的大分子单克隆抗体、以重组人血管内皮抑制素为代表的小分子抑制因子以及以安罗替尼为代表的小分子酪氨酸激酶抑制剂等。安罗替尼作为我国自主研发的一种小分子多靶点酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI),在肿瘤内发挥抗血管生成和抗肿瘤活性的双重作用。ALTER 0303研究表明,无论是表皮生长因子受体(epidermal growth factor receptor,EGFR)野生型[1],还是EGFR突变型或T790M型[2],安罗替尼组相比于安慰剂组显著延长了患者的总生存期和无进展生存期(progression-free survival,PFS)[3];ALTER 0302研究提示患者的年龄、性别、突变状态等所有亚组分析均有PFS获益[4]。然而,安罗替尼在临床应用中仍面临诸多问题,包括受益人群筛选、原发性或获得性耐药以及方案选择等应用指征问题。本课题回顾性地收集分析69例确诊的晚期NSCLC患者作为研究对象,评估将安罗替尼作为一线及二线单药治疗方案应用于晚期NSCLC的短期疗效和安全性,通过对患者PFS、客观缓解率(objective response rate,ORR)、疾病控制率(disease control rate,DCR)及安全性分析,探讨以安罗替尼单药作为晚期NSCLC治疗的有效性与安全性,以期为晚期NSCLC治疗方案的制定提供理论支持并奠定基础。
1 对象与方法
1.1 对象
收集2021年7月至2022年2月西京医院、唐都医院、西安市第三医院确诊的晚期NSCLC患者进行回顾性研究。收集电子病历系统中患者的一般资料,包括年龄、性别、病理分型、突变类型、临床分期、治疗线数。入选标准为:①年龄≥18岁;②晚期NSCLC(根据美国癌症分期手册第8版分期,分为ⅢB、ⅢC或Ⅳ);③根据组织病理学标准组织学或细胞学诊断为NSCLC;④实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1版中定义的一个或多个可测量的靶病灶;⑤一线及二线使用安罗替尼进行治疗。排除标准:①小细胞肺癌或者混合细胞型肺癌患者;②接受过安罗替尼或其他抗血管生成治疗的患者;③无药物疗效评估数据的患者。69例晚期NSCLC患者中,26例从未接受过抗肿瘤治疗的患者应用安罗替尼一线单药治疗(一线治疗组),43例对化疗不耐受或靶向治疗耐药的患者接受安罗替尼二线单药治疗(二线治疗组)。因患者拒绝采用其他治疗方案并自愿使用安罗替尼作为一线或二线单药治疗方案,临床医生已充分告知患者及家属相关政策和潜在的风险,经评估后予以使用。本研究经空军军医大学西京医院伦理委员会批准(许可证号:KY20212214-C-1),所有患者均签署知情同意书。
1.2 方法
纳入研究的患者均采用安罗替尼单药治疗,根据药品说明书及中国抗癌协会临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)指南推荐,药物剂量按12 mg/d计,早餐前口服,连续服药2周,停药2周,每3周为一个疗程。如果患者出现不良事件≥Ⅲ级,适当调整用药剂量(可选的调整剂量为10 mg和8 mg);如果患者病情进展或出现不良事件导致的不耐受,则停止药物治疗。
1.2.1 疗效评估 根据RECIST,每2个周期或在出现显著进展迹象早期时进行CT扫描和核磁共振成像评估治疗效果。疗效评估分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、病情稳定(stable disease,SD)和病情进展(progressive disease,PD)。主要研究终点为接受安罗替尼单药治疗患者的PFS,次要研究终点为ORR、DCR以及安罗替尼的安全性。ORR=[(CR+PR)/总数]×100%;DCR=[(CR+PR+SD)/总数]×100%;安罗替尼治疗的安全性由美国国立癌症研究所的常见毒性事件标准[5]进行评估。
1.2.2 统计学分析 应用SPSS 26.0软件进行数据分析,计数资料以n(%)表示,组间差异比较采用χ2检验或者Fisher确切概率法;采用RStudio软件绘制Kaplan-Meier生存曲线及森林图,P<0.05表示差异有统计学意义。
2 结果
2.1 69例接受安罗替尼治疗患者的基线临床资料
在69例患者中,多数患者年龄超过55岁,男性45例(65.2%);23例(33.3%)患有高血压病史;8例(11.6%)合并有脑转移;病理类型为肺腺癌者占比75.4%;Ⅲ期19例,Ⅳ期50例;26例接受安罗替尼一线治疗,43例接受安罗替尼二线治疗,绝大多数为驱动基因阴性患者,既往因不耐受化疗或者靶向治疗而自愿采用安罗替尼方案治疗。本研究中70%以上的患者ECOG PS评分≥1分(表1)。
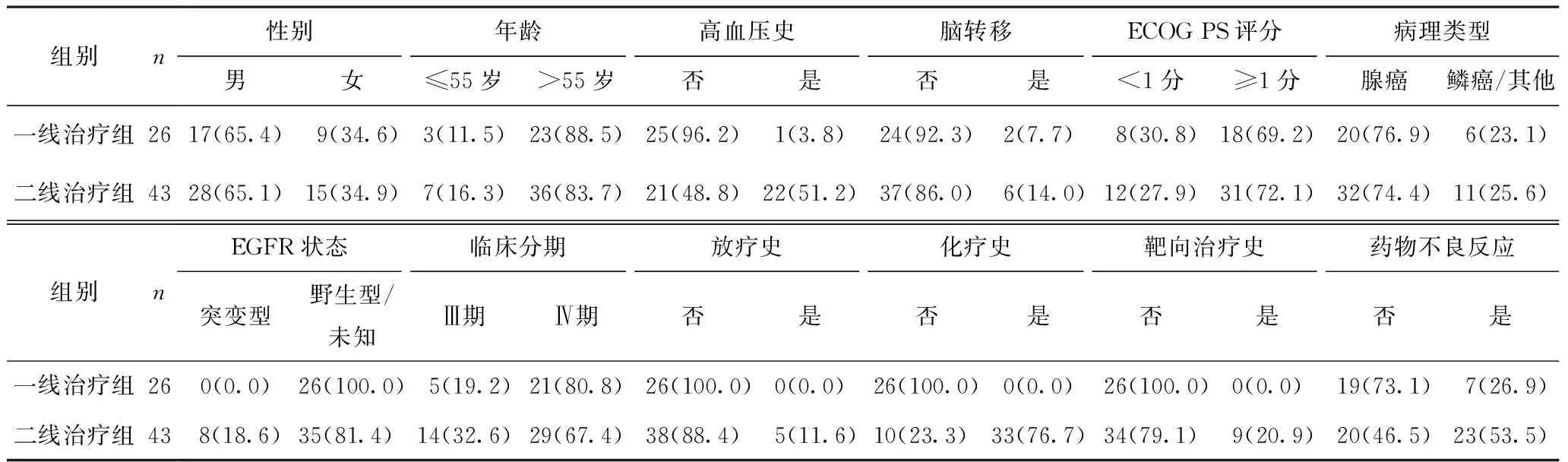
表1 安罗替尼一线治疗组及二线治疗组患者的基线特征 [n(%)]
2.2 安罗替尼单药治疗NSCLC患者的疗效、预后及影响因素分析
69例患者中CR 0例,PR 11例,SD 47例,PD 11例(表2)。总ORR和DCR分别为15.9%(11/69)和84.1%(58/69)。其中,接受安罗替尼一线治疗的26例患者,ORR和DCR分别为26.9%(7/26)和84.6%(22/26);接受安罗替尼二线治疗的43例患者,ORR和DCR分别为9.3%(4/43)和83.7%(36/43)。从纳入研究到最后一次随访的中位随访时间为6个月,69例患者的中位PFS为4.6个月(95%CI:4.21~5.00),46例患者在随访过程中出现进展。26例一线安罗替尼治疗的NSCLC患者和43例二线治疗患者的中位PFS分别为4.7个月(95%CI:4.44~5.03)和4.2个月(95%CI:3.86~4.48),差异有统计学意义(P<0.05,图1)。单因素分析表示,年龄和治疗线数与PFS显著相关(均P<0.05,图2);Cox多因素回归分析表明,治疗线数是发生PFS的独立影响因素(P=0.042),二线治疗患者发生PFS的危险性约是一线治疗患者的2倍(HR:2.009,95%CI:0.94~6.19)。
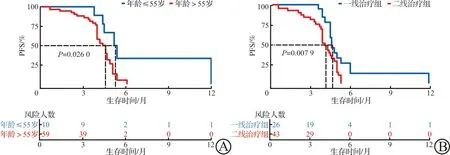
PFS:无进展生存期;NSCLC:非小细胞肺癌。图1 根据年龄(A)和治疗线(B)进行分组绘制接受安罗替尼治疗的69名NSCLC患者的PFS
2.3 安罗替尼一线及二线用药后出现的不良事件
本研究总结了所有报告的不良事件。接受安罗替尼一线治疗和二线治疗的患者毒副反应事件如表4所示,并未观察到药物治疗相关死亡事件发生。接受安罗替尼一线治疗的患者中,三种最常见的不良反应分别为乏力、手足综合征、食欲减退;而接受安罗替尼作为二线治疗的患者中,三种最常见的不良反应是高血压、腹泻、声音嘶哑。≥3级不良事件包括乏力、口腔黏膜炎、高血压、手足综合征,通过减量或者暂停用药,对症治疗后也得到控制。
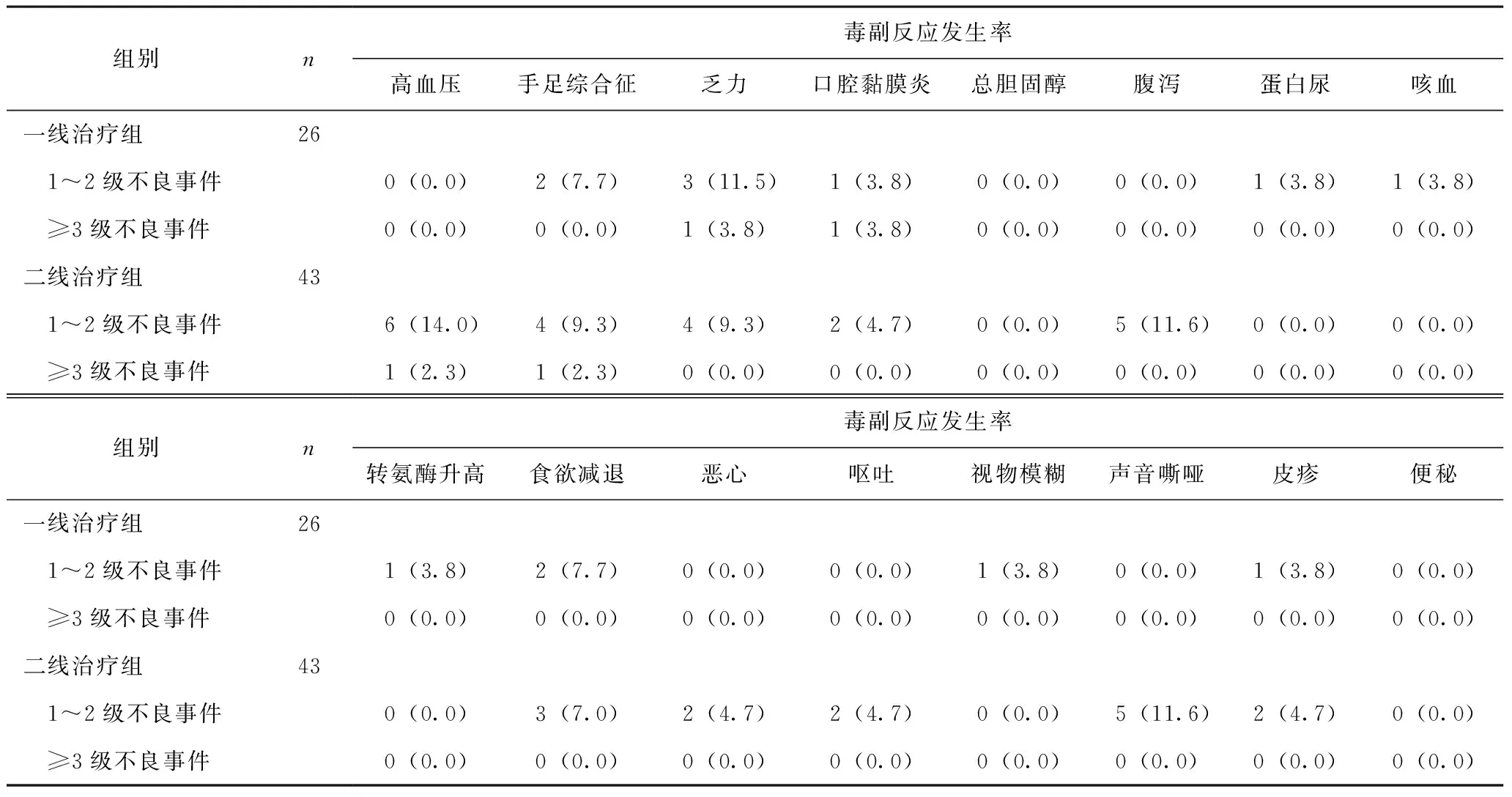
表4 安罗替尼一线治疗组及二线治疗组毒副反应发生率 [n(%)]
3 讨论
肿瘤细胞招募血管内皮细胞和循环内皮祖细胞形成新的血管,以支持其自身的生长和转移。VEGF、PDGF-BB和FGF-2是三种主要的促血管生成因子,可用于促进血管生成,安罗替尼抑制VEGF/PDGF-BB/FGF-2诱导的细胞迁移和内皮细胞毛细血管样管的形成,且抗血管生成作用优于舒尼替尼、索拉非尼和尼达尼布这几种酪氨酸激酶抑制剂[6]。LIANG等[7]的研究指出安罗替尼可诱导人肺癌细胞系(Calu-1、A549)凋亡,并通过抑制JAK2/STAT3/VEGFA信号通路发挥抗血管生成作用,然而安罗替尼同样诱导肺癌细胞发生保护性自噬,联用氯喹等自噬抑制剂可抑制该不良作用,从而进一步增强抗肿瘤活性。既往临床研究结果提示安罗替尼对于软组织肉瘤、甲状腺髓样癌、转移性肾癌等有确切疗效[8-9],一项154例接受安罗替尼治疗软组织肉瘤患者的单组实验(NCT01878448)表明病理亚型为软组织腺泡状肉瘤的患者12周PFS最高(76.9%)[10];甲状腺髓样癌患者的单组实验(NCT01874873)研究提示接受安罗替尼治疗患者的平均PFS为12.8个月[11];转移性肾癌单组实验(NCT02072044)患者的中位PFS为11.8个月[12]。在肺癌方面,安罗替尼已被NMPA批准用于复发或进展的晚期NSCLC患者在经历二线及多线靶向药物治疗或化疗后的治疗选择[13-15]。虽然CSCO并未推荐安罗替尼为肺癌一线治疗药物,然而含铂类药物的双药联合化疗作为晚期肺癌患者的标准治疗手段,在近年来并无显著疗效进展。鉴于临床部分患者存在经济负担,从而拒绝化疗或靶向药物治疗,一线安罗替尼单药治疗或可成为这类晚期NSCLC人群挽救性治疗方案的可能选择。一项纳入118例患者的回顾性研究显示,应用安罗替尼治疗的患者,其ORR为8.5%,DCR为75.4%[16]。meta分析结果提示,相较于其他多靶点小分子TKI药物,安罗替尼显示出更好的ORR、DCR及PFS[17-18]。本研究对26名晚期NSCLC患者使用安罗替尼一线单药治疗的疗效结果显示,一线治疗ORR和DCR分别为26.9%和84.6%,中位PFS为4.7个月(95%CI:4.44~5.03),表明一线安罗替尼单药治疗作为挽救性治疗方案颇具成效。此外,43例二线安罗替尼单药治疗组的NSCLC患者ORR和DCR分别为9.3%和83.7%,中位PFS为4.2个月(95%CI:3.86~4.48)。相较于安罗替尼一线单药治疗,二线单药治疗的疗效稍欠佳。但总体来说安罗替尼单药治疗是一线及后线可选择的方案之一,为这类患者后续的临床治疗提供了一定的理论依据。
从药物安全性方面来说,乏力和高血压分别为本研究中一线治疗组和二线治疗组最常见的毒副反应,这与先前研究结果基本一致[19-21]。回顾既往研究结果,少见的毒副反应如视物模糊也有所报道[22],未发现新的非预期的不良反应。所有药物相关毒副反应在调整药物剂量或者暂停用药、对症治疗后均可控,且未发生治疗相关的死亡事件,表明安罗替尼在晚期NSCLC患者中具有良好的安全性。
本文研究结果同样有一定的局限性,首先,本研究为回顾性研究,存在不可避免的偏倚;其次,样本量局限,只有69例晚期NSCLC患者纳入到研究中,未来需要开展更大样本量的研究对结果进行验证。
综上,对于基因靶向检测提示驱动基因阴性且经济负担较重拒绝常规治疗的晚期NSCLC一线用药人群,或者不耐受化疗及靶向药物治疗的二线用药人群来说,安罗替尼或许是一种有效的选择,用药方便,疗效尚佳,且毒副反应可控。此外,LIU等[23]发现安罗替尼通过失活的AKT通路下调血管内皮细胞上PD-L1的表达,从而提高肿瘤内CD8+/Foxp3的比值,抑制肿瘤生长,改善免疫微环境;YANG等[24]的研究提示安罗替尼增强了先天性免疫细胞(NK细胞、M1型肿瘤相关巨噬细胞、树突状细胞等)的浸润,协同PD-1免疫抑制剂发挥抗肿瘤作用。一项安罗替尼联合信迪利单抗一线治疗NSCLC患者的临床试验数据表明,患者具有较高的ORR(72.7%)和DCR(100.0%),12个月PFS达74.7%[25]。未来随着大样本、前瞻性研究的进一步开展,安罗替尼单药或联合其他治疗等多种新型治疗模式或将为患者带来更大的生存获益。
