2-脱氧葡萄糖修饰共载siPD-L1及替莫唑胺脂质纳米粒的脑靶向性研究
2024-01-23罗静远周四元刘道洲
罗静远,杨 静,李 雪,周四元,刘道洲
(空军军医大学药学系药剂学与药事管理学教研室,陕西 西安 710032)
胶质母细胞瘤(glioblastoma,GBM)是最常见的脑部原发性肿瘤,占颅内肿瘤的35%~61%[1-2]。GBM侵袭能力强,在周围正常脑组织浸润生长,导致GBM组织与周围正常脑组织无明显界限,具有病死率高、复发率高及治愈率低等特点[3-4]。替莫唑胺(temozolomide,TMZ)是第二代口服烷化剂,是目前治疗GBM最有效的化疗药物[5-6]。TMZ本身没有直接的抗GBM活性,只有水解为5-(3-甲基-三嗪-1-基)咪唑-4-甲酰胺[5-(3-methyltriazen-1-yl)imidazole-4-carboxamide,MTIC]后,才能发挥抗GBM作用。TMZ在血液循环中极易水解为MTIC,但是MTIC几乎不能通过血脑屏障[7-8]。另据报道,GBM细胞程序性细胞死亡蛋白-配体1(programmed cell death 1 ligand 1,PD-L1)高表达,与T细胞上程序性细胞死亡蛋白1结合后,能够抑制T细胞激活并减少T细胞分泌IFN-γ、IL-2等细胞因子,使GBM细胞逃避机体免疫监视和杀伤,促进GBM的生长[9-10]。因此,当采用特定序列的PD-L1特异的siRNA(siPD-L1)抑制GBM细胞PD-L1的表达,就能够增强机体自身免疫系统对GBM的杀灭,与TMZ发挥协同作用。但是siPD-L1在血液循环中不稳定[11-12]。因此,提高TMZ和siPD-L1在血液循环中的稳定性,增加它们在脑内的蓄积,是TMZ和siPD-L1发挥协同作用的关键。
脑组织需要大量的营养物质维持正常的生理功能,脑毛细血管内皮细胞表面的各类转运体可以介导这些营养物质进入脑组织[13-14]。研究显示,在脑毛细血管内皮细胞表面大约存在30种不同营养物质的转运体,用来运送糖类、氨基酸等营养物质进入脑组织。因此,直接将药物制成氨基酸和糖的类似物,或在纳米粒表面修饰氨基酸或糖类,就可以在脑毛细血管内皮细胞表面特异性转运体的介导下穿过血脑屏障,到达病灶部位,实现药物的脑内靶向递送[15-16]。基于此,我们采用2-脱氧葡萄糖(2-deoxy-D-glucose,2-DG)修饰脂质纳米粒,共载siPD-L1和TMZ,以期提高siPD-L1和TMZ在血液循环中的稳定性及其在脑组织的分布,提高siPD-L1和TMZ治疗GBM的效果[17]。本文通过研究2-DG修饰共载siPD-L1及TMZ脂质纳米粒(TMZ/siPD-L1@GLPN)给药后,TMZ在血浆中的消除动力学以及在小鼠脑内的分布动力学,旨在阐明2-DG修饰对脂质纳米粒脑靶向性的影响,为脑靶向递药系统的设计提供依据。
1 材料与方法
1.1 材料
1.1.1 实验仪器 电子天平(AL104型,梅特勒-托利多仪器有限公司);高效液相色谱(high performance liquid chromatography,HPLC,2695/2996,美国Waters公司);活体成像仪(Caliper IVIS Lumina Ⅱ,美国Caliper Life Sciences公司);摩尔超纯水机(1810D型,上海摩勒科学仪器有限公司);低温离心机(5427R型,德国Eppendorf公司);恒温磁力搅拌器(GL-325B型,海门市其林贝尔仪器制造有限公司)。
1.1.2 实验试剂 胆固醇、TMZ(Lot:FCB055744)、二油酰磷脂酰乙醇胺(1,2-dioleoyl-sn-glycero-3-phosphoethanolamine,DOPE)等购自北京百灵威科技有限公司;二硬脂酰基磷脂酰乙醇胺-聚乙二醇-琥珀酰亚胺购于上海炎怡生物技术有限公司;siPD-L1购自上海吉玛制药技术有限公司;PBS缓冲液、色谱甲醇、色谱乙腈、冰乙酸、2-DG等购自西安科昊生物工程有限责任公司;2-DG-PEG-DSPE、聚天冬氨酸-g-聚乙烯亚胺(PASP-g-PEI1800)由本课题组自行合成。TMZ/siPD-L1@GLPN和TMZ/siPD-L1@LPN的制备方法如下:取siPD-L1(330 μg)溶于2 880 μL HEPES(10 mmol/L,pH=7.4)缓冲溶液中,获得浓度为8.7 μmol/L的siPD-L1溶液;称取2 mg PASP-g-PEI1800连接物,溶于1 mL HEPES(10 mmol/L,pH=7.4)缓冲溶液中,配制成浓度为4.5 μmol/L的PASP-g-PEI1800溶液。取配制好的siPD-L1和PASP-g-PEI1800溶液各125 μL,混匀,涡旋30 s,室温放置30 min,制备氮磷比(N/P)为9的siPD-L1聚合物纳米粒(siPD-L1@PASP-g-PEI1800)。称取DOPE 31.6 mg、胆固醇5.4 mg、2-DG-PEG-DSPE 21.0 mg,加入2 mL氯仿/甲醇(V/V=3∶1)的混合溶液,溶解后35 ℃减压旋转蒸发移除氯仿/甲醇溶液,使其形成均匀薄膜。将N/P=9的siPD-L1@PASP-g-PEI1800(2 mL,包含siPD-L1 50 μg)以及饱和TMZ水溶液(2 mL)加入到脂质薄膜中,室温下搅拌过夜,超声1 min,随即将脂质纳米粒转移到截留Mr为1 000的透析袋中,在蒸馏水中透析2 h,每0.5 h更换一次蒸馏水,于-80 ℃冰箱中放置24 h,冷冻干燥24 h,即得共载siPD-L1与TMZ的脂质纳米粒TMZ/siPD-L1@GLPN固体粉末。采用PEG-DSPE制备没有2-DG修饰的脂质纳米粒TMZ/siPD-L1@LPN。
1.1.3 实验动物 昆明小鼠购自空军军医大学实验动物中心,所有动物实验符合动物伦理要求,并通过空军军医大学实验动物福利与伦理委员会批准(许可证号:KY20194106)。
1.2 方法
1.2.1 色谱条件 色谱柱为ODS-C18柱(250 mm×4.6 mm,5 μm,Dikma),检测波长为329 nm,流动相为甲醇/水(1 mL/L醋酸溶液)=20/80(V/V),流速1.0 mL/min,进样量10 μL,柱温为室温。
1.2.2 小鼠血浆及组织样品的处理 ①血浆样品的处理:小鼠尾静脉注射给药后,在预定时间点摘除眼球取全血,并加入肝素钠抗凝,于室温条件下5 000g离心5 min,吸取上清液300 μL,加入到2 mL离心管中,加入300 μL乙腈沉淀蛋白,涡旋30 s后,于12 000g、4 ℃条件下离心15 min,取上清液,过0.22 μm滤膜,取10 μL注入HPLC系统,测定血浆样品中TMZ的浓度。②组织样品的处理:小鼠尾静脉注射给药后,在预定时间点处死小鼠,获取小鼠脑、心、肝、脾、肺、肾等器官组织,称取组织质量,向每个组织中加入1 mL生理盐水(肝脏加入2 mL),匀浆后取匀浆液500 μL,加入500 μL乙腈沉淀蛋白,涡旋30 s后,于12 000g、4 ℃条件下离心15 min,取上清液,过0.22 μm滤膜,取10 μL注入HPLC系统,测定组织样品中TMZ的浓度,最终计算出每克组织中TMZ的含量。
1.2.3 方法学验证
1.2.3.1 专属性实验 获取小鼠的空白血浆及脑组织匀浆液,加入一定量的TMZ溶液,按照“1.2.2”方法处理血浆样品和脑组织匀浆液样品,按“1.2.1”液相条件进样,记录色谱图。
1.2.3.2 标准曲线的绘制 准确称取TMZ 30 mg,充分溶解后加入到50 mL容量瓶中,加入蒸馏水定容至刻度线。吸取不同体积的上述TMZ溶液,加入蒸馏水稀释成5、10、50、100、200、500 mg/L的标准溶液。吸取900 μL空白血浆及各组织匀浆液,加入TMZ标准溶液100 μL,涡旋30 s,配制成浓度为0.5、1.0、5.0、10.0、20.0、50.0 mg/L的含药血浆、脑、心、肝、脾、肺及肾组织匀浆液,按照“1.2.2”方法处理血浆样品和各组织匀浆液样品,按“1.2.1”液相条件进样,获取峰面积,以峰面积(Y)作为纵坐标,TMZ浓度(X)作为横坐标,进行线性回归,绘制血浆及脑、心、肝、脾、肺、肾组织匀浆液中检测TMZ的标准曲线,计算回归方程。
1.2.3.3 精密度实验 量取TMZ标准溶液,加入空白血浆、脑、心、肝、脾、肺及肾组织匀浆液,涡旋30 s,配制成浓度分别为2、11、40 mg/L的含药样品,按照“1.2.2”方法处理血浆样品和组织样品,按“1.2.1”液相条件进样,获取峰面积,根据标准曲线方程,计算TMZ浓度。1 d内间隔相同时间后,重复上述操作3次,计算方法的日内精密度;连续3 d在相同时间点重复上述操作,计算方法的日间精密度。
1.2.3.4 回收率实验 量取TMZ标准溶液,加入空白血浆、脑、心、肝、脾、肺及肾组织匀浆液,涡旋30 s,配制成浓度分别为2、11、40 mg/L的含药样品,按照“1.2.2”方法处理血浆及各组织匀浆液样品,按“1.2.1”液相条件进样,获取峰面积,根据标准曲线方程计算TMZ浓度,计算分析方法的回收率。
1.2.4 血浆及组织样品中TMZ含量测定 将小鼠分成3组,分别尾静脉注射游离TMZ、TMZ/siPD-L1@GLPN及TMZ/siPD-L1@LPN,每组中TMZ的给药剂量均为50 mg/kg,于给药后1、5、15、30 min及1、2、4、8、12、24 h,摘除眼球取小鼠全血,并加入肝素钠抗凝,处死小鼠后获取脑、心、肝、脾、肺、肾,按照“1.2.2”方法处理血浆样品和组织样品,按“1.2.1”液相条件进样,获取峰面积,代入标准曲线,求取各时间点血浆及脑、心、肝、脾、肺、肾内的TMZ含量。
1.2.5 活体成像观察脂质纳米粒在正常体内的分布 取正常小鼠,尾静脉注射Cy7.5标记的TMZ/siPD-L1@GLPN以及Cy7.5标记的TMZ/siPD-L1@LPN,在12、24 h后,用异氟烷麻醉小鼠,采用活体成像仪观察脂质纳米粒在小鼠体内的分布。
2 结果
2.1 TMZ检测的HPLC方法学验证
2.1.1 专属性实验 专属性实验结果显示,在实验设定的色谱条件下,TMZ的保留时间约为4.3 min,血浆以及脑匀浆液基质对TMZ的测定无干扰,提示建立的HPLC方法专属性良好(图1)。
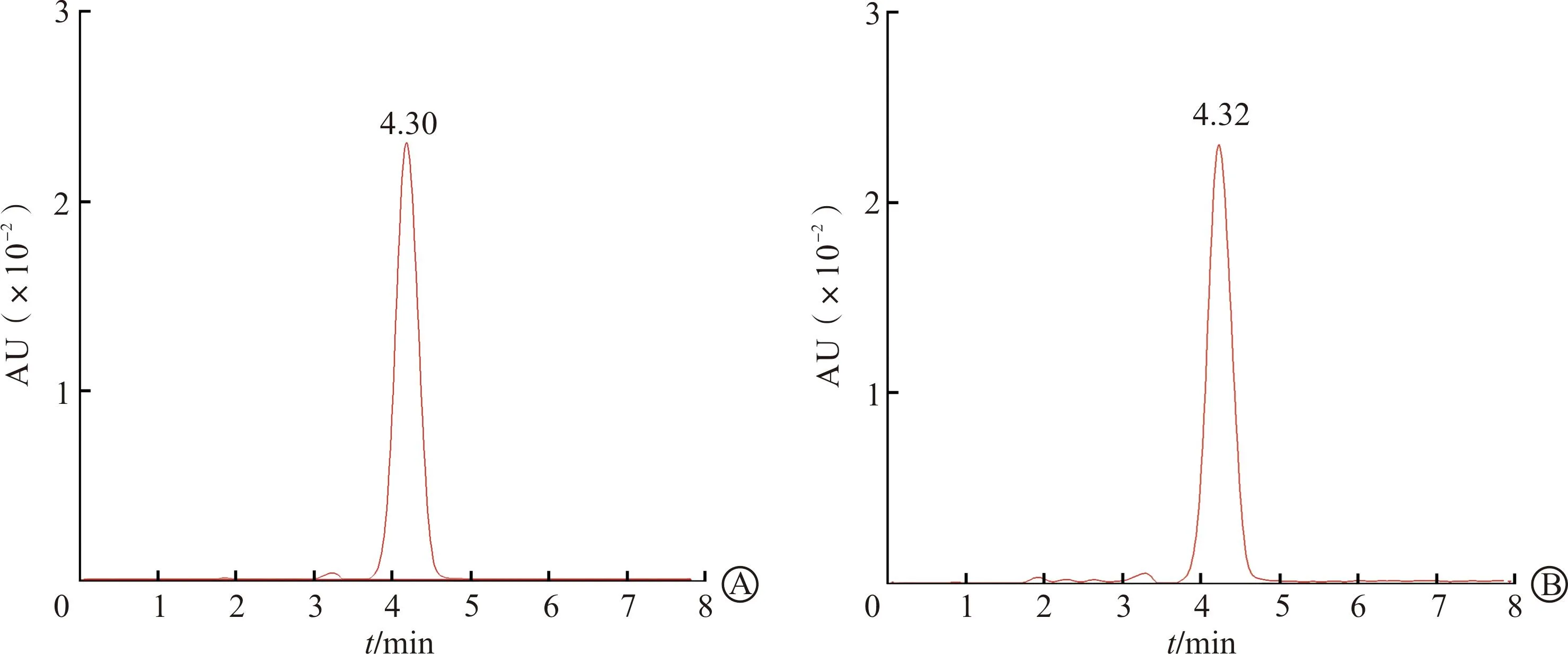
A:含TMZ血浆;B:含TMZ脑组织匀浆液。TMZ:替莫唑胺。图1 血浆以及脑组织匀浆液中TMZ的高效液相色谱图
2.1.2 标准曲线的绘制 根据峰面积,以峰面积(Y)作为纵坐标,TMZ浓度(X)作为横坐标,进行线性回归,绘制血浆及脑、心、肝、脾、肺、肾组织匀浆液中检测TMZ的标准曲线,计算回归方程。在实验设定的浓度范围内,峰面积与TMZ浓度之间线性关系良好(表1)。

表1 血浆及不同组织匀浆液中TMZ检测标准曲线及线性范围
2.1.3 精密度实验 精密度实验结果显示,检测高、中、低3个TMZ浓度,其日内精密度以及日间精密度的相对标准差(relative standard deviation,RSD)均小于5%,表明测定方法精密度良好,符合新药临床前研究要求(表2)。
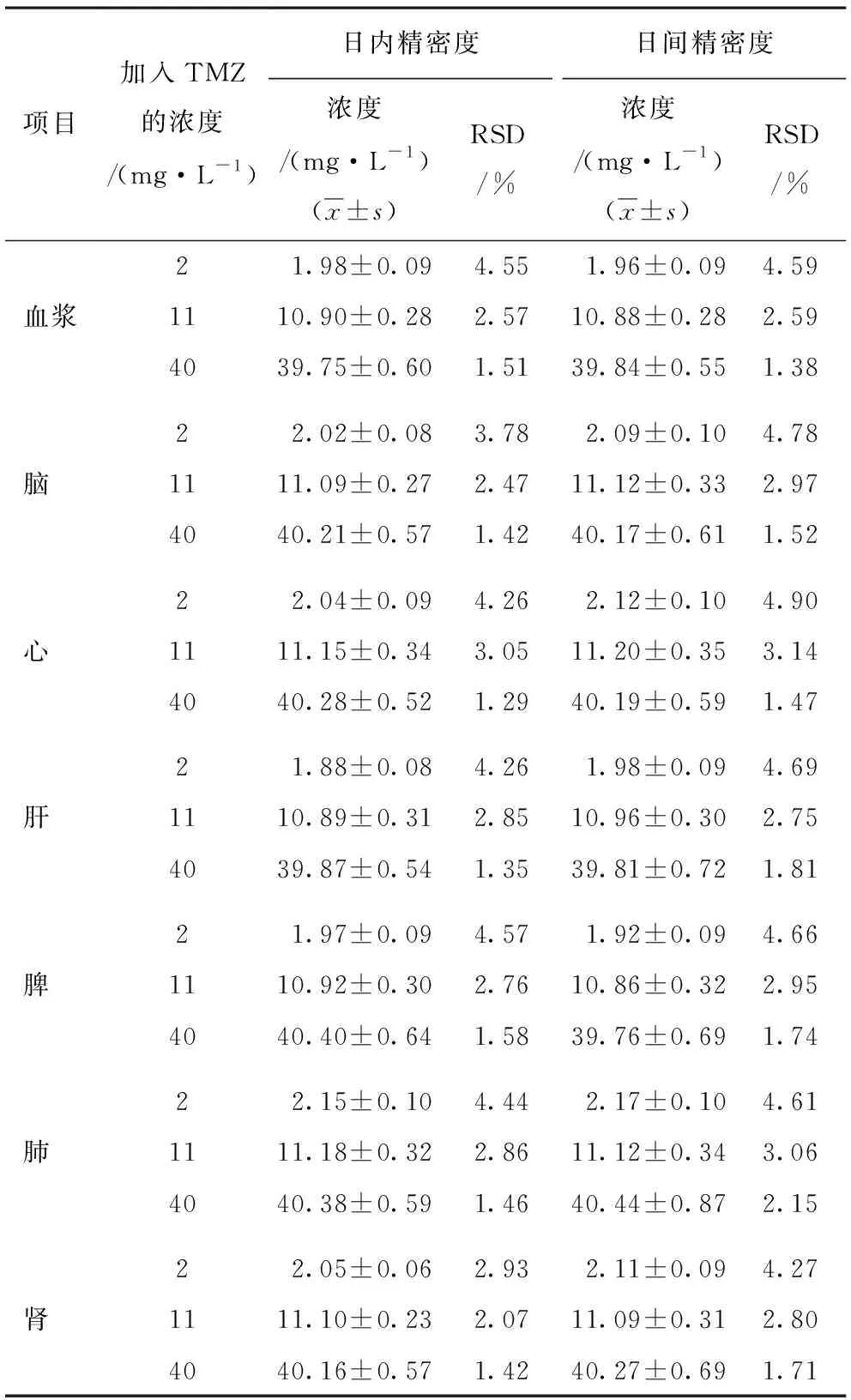
表2 HPLC测定血浆及不同组织匀浆液中TMZ的日内精密度和日间精密度(n=3)
2.1.4 回收率实验 回收率实验结果显示,检测高、中、低3个TMZ浓度的回收率大于98%,小于103%,RSD均小于5%,符合新药临床前研究要求,能够用于TMZ含量测定(表3)。
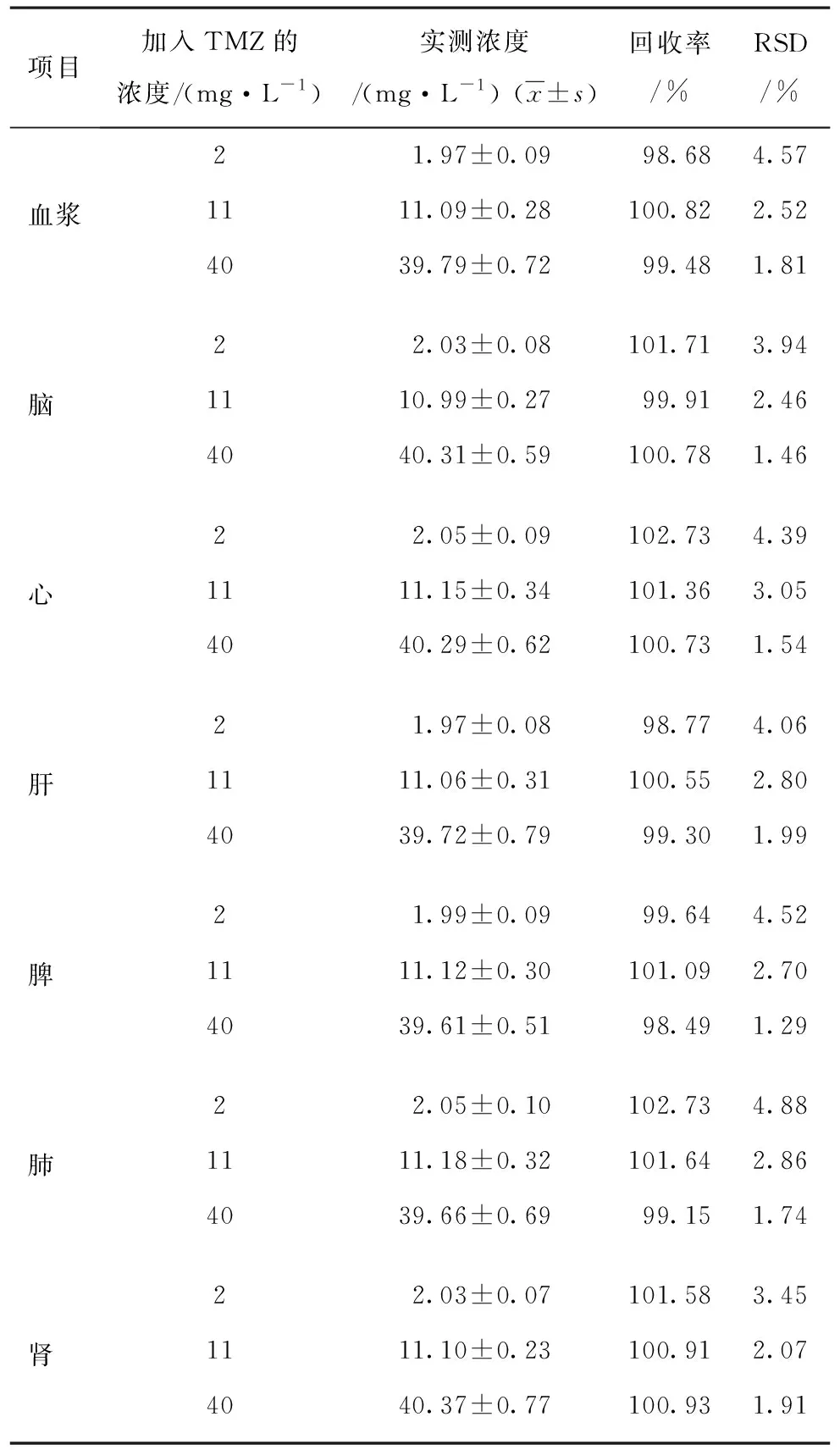
表3 HPLC测定血浆及不同组织匀浆液中TMZ的回收率(n=3)
2.2 血浆及组织样品中TMZ含量测定
TMZ在小鼠体内血药浓度随时间变化的曲线显示,相较于游离TMZ,小鼠尾静脉注射TMZ/siPD-L1@GLPN和TMZ/siPD-L1@LPN后,TMZ的消除速度明显减慢,TMZ在血液中的循环时间显著延长(图2)。

TMZ:替莫唑胺;PD-L1:程序性细胞死亡蛋白-配体1;siPD-L1:PD-L1特异的图2 尾静脉注射TMZ、TMZ/siPD-L1@GLPN和TMZ/siPD-L1@LPN后,小鼠血浆中TMZ浓度时间变化曲线
给予游离TMZ、TMZ/siPD-L1@LPN和TMZ/siPD-L1@GLPN后,TMZ在小鼠脑、心、肝、脾、肺、肾等组织内的分布结果显示,小鼠静脉注射游离TMZ后,TMZ能够迅速分布于脑组织;小鼠静脉注射TMZ/siPD-L1@LPN和TMZ/siPD-L1@GLPN后,TMZ进入脑组织的速度减慢;与游离TMZ和TMZ/siPD-L1@LPN相比,TMZ/siPD-L1@GLPN能显著提高TMZ在脑组织内的蓄积。尾静脉注射TMZ、TMZ/siPD-L1@LPN和TMZ/siPD-L1@GLPN后,血浆及脑、心、肝、脾、肺、肾等组织中TMZ浓度-时间曲线下面积(area under the curve,AUC)如表4所示,与游离TMZ相比,TMZ/siPD-L1@GLPN能够显著提高TMZ在血浆及脑组织内的AUC,且效果显著优于TMZ/siPD-L1@LPN。以上结果表明TMZ/siPD-L1@GLPN能够增加TMZ在血液中的循环时间,增加TMZ在脑组织内的分布及滞留。

表4 小鼠尾静脉注射TMZ、TMZ/siPD-L1@LPN及TMZ/siPD-L1@GLPN后TMZ在各组织内的AUC
2.3 活体成像仪观察脂质纳米粒在正常体内的分布
取正常小鼠,尾静脉注射Cy7.5标记的TMZ/siPD-L1@GLPN以及Cy7.5标记的TMZ/siPD-L1@LPN,在12、24 h后,异氟烷麻醉小鼠,采用活体成像仪观察脂质纳米粒在小鼠体内的分布。结果显示,TMZ/siPD-L1@LPN几乎不能穿过血脑屏障,在12 h和24 h时,仅有很少量的脂质纳米粒在脑组织内蓄积;而TMZ/siPD-L1@GLPN在脑组织内的蓄积明显增多,在12 h时荧光强度达到6.83×107,且24 h后,在脑部仍旧能观察到TMZ/siPD-L1@GLPN在脑组织内的蓄积,荧光强度为2.35×107(图3)。小鼠被处死后,将脑、心、肝、脾、肺、肾等器官组织取出,活体成像仪观察纳米粒在小鼠各器官组织的蓄积。结果显示,TMZ/siPD-L1@GLPN在脑组织内能够大量蓄积,蓄积量显著高于TMZ/siPD-L1@LPN给药组(P<0.01,图4)。以上结果表明,TMZ/siPD-L1@GLPN不仅能高效跨血脑屏障转运,而且能够在脑组织中滞留较长时间。
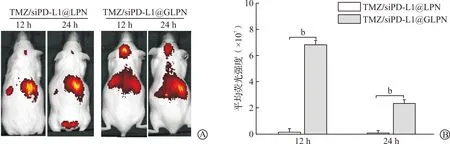
A:TMZ/siPD-L1@GLPN及TMZ/siPD-L1@LPN在小鼠体内分布的活体成像观察结果;B:脑组织内平均荧光强度统计结果。TMZ:替莫唑胺;PD-L1:程序性细胞死亡蛋白-配体1;siPD-L1:PD-L1特异的图3 TMZ/siPD-L1@GLPN及TMZ/siPD-L1@LPN在正常小鼠体内的分布
3 讨论
TMZ是目前治疗GBM最为有效的化疗药物,但是TMZ在血液循环中极易水解为MTIC,MTIC几乎不能通过血脑屏障,从而极大地降低了TMZ在脑内的蓄积。本研究以2-DG-PEG-DSPE、胆固醇及DOPE等构成的脂质薄膜为外层壳,采用前期合成的新型阳离子聚合物PASP-g-PEI1800压缩siPD-L1,采用薄膜分散法将siPD-L1及TMZ共同负载在脂质纳米粒TMZ/siPD-L1@GLPN中。研究结果显示,相较于游离TMZ,TMZ/siPD-L1@LPN及TMZ/siPD-L1@GLPN均可以降低TMZ的水解,从而减慢TMZ在体内的清除,显著提升TMZ在血液中的循环时间。
研究显示,DOPE是一种常用的助磷脂,在制备阳离子脂质体过程中具有很强的协同作用。DOPE能够干扰类脂膜,降低内涵体膜的稳定性,并增加脂质纳米粒与质膜的融合,从而使脂质纳米粒从内涵体逃逸[18]。前期研究结果显示,TMZ/siPD-L1@GLPN能够从溶酶体高效逃逸,将包裹在脂质纳米粒内的药物释放到细胞浆内[17]。由于血脑屏障的存在,大多数药物难以进入到脑组织[19-20]。我们前期研究结果显示,脑毛细血管内皮细胞表面,葡萄糖转运体-1高表达[17],因此,HPLC及活体成像仪检测结果显示,相较于TMZ/siPD-L1@LPN,TMZ/siPD-L1@GLPN在小鼠脑组织内蓄积及滞留时间显著延长,表明2-DG修饰可以显著增加脂质纳米粒的脑靶向性,从而更好地发挥抗GBM活性。
