RPA-毛细管电泳检测人腺病毒55型的方法建立及初步应用
2024-01-23袁若栋董阳超武福星袁明城薛智丰张海军张欠欠雷迎峰高小朋
袁若栋,董阳超,武福星,段 甜,薛 潘,张 剑,袁明城,薛智丰,张海军,张欠欠,雷迎峰,高小朋
(1延安大学生命科学学院,陕西 延安 716000;2空军军医大学基础医学院病原生物学与微生物学教研室,陕西 西安 710032)
腺病毒主要有A~G 7个血清学组,是导致人呼吸道感染的重要病原体。人腺病毒(human adenovirus,HAdV)现有100多个亚型,临床主要表现为发热、呼吸系统疾病、肠胃炎和结膜炎,在低免疫功能患者中,可能会导致呼吸衰竭,出现弥漫性感染、血性膀胱炎,引起神经系统疾病,甚至会导致死亡[1]。HAdV55属于B血清组,是HAdV11和HAdV14的重组体,我国最早从2006年陕西省岐山县暴发的疫情中分离获得[2]。HAdV55主要通过飞沫传播,感染后易出现急性呼吸道感染症状,例如发热、咳嗽、头痛、咽喉肿痛、支气管炎、肺炎、肝炎等,可发展成为重症肺炎[3]。HAdV的主要易感人群是婴儿、学生、新兵和免疫功能低下的患者[4-5]。目前临床上尚无针对腺病毒的特异治疗药物,多采用对症治疗。因此,早期诊断是HAdV55型防控的重点。
目前关于HAdV55的检测方法,主要包括病毒分离培养、鼻黏膜上皮脱落细胞直接免疫荧光检测病毒抗原、血清学检测和分子生物学方法[6]。前三种方法过程繁琐、耗时长,不适合早期诊断,聚合酶链反应(polymerase chain reaction,PCR)等分子生物学方法具有快速灵敏等优势,在临床检测中备受青睐[7]。但现有传统检测方法还只是基于Hexon基因部分序列进行分子分型的做法,主要是对各类临床样本进行核酸提取,设计相应引物,采用PCR进行检测,虽然市面上也已出现大量呼吸道病原体检测试剂盒,但无特异性针对HAdV55的检测试剂盒。而传统的PCR扩增检测技术,通过特异性引物对DNA片段进行体外扩增,包括巢式PCR、探针法和染料法实时荧光定量PCR等,这些技术具有高灵敏度、高特异性,技术较为成熟,适合早期临床诊断,但对实验条件、试剂成本、工作人员的技术要求高。基于基因芯片和基因测序技术在腺病毒检测方面也有报道[8-10],LI等[11]就采用了可获得更高的序列准确性的高通量测序:将纳米孔测序技术和华大基因平台应用于2019年5月中国湖北省HAdV55暴发的鉴定和基因组分析,但这两种主要适用于复杂感染情况下的鉴别诊断,且技术成本昂贵、复杂,检测灵敏度低,尚未在临床诊断HAdV55中广泛应用[12]。重组酶聚合酶扩增(recombinase polymerase amplification,RPA)技术是一种可以替代传统的PCR核酸探测技术,即在单链结合蛋白和链置换DNA聚合酶的参与下,利用重组酶进行恒温核酸扩增。该技术能够在15 min内进行常温条件下的单分子核酸检测[13]。毛细管电泳技术与核酸扩增技术联合使用已经在多种病原体检测中显现出明显优势[14]。
本研究以HAdV55为研究对象,利用RPA等温扩增技术,针对Hexon基因筛选特异高效的RPA引物,建立了快速、特异检测HAdV55的RPA-毛细管电泳的方法,并对该方法进行优化和评价。
1 材料与方法
1.1 材料
1.1.1 病原样本和临床样本 本试验所使用的临床常见的呼吸道病毒核酸标准品,包括人冠状病毒(human coronavirus,HCoV;HCoV-229E、HCoV-OC43、HCoV-HKU1)、甲型和乙型流感病毒(influenza A/B virus,FluA/B)、副流感病毒(parainfluenza virus,PIV)、呼吸道合胞病毒(respiratory syncytial virus,RSV)、腺病毒(HAdV3、HAdV4、HAdV7、HAdV16、HAdV21、HAdV55),均保存于本实验室。实验中使用的咽拭子样本来自空军军医大学西京医院检验科。
1.1.2 主要试剂和仪器 Epoch酶标仪、质粒小提试剂盒、病毒DNA提取纯化试剂盒采购于天根生化科技有限公司,TwistAmpTM试剂盒购自南京沃博生物科技有限公司,多槽扩增仪购自杭州柏恒科技有限公司,QlAxcel毛细管电泳仪购自凯杰生物公司。
1.2 方法
1.2.1 引物设计与合成 根据HAdV55-Hexon保守部分基因序列,利用SnapGene软件,设计RPA引物,交由擎科生物工程股份有限公司合成。
1.2.2HAdV55-Hexon质粒构建 根据美国国家生物技术信息中心网站搜索到的HAdV55的Hexon基因序列,位于腺病毒全基因组的19 000 bp附近,长度为2 874 bp,合成HAdV55的Hexon基因,在基因两端加入EcoR Ⅰ &SalⅠ酶切位点,经EcoR Ⅰ和SalⅠ双切后与经EcoR Ⅰ和XhoⅠ双切pCAGGS载体连接,即获得HAdV55-Hexon质粒。
1.2.3 病毒DNA提取 按照TIANGEN磁珠法提取病毒DNA试剂盒的操作说明,从临床HAdV55患者的咽拭子中提取病毒DNA,-80 ℃保存备用。
1.2.4 RPA反应体系和条件 本反应使用TwistAmpTM试剂。将RPA冻干酶粉反应管置于冰上,加入溶解性缓冲液29.5 μL、上下游引物(10 mol/L)各2.4 μL、核酸模板13.2 μL(模板量不低于1 000 copies/mL)等能充分混合均匀,并加入280 mmol/L的醋酸镁溶液2.5 μL,共50 μL。在把上述反应液分配好后,立即放入恒温扩增仪,并选取39 ℃的反应温度和20 min的反应时间。
1.2.5 RPA扩增产物的毛细管电泳分析 选择高分辨率卡夹(SKC105102)。Alignment Marker选择MA1(C109100),Size Marker选择MA2(C109200),样本注入电压4 kV 10 s,分离压6 kV 330 s(最佳分辨率2~4 bp)。将RPA扩增产物进行毛细管电泳,操作过程按照设备说明书进行。
1.2.6 引物筛选 根据RPA引物设计原则,比对了常见腺病毒的Hexon区域,针对HAdV55-Hexon基因的保守区[15],设计四对长度不同引物,扩增位置位于HAdV55-Hexon基因的1 211~1 329 bp处。扩增长度约为118 bp,以HAdV55-Hexon质粒为模板,分组进行RPA检测,筛选较优引物组合(表1)。

表1 靶向HAdV55-Hexon基因的RPA扩增引物核苷酸序列
1.2.7 特异性试验 应用上述筛选最优的引物建立的RPA-毛细管电泳的方法,对本实验室保存的HAdV3、HAdV4、HAdV7、HAdV16、HAdV21、HCoV-229E、HCoV-OC43、HCoV-HKU1、FluA/B、PIV、RSV等标准品核酸模板进行检测,对RPA-毛细管电泳进行特异检测,采用HAdV55-Hexon质粒标准品为阳性对照,无核酸酶水为阴性对照。
1.2.8 灵敏度试验 将HAdV55-Hexon质粒标准品稀释为10-10~10-4的7个梯度作为模板进行RPA扩增,每管反应体系取20 μL进行毛细管电泳,由此可以判断这种方法的最低检测极限。同时,参照张然等[16]建立的AdV实时荧光PCR算法,对两种方法的灵敏度进行了平行检测。
1.2.9 重复性试验 选取HAdV55-Hexon质粒标准品3个稀释梯度(10-3、10-2、10-1)作为模板,利用已建立的RPA-毛细管电泳进行检测,对反应系统的稳定性进行3次重复检测和分析。
1.2.10 临床样品检测 应用建立的方法对来自空军军医大学西京医院HAdV55患者的咽拭子样品进行测试,设置HAdV55-Hexon质粒标准品为阳性对照,ddH2O作为阴性对照,同时采用张然等[16]建立的实时荧光PCR方法测试,比对分析两种方法的一致性。
2 结果
2.1 HAdV55-Hexon质粒的鉴定结果
Hexon基因的PCR产物经EcoR Ⅰ和SalⅠ双切后与同样双切的pCAGGS载体连接,获得HAdV55-Hexon质粒,PCR鉴定正确的质粒经酶切分析,并由擎科生物工程有限公司合成并测序,电泳结果显示,经双切的质粒,Hexon约为2 874 bp,载体大小约为5 000 bp,未经双切的质粒大小约为7 874 bp,与预期片段大小一致(图1)。

M:Marker标准品;1:经双酶切的HAdV55-Hexon质粒,目的片段大小;2:未经酶切的HAdV55-Hexon质粒。图1 HAdV55-Hexon质粒鉴定的电泳分析
2.2 引物的筛选
选择稀释度10-10~10-4的7个HAdV55-Hexon质粒标准品作为模板,分别使用不同引物进行RPA-毛细管电泳。结果表明,引物F2-R2扩增效率最高,产生非特异性条带最少,其他三对引物条带扩增不稳定,出现非特异性条带(图2)。

A:用引物F1-R1扩增稀释度为10-10~10-4的HAdV55-Hexon的阳性质粒,条带大小在118 bp附近,与目的条带大小均一致,但条带之间差异性较大;B:用引物F2-R2扩增稀释度为10-10~10-4的HAdV55-Hexon的阳性质粒,条带均在118 bp附近,与目的条带大小均一致,条带之间bp差值很小;C~D:用引物F3-R3、F4-R4扩增稀释度为10-10~10-4的HAdV55-Hexon的阳性质粒,条带与目的条带大小均不相符,出现大量引物二聚体。NC:阴性对照。图2 F1-R1、F2-R2、F3-R3、F4-R4扩增产物毛细管凝胶成像图
2.3 特异性实验
以未稀释的HAdV55-Hexon质粒、HAdV55质粒标准品和常见HAdV3、HAdV4、HAdV7、HAdV16、HAdV21、HCoV-229E、HCoV-OC43、HCoV-HKU1、FluA/B、PIV、RSV的标准品,应用建立的RPA联合毛细管电泳方法扩增及检测。结果显示,HAdV55-Hexon质粒标准品和HAdV55质粒标准品均出现了典型的目的条带,目的片段大小与预期相符;其他呼吸道病原核酸样本和空白对照均未出现与目的大小相符的条带(图3)。表明本方法特异性较强,能准确检测到HAdV55,与其他病原核酸无交叉反应,与试验设计相符。

以HAdV3、HAdV4、HAdV7、HAdV16、HAdV21、HCoV-229e、HCoV-NL63、HCoV-OC43、HCoV-HKU1、FluA/B、RSV、PIV、HAdV55、HAdV55-Hexon标准品为扩增对象,无酶水为阴性对照,应用建立的RPA联合毛细管电泳方法扩增及检测。NC:阴性对照;PC:阳性对照;RPA:重组酶聚合酶扩增。图3 特异性实验测定试验的电泳凝胶成像图谱
2.4 灵敏度实验
试验中HAdV55-Hexon阳控质粒标准品初始浓度为2.9×1011copies/mL,由拷贝数的计算方法(6.02×1023copies/mol)×(质粒浓度g/mL)/(质粒碱基数×660 g/mol)将质粒的质量转换为拷贝数(copies/mL)。选择HAdV55-Hexon标准品7个稀释度10-10~10-4作为模板,使用建立的RPA联合毛细管电泳方法检测,结果显示,HAdV55-Hexon质粒标准品在稀释度为10-8时检测仍有目的条带检出,对应最低检测浓度为2.9×103copies/mL(图4A~B)。同时,使用张然等[16]建立的实时荧光定量PCR检测法开展检测,结果显示,HAdV55-Hexon标准品在稀释度为10-9、Cq<33时,荧光强度仍然超过阈值,可认为有目的基因检出,最低检测拷贝数为2.9×102copies/mL。虽然本研究建立的RPA-毛细管电泳方法比实时荧光定量PCR法低1个数量级的灵敏度,但由于RPA-毛细管电泳技术有其优势,全程只需要30 min即可完成,且不需要大规模设备,反应条件简单,检测时间不会超过荧光实时PCR时间的1/3,因而检测效率较高。
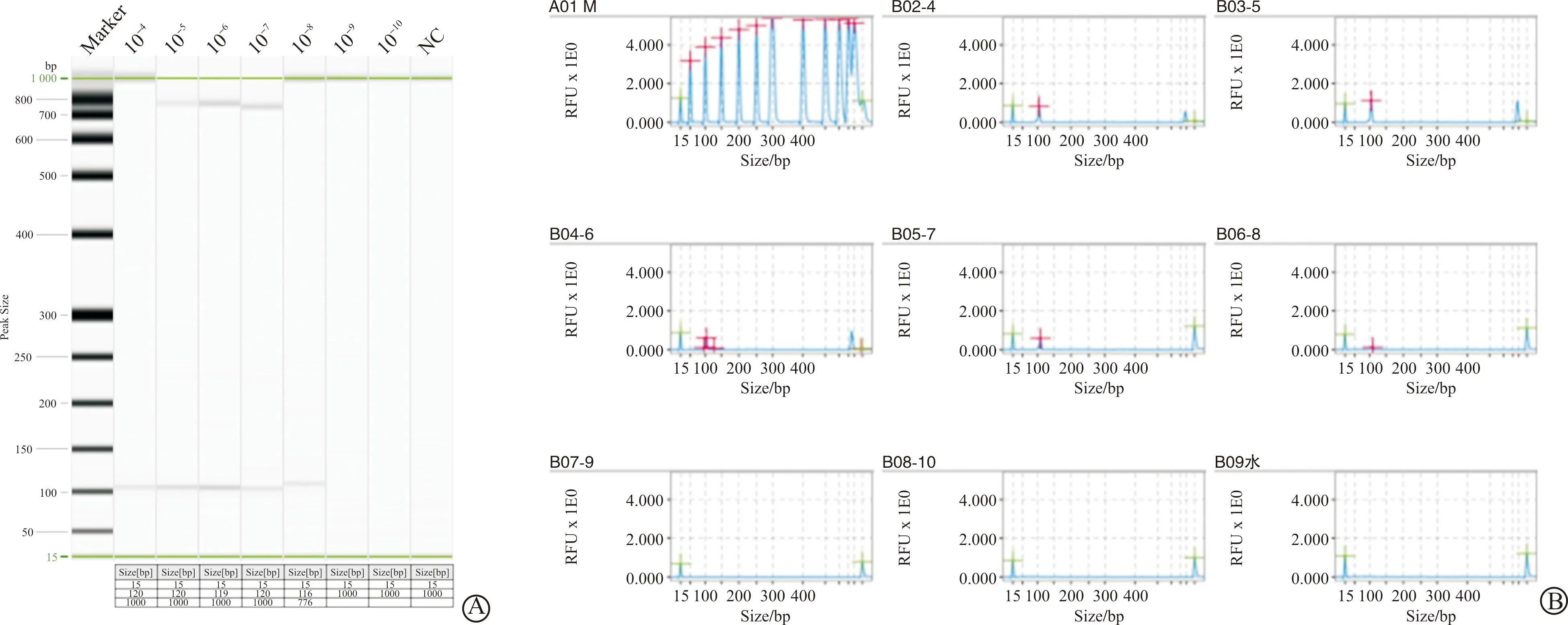
A:电泳凝胶成像图谱;B:灵敏度实验毛细管电泳信号图谱。PC:阳性对照;NC:阴性对照。图4 灵敏度实验
2.5 重复性实验
将浓度为2.9×1011copies/mL的HAdV55-Hexon质粒进行10-3、10-2、10-1梯度稀释后分别用RPA法重复检测3次,部分条带出现不一致的情况推测为反应体系存在不稳定情况,但差值很小,均可得到相应目的条带,相同模板检测结果基本一致,能表明本方法重复性能够满足检测需要(图5)。
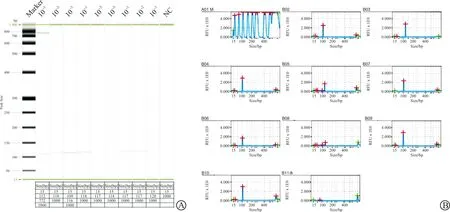
A:毛细管电泳凝胶成像图;B:毛细管电泳信号图谱:毛细管电泳的信号图谱纵坐标表示DNA吸光值,横坐标为条带大小,反映出在稀释度10-3、10-2、10-1均有条带检出,且与目的条带大小基本一致,第二泳道出现条带大小不稳定以及杂带是由于电泳仪对齐标记物的降解。NC:阴性对照。图5 重复性实验
2.6 临床样品检测
采用建立的RT-RPA方法和实时荧光PCR方法,对来自于西京医院检验科的18份灭活临床HAdV55型患者咽拭子临床样品进行检测,分别以HAdV55-Hexon质粒为阳性对照,无核酸酶水为阴性对照。结果显示,HAdV55有18份阳性核酸出现典型扩增,11号样本可能由于病毒滴度很低,提取的病毒核酸很少,条带不明显,但通过表格和信号图谱可以证明是有扩增的,以HAdV55阳控质粒为阳性对照,水为阴性对照,结果与实时荧量PCR法相符合(图6)。对未感染HAd55健康人类咽拭子进行建立的RPA-毛细管电泳与实时荧光PCR方法检测,结果显示均无检出,证明实时荧光PCR与建立的RT-RPA方法相符合。
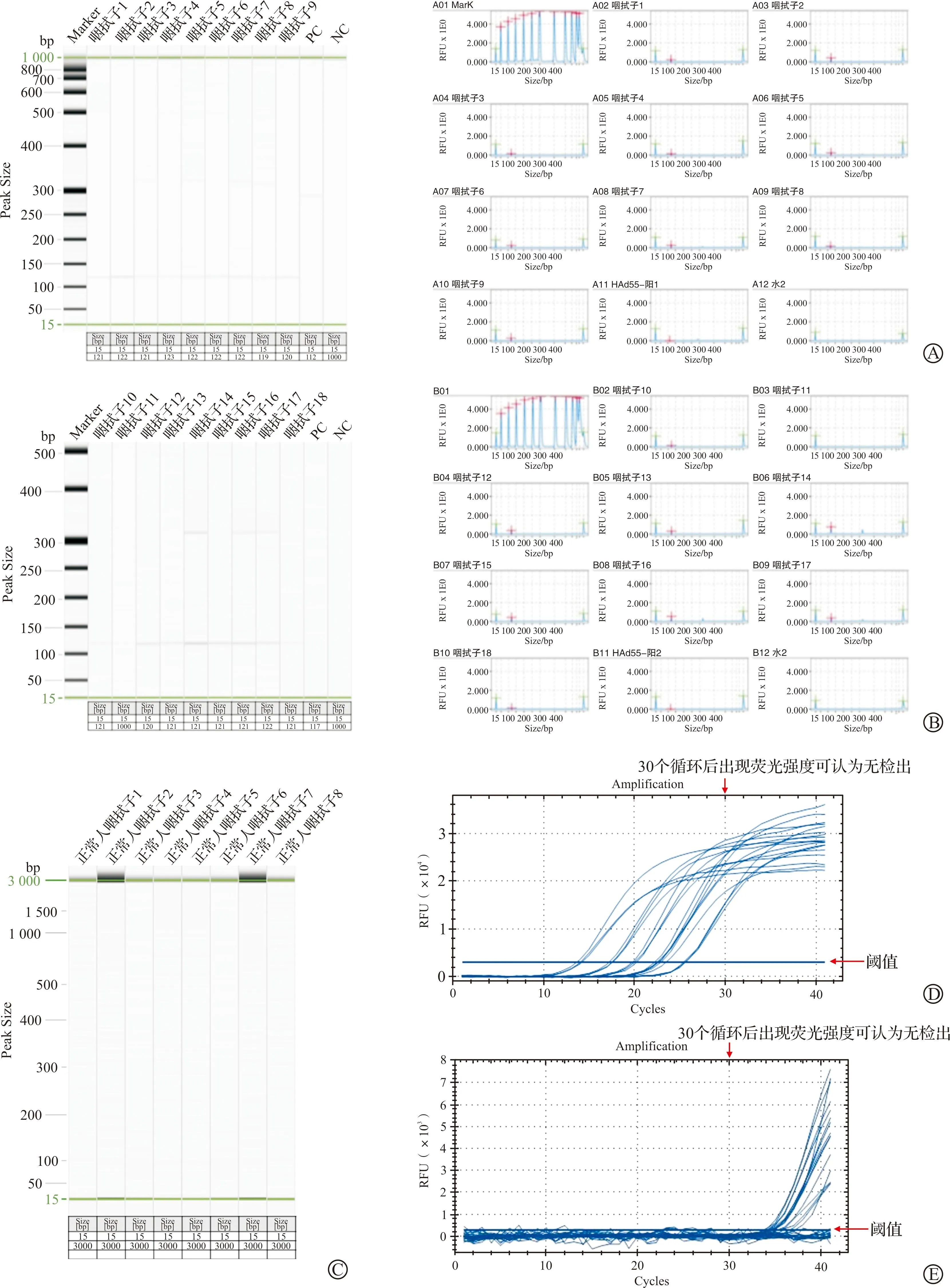
A~B:临床18份样本对应的毛细管电泳凝胶成像和信号图谱,对临床18份临床HAdV55型患者咽拭子采用建立的RPA方法检测,凝胶成像的条带和信号图谱的信号反映出的与目的条带大小均一致,可认为有HAdV55检出;C:对8份未感染HAdV55的健康人类咽拭子进行建立的RPA-毛细管电泳检测,均无检出;D:对临床18份HAdV55型患者咽拭子采用实时荧光PCR方法检测的Cq值和信号图谱,Cq<33时,均有荧光信号,可认为均有HAdV55检出;E:对8份未感染HAdV55的健康人类咽拭子进行实时荧光PCR方法检测,均无检出。RFU:相对荧光单位;NC:阴性对照;PC:阳性对照。图6 临床18份样本对应的毛细管电泳凝胶成像、信号图谱及实时荧光PCR Cq值和信号图谱
3 讨论
RPA是一种在恒温条件下,通过引物与目的片段相结合即可实现对核酸扩增实时监测的检测新技术[17]。在反应体系中加入目的片段及引物,可一步快速扩增DNA模板,总反应时间不超过15 min。结合毛细管电泳技术,可以直接在毛细管电泳仪中直接读取检测结果。本研究建立一种简便、快捷、准确的基于RPA-毛细管电泳检测HAdV55方法,最低检出限为2.9×103copies/mL,整个过程30 min即可完成。目前,RPA引物的设计尚无专门的程序[18],引物设计主要遵循以下原则[19]:5′末端3~5个核苷酸避免聚鸟嘌呤,最好是胞嘧啶,能促进重组;3′末端3个核苷酸为G或C有助于聚合酶的稳定性,而不要出现聚嘌呤和嘧啶;GC含量在30%~70%之间避免形成二级结构、发卡结构等;靶标区域应避开重复元件等。引物筛选的条件最好尽量模拟实际检测时的条件,例如模板的拷贝数、样本纯度等尽可能与实际样本类似。本研究对引物和探针的组合进行了试验筛选,建立了HAdV55 RPA联合毛细管电泳方法。结果显示,本研究建立的RPA联合毛细管电泳与常见呼吸道病毒核酸检测无交叉反应,且操作简便,特异性强;灵敏度比实时荧光定量PCR稍低,可检测HAdV55阳性核酸的最低拷贝数为2.9×103copies/mL。但荧光定量PCR必须经过变性、退火、延伸三个步骤,同时PCR核酸扩增仪本质上是控制温度升降的设备,而RPA反应的最适合温度在37~42 ℃之间,可在常温下进行,无需变性。这无疑能大大加快检测的速度。对RPA扩增产物不仅可以进行终点检测,还可以对扩增过程进行实时监控,甚至可以通过侧流层试纸条读取结果[20]。RPA检测灵敏度高,可扩增痕量核酸(特别是DNA)模板至可检测程度。此外,由于不需要温控设备,RPA可以真正实现便携式的快速核酸检测。本文所建立的HAdV55RPA-毛细管电泳方法比张然等[16]建立的荧量定量PCR法要低1个数量级,可能由于RPA扩增体系中的蛋白酶干扰。本文所建立的实时RPA联合毛细管电泳法,其反应过程简单,易于快速检测,无需复杂仪器和设备,反应时间短,不超过实时荧光PCR的1/3,两种方法检测结果一致,说明这种方式具有较强的实用性。
综上所述,本研究建立的检测HAdV55 RPA检测方法操作简单,反应灵敏,结果可靠,只依赖于毛细管电泳仪,为HAdV55感染的早期检测提供了技术支撑。
