异种实体器官移植亚临床研究中的突破与问题
2024-01-23杜嘉祥淮国丽邢向阳谢雨宣潘登科
刘 欣,杜嘉祥,淮国丽,邢向阳,谢雨宣,潘登科
(1电子科技大学医学院,四川 成都 610057;2四川省医学科学院·四川省人民医院,临床免疫转化医学四川省重点实验室,四川 成都 610072;3成都中科奥格生物科技有限公司,四川 成都 610094)
器官移植是治疗终末期器官功能衰竭的有效方法,挽救了大量器官衰竭患者的生命[1]。器官资源的短缺是器官移植的重要障碍,已成为全球性难题。异种器官来源尤其是猪来源器官被认为是潜在解决器官短缺问题的重要方式[2]。随着CRISPR/Cas9技术的快速发展,多基因编辑猪的培育更加快速高效,通过转入多种人源保护性蛋白,移植物存活时间得到延长[3]。目前,猪-非人灵长类动物(non-human primate,NHP)模型被广泛用于异种移植研究,且受体最长存活时间不断突破[4],其中异种心脏移植最长存活945 d,异种肾脏移植最长存活758 d(表1)。
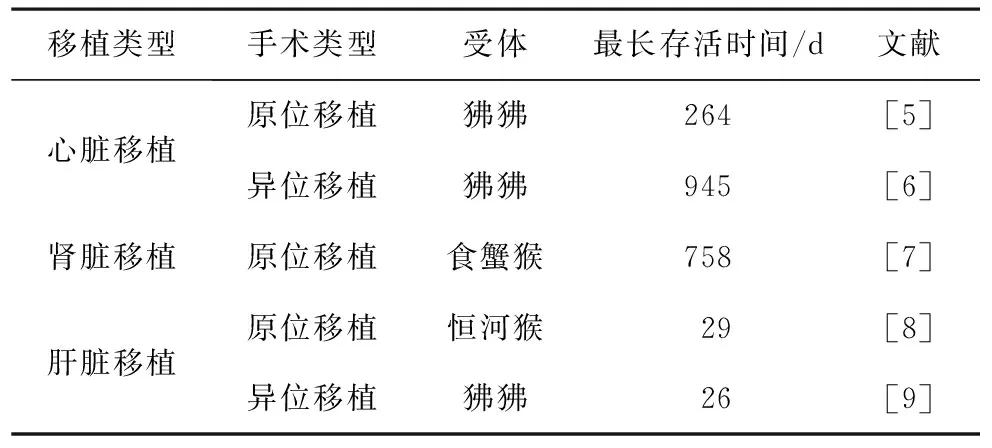
表1 NHP模型中受体最长存活时间
尽管猪-NHP的实验研究为异种移植进入临床阶段提供了重要的数据参考及经验指导,然而NHP和人类之间仍然存在一定差异[10],主要包括预存抗体种类、器官大小两方面。猿猴类是属于较高等的灵长类,根据分布和形态上的不同,猿猴的种类可以分为两大类:新世界猴(New World monkeys,NWM)和旧世界猴(Old World monkeys,OWM)[11]。目前异种移植模型应用最多的受体为狒狒、猕猴、恒河猴、食蟹猴,均属于OWM,N-羟乙酰神经氨酸(N-glycolylneuraminic acid,Neu5Gc)是引起异种移植排斥反应的重要非半乳糖抗原,YAMAMOTO等[12]的研究表明当Neu5Gc在供体猪体内不再表达时(CMAH基因失活),与人类或NWM相比,OWM血清对供体猪外周血单个核细胞具有更显著的免疫球蛋白M(immunoglobulin M,IgM)结合和细胞毒性。卷尾猴、金丝猴等属于NWM,但体型较小,无法满足猪器官移植手术。MOAZAMI等[13]的报告中指出供体猪和受体的心脏尺寸不匹配可能不足以维持足够的心输出量,从而导致心脏缺血性损伤。因此,NHP作为异种移植研究模型存在缺陷。出于更严谨的研究态度和对生物安全方面的考量,MONTGOMERY在2022年美国器官移植大会上提出猪-脑死亡遗体异种移植亚临床研究模型,作为异种移植走向临床前的一种过渡模型,并在国外开始了早期的探索[14-17]。本文将猪器官向脑死亡遗体的移植定义为异种移植亚临床研究。
2 异种移植在亚临床研究中的突破
近期,报道了9例基因编辑猪器官移植到人体的研究,包括7例(肾脏5例、心脏2例)异种移植亚临床研究和2例根据美国食品与药品监督管理局(Food and Drug Administration,FDA)同情使用条例开展的猪心移植研究,FDA定义,同情使用是指患有严重或立即危及生命的疾病或症状的患者,在没有可比较或者令人满意的替代疗法时,可以允许获得试验性医疗产品治疗。这些研究内容为克服免疫排斥、优化免疫抑制剂方案、监测跨物种病原微生物传播等提供了重要的数据参考。
2.1 肾脏移植
目前,已报道的异种肾脏亚临床研究共5例(表2),其中3例由美国纽约大学朗格尼医学中心(New York University Langone Medical Center,NYU Lounge)研究团队完成,另外2例由阿拉巴马大学伯明翰医学院(The University of Alabama at Birmingham,UAB)研究团队完成。
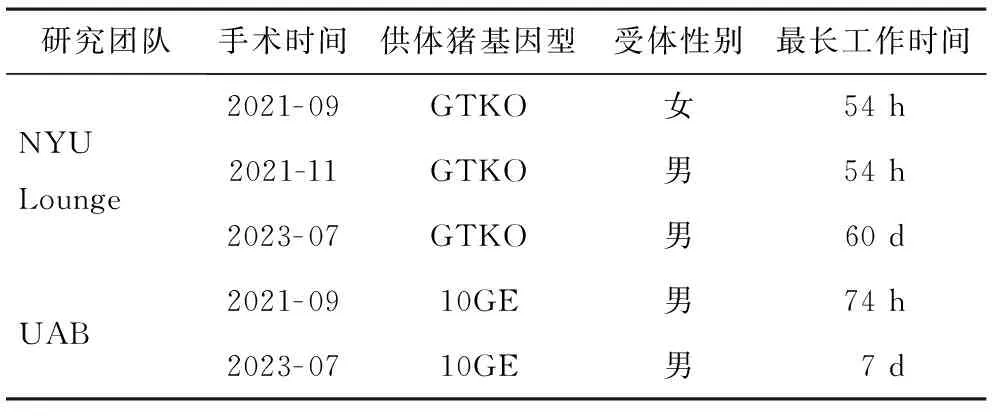
表2 猪-人肾脏移植研究现状
NYU Lounge研究团队的3例手术均选择了GTKO猪,移植后猪肾立即就产生了尿液,能够有效清除代谢废物肌酐,术后观察期内并未出现免疫排斥迹象[15]。此外,NYU Lounge研究团队还尝试了肾脏联合胸腺的移植方法:在移植前2个月时,将猪自体胸腺植入到肾包膜下,期望建立免疫耐受,实验结果显示猪肾联合胸腺的移植方式能够抑制适应性免疫。法国巴黎城市大学的ALEXANDRE团队利用空间转录组等技术围绕NYU Lounge研究团队完成的2例存活54 h猪肾移植的手术从免疫反应方面进行了完整的分析[17]。结果发现2例异种移植物中与单核细胞和巨噬细胞活化、自然杀伤细胞聚集、内皮活化、补体活化和T细胞发育的相关基因表达均显示增加。
UAB研究团队使用10-基因编辑猪10GE,包括4种基因敲除(GTKO、CMAH、B4GALNT2、GHR)和6种人源保护性基因的插入(CD46、CD55、CD47、THBD、EPCR、HO-1)。该团队在进行第一例移植时发现左肾产生的尿液量少,且肾脏不能清除肌酐[16]。2023年该团队进行了第二例异种肾移植手术,猪肾脏在灌注后短时间就产生了尿液,开始代谢肌酐。该团队认为受体的脑死亡状态或猪肾获取过程的缺血损伤可能影响到肌酐清除[18]。以上提示手术过程中要注重肾脏的保存[19]。
2.2 心脏移植
目前,已报道的异种心脏移植共完成4例(表3)。由马里兰医学中心(University of Maryland School of Medicine,UMSOM)研究团队和NYU Lounge团队分别完成2例。
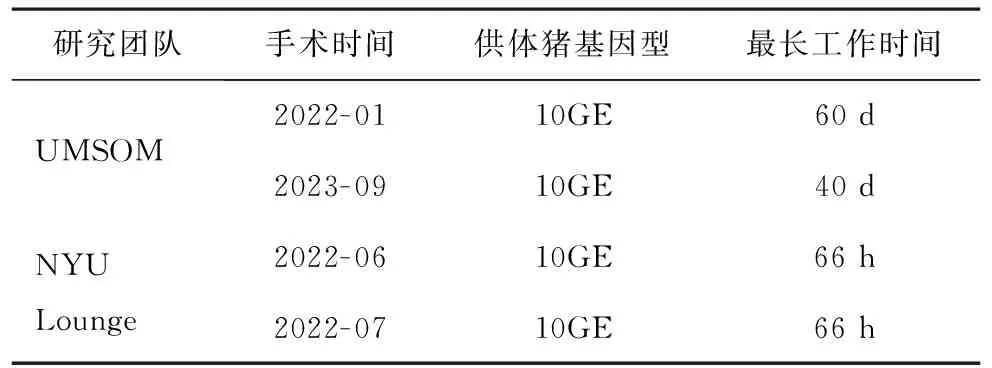
表3 猪-人心脏移植研究现状
UMSOM研究团队完成的2例异种心脏移植,是通过同情使用条例开展的猪心向心衰患者的移植,术后猪心脏在人体中能够自发搏动,未出现超急性免疫排斥,第一例患者存活60 d[20],第二例患者存活40 d。其中对第一例的检测结果已报道,发现可能导致排斥的三个方面。首先,观察到广泛的内皮细胞和毛细血管损伤,出现间质水肿和红细胞外渗及补体沉积等问题,这提示发生抗体介导的排斥。其次,本例中为避免微生物感染所使用的静脉注射免疫球蛋白,被证明能够结合猪细胞表面抗原,加剧了排斥反应。最后,血清中循环游离DNA的结果显示,出现了猪巨细胞病毒(porcine cytomegalovirus,PCMV),终止时在受体其他器官中同样被检测到,潜在的PCMV在异种移植物中的重新激活和复制可能引发破坏性炎症反应。这些发现指出了需注重内皮损伤机制研究,开发新型免疫抑制药物,需要更加严格的筛查供体猪。第二例移植较第一例采用了更灵敏的PCMV检测方法,并采用了新型免疫抑制剂CD154,移植后患者状态良好,但后续移植的心脏开始出现排斥现象并导致患者死亡,检测结果等待最新报道。
NYU Lounge完成了2例猪-脑死亡遗体的心脏移植,并维持观察66 h[13]。移植物在观察期内均未出现排斥迹象,能较好地维持心脏功能。但其中1例由于猪心脏尺寸偏小,最终因供血不足导致心肌细胞出现了不可逆的缺血性损伤,这提示器官大小也是移植成功的重要保证,敲除GHR基因是否能够稳定、一致地控制猪器官大小尚不明确,选择器官大小接近人类的小型猪可能是更好的选择,且能够避免此类问题的出现。
3 异种实体器官移植亚临床研究存在的问题
3.1 免疫排斥反应
异种移植中的排斥反应可以分为3类:超急性排斥、急性血管性排斥(acute vascular rejection,AVR)和急性细胞性排斥(acute cellular rejection,ACR)[21]。目前亚临床研究结果表明,超急性免疫排斥已被克服,然而在这之后的数日到数周内会发生以进行性炎症细胞浸润、移植物内皮细胞损伤、血管内血栓形成和纤维蛋白沉积为特征的AVR和ACR[22]。与同种异体移植相比,异种移植的一个优势是可以对猪进行基因改造,现有的基因工程猪在以猴为模型的移植中已取得很多长期存活记录,但在临床应用上仍处于早期探索,临床使用的供体猪基因型选择尚未明确,寻找新的基因改造靶点也是需要去攻克的难题。此外,也需要更多力量投入在基础研究,如明确异种排斥机制、开发新型免疫抑制药物和建立免疫监测体系等。
3.2 免疫抑制方案
有效的免疫抑制方案在器官移植中发挥重要作用,但现有的免疫抑制药物仅适用于同种移植,并不足以维持异种器官的长期存活[23]。猪-NHP的移植案例中已证明阻断CD40/CD154通路可以显著提高存活时间[24],其中猪心脏、肾脏已取得长期存活记录[25]。此外,抗补体药物对抑制异种移植早期排斥反应十分重要,抗C5抗体Tesidolumab能够有效减少早期IgM类抗体引起的攻膜复合物形成[26]。目前,国内适用于异种移植的免疫抑制剂开发较少,导致国内猪到猴的移植缺乏长期存活记录。
3.3 生物安全
随着异种移植(亚)临床研究的推进,跨物种病原微生物感染风险获得更多的关注,供体猪来源的部分细菌、病毒被证明可感染灵长类动物/细胞,可能导致灵长类动物患已知或未知的疾病[27]。已有多项研究表明PCMV的传播与受体存活时间相关,PCMV的激活可能引起了免疫排斥的加重[28]。因此,无菌猪的培育是开展(亚)临床研究的前提保障[29]。
无菌猪的培育依赖于无指定病原体屏障设施和剖腹产手术,从母猪子宫中获取仔猪后直接培育在洁净环境中[30],目前,国内仅有少数几家能够满足实施条件。异种移植领域虽已提出相应的病原微生物筛查清单,但这对于真正开展临床研究仍然有较多不确定性,在(亚)临床研究中还需要不断完善[10]。此外,需要优化病原微生物检测技术和完善体猪筛选流程以避免出现第一例猪心移植中的PCMV感染[31]。
3.4 法律法规
异种移植相关的法律法规的完善也是异种移植走向临床不可缺少的一环。世界卫生组织联合国际异种器官移植协会分别于2008年和2018年在长沙制定和更新了国际异种移植临床规范[32]。但我国相应技术准备、伦理审查及政策法规建设尚未完善[33],并未颁布异种移植相关法律法规。此外,尽管大部分国家都出台了脑死亡判定标准以及脑死亡立法,但我国大陆地区还未完成脑死亡立法,缺乏脑死亡立法的支持可能是我国异种移植在亚临床研究中发展受限的原因之一[34]。
4 总结与展望
猪-脑死亡遗体模型可能是一种更谨慎、安全的临床过渡方式,虽然该模型仅能维持有限的观察时间,但这将为我们提供更有价值的临床数据和经验指导。异种器官移植是一项前沿而富有挑战性的技术,可以解决目前人类面临的严重的器官缺乏问题,但它也面临着一些风险和其他问题,需要科学家们和社会各界共同努力来推进,也需要相应的法律法规进行约束,最终实现真正走向临床,造福人类。
