异种肝肾联合移植中猪内源性逆转录病毒的检测
2024-01-23陶开山窦科峰
张 虹,张 玄,陶开山,窦科峰
(空军军医大学西京医院肝胆外科,陕西 西安 710032)
异种移植是解决同种器官移植供体短缺的有效策略之一。近年来,猪器官的应用为心脏、肾脏、胰岛等临床前异种移植的发展提供了重要的器官来源[1]。目前原位猪肾脏异种移植受体和异位猪心脏异种移植受体最长存活时间分别达到499 d和945 d,说明临床前猪器官异种移植研究已初具规模[2]。然而,免疫排斥反应、炎症和凝血功能障碍以及猪病毒的跨物种传播风险是影响异种移植发展的关键性问题。随着基因工程技术的快速发展和有效免疫抑制剂的出现,通过对供体猪进行基因改造和使用免疫抑制剂能够减轻受体免疫排斥反应和炎症及凝血障碍,延长异种受体的存活时间[3]。但猪器官的移植是否会引起人畜共患病微生物的跨物种传播,是异种移植发展中人们关注的热点问题。其中猪内源性逆转录病毒(porcine endogenous retrovirus,PERV)整合在猪基因组中,被认为是风险等级最高的病毒[4]。
PERV是由核心蛋白gag、聚合酶pol和包膜蛋白env基因组成编码区的RNA逆转录病毒,在体外能够感染多种动物或人的细胞,并通过遗传传播[5]。感染性的PERV分为3个亚类:多嗜性的PERV-A和PERV-B以及嗜生态性的PERV-C。PERV-A和PERV-B在所有猪中均表达,并能感染不同物种细胞;而PERV-C仅在部分猪中表达,且只能感染猪细胞[6]。PERV-A和PERV-C会形成具有强复制和特异性突变能力的重组体PERV-A/C,整合在动物和人类细胞的基因组中[7]。此外,也有研究证明PERV在不同的组织器官中存在差异表达[8]。2019年,HEO等[9]研究发现异种肾脏移植术后受体膀胱中检测到PERV序列,插入实验证实受体中的PERV来源于供体猪细胞,采用猪特异性线粒体细胞色素B基因检测也证实了异种移植术后受体膀胱中存在猪细胞。因此,为了提高异种移植的安全性,选用PERV失活的供体或对移植受体进行广泛检测具有重要意义。现已有多种技术用于失活PERV,如同源重组、锌指核酶和CRISPR/Cas9等[10]。但PERV失活的供体移植后是否已完全失去遗传因素引起的病毒感染性,在移植过程中也需要进行实时监测。本研究以6-基因编辑猪-恒河猴异种肝肾联合移植样本为研究对象,检测异种移植过程中供受体不同组织中PERV基因的表达,期望为PERV的跨物种传播提供一定的理论基础。
1 材料与方法
1.1 材料
本实验采用的供体为成都中科奥格生物科技有限公司提供的健康SPF级3月龄(体质量约8 kg)6-基因编辑(3KO·3TG)巴马小型猪,敲除猪GGTA1、CMAH和β4GalNT2基因(3KO),转入人CD46、CD55和TBM基因(3TG)。受体为四川省医学科学院暨四川省人民医院实验动物研究所提供的10 kg成年雄性恒河猴。异种大动物实验遵循实验动物保护原则及伦理规范,并取得空军军医大学实验动物福利与伦理委员会批准(许可证号:20200487,20202488)。PK15细胞(CL-0187)购自武汉普诺赛生物科技有限公司。
PK15专用培养基(CM-0187,普诺赛生物科技有限公司,中国)。总DNA提取试剂盒(DP304,天根生化科技有限公司,中国)。Evo M-MLV反转录试剂盒(AG11711,艾瑞科生物工程有限公司,中国)。PremixTaqTM试剂(RR902A,宝日医生物技术有限公司,中国)。SYBR GreenProTaqHS预混型qPCR试剂盒(AG11476,艾瑞科生物工程有限公司,中国)。4S-GelRed核酸染料(A616694,生工生物工程有限公司,中国)。DL2000 DNA分子质量标准(3427A,宝日医生物技术有限公司,中国)。琼脂糖(BS081,白鲨科技有限公司,中国)。TAE溶液(50×)(BL533A,白鲨科技有限公司,中国)。
1.2 方法
1.2.1 引物序列及合成 查阅文献找PERV基因序列[9],在NCBI Primer-BLAST进行引物序列比对。选择合适的序列并合成引物(表1),引物由西安擎科生物有限公司合成。

表1 检测PERV各亚型的PCR和RT-PCR引物序列
1.2.2 PCR和RT-PCR检测供受体中PERV各亚型基因 分别收集供受体心脏、肝脏和肾脏等不同部位的组织样本,采用DNA提取试剂盒提取供受体组织和PK15细胞的基因组DNA(genomic DNA,gDNA),具体实验步骤依据说明书。200 ng gDNA中加入不同PERV亚型的特异性引物进行PCR反应,PCR反应程序为:94 ℃预变性3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃延伸5 min。常规TRIzol法提取不同供受体组织和PK15细胞的RNA,用反转录试剂盒将RNA反转录为cDNA,600 ng cDNA中加入特异性引物进行RT-PCR反应扩增PERV基因,RT-PCR反应程序为:94 ℃预变性5 min;94 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,30个循环;72 ℃ 延伸10 min。将获得的PCR和RT-PCR产物通过琼脂糖凝胶电泳检测PERV亚型的表达。其中PK15细胞为阳性模板,18srRNA为管家基因。
1.2.3 PCR检测猪特异性线粒体细胞色素B基因 采用PCR技术检测供受体组织中猪特异性线粒体细胞色素B基因的表达,200 ng gDNA中加入特异性引物进行PCR反应,PCR反应程序为:95 ℃预变性3 min;94 ℃ 40 s,55 ℃ 40 s,72 ℃ 40 s,35个循环;72 ℃ 延伸5 min。PCR产物通过琼脂糖凝胶电泳检测猪特异性线粒体细胞色素B基因的表达。
2 结果
2.1 异种肝肾联合移植供受体中PERV基因gag和pol的表达
PERV的gag基因编码核衣壳蛋白,pol基因编码逆转录酶和蛋白酶等,gag和pol基因是PERV产生的先决条件[6]。因此,本实验检测了gag和pol基因在异种移植供受体组织中的表达。课题组负责人前期实施了6-基因编辑猪-恒河猴异种肝肾联合移植大动物实验,受体存活14 d。在移植终点组织学检查发现移植肝组织结构紊乱,存在片状坏死及血栓性微血管病。将术前术后不同时间点收集的供受体组织样本的cDNA进行RT-PCR,琼脂糖电泳检测扩增产物的表达。结果显示,gag和pol基因在供体猪的肝脏、肾脏、皮肤、脾脏、小肠和肌肉组织中表达,移植终点时受体的肝脏、肾脏、心脏、肺、胰腺、小肠和胃组织中均没有检测到gag和pol基因。上述结果表明,在异种移植14 d内供体体内的gag和pol基因未向受体基因组传播(图1)。

M:DL2000分子质量标准;P:供体猪;NHP:非人灵长类受体恒河猴;NTC:阴性对照(以ddH2O为模板);PC:阳性对照(以PK15细胞cDNA为模板);Pre-Tx:移植前;Post-Tx:移植后。图1 RT-PCR检测异种肝肾联合移植供受体不同组织中gag和pol基因的表达
2.2 异种肝肾联合移植供受体中PERV各亚型的表达
PERV的gag和pol基因具有高度同源性,env基因存在差异,因此将PERV分为A、B和C三个亚型[11]。提取异种移植术前和术后供受体不同组织样本的gDNA并定量,经PCR扩增后电泳结果显示:供体猪的肝脏、肾脏、皮肤、脾脏、小肠和肌肉组织中均有PERV-A和PERV-B亚型的表达,移植终点时受体肝脏、肾脏、心脏、肺、胰腺、小肠和胃组织中未检出PERV-A和PERV-B亚型;而PERV-C亚型在供体猪和受体组织中均没有检出(图2)。上述结果表明:在异种移植术后14 d内,供体体内的PERV-A和PERV-B亚型未向受体传播。PERV-C亚型在该6-基因编辑猪中未检测到,提示形成强复制能力重组体PERV-A/C亚型的可能性较小。
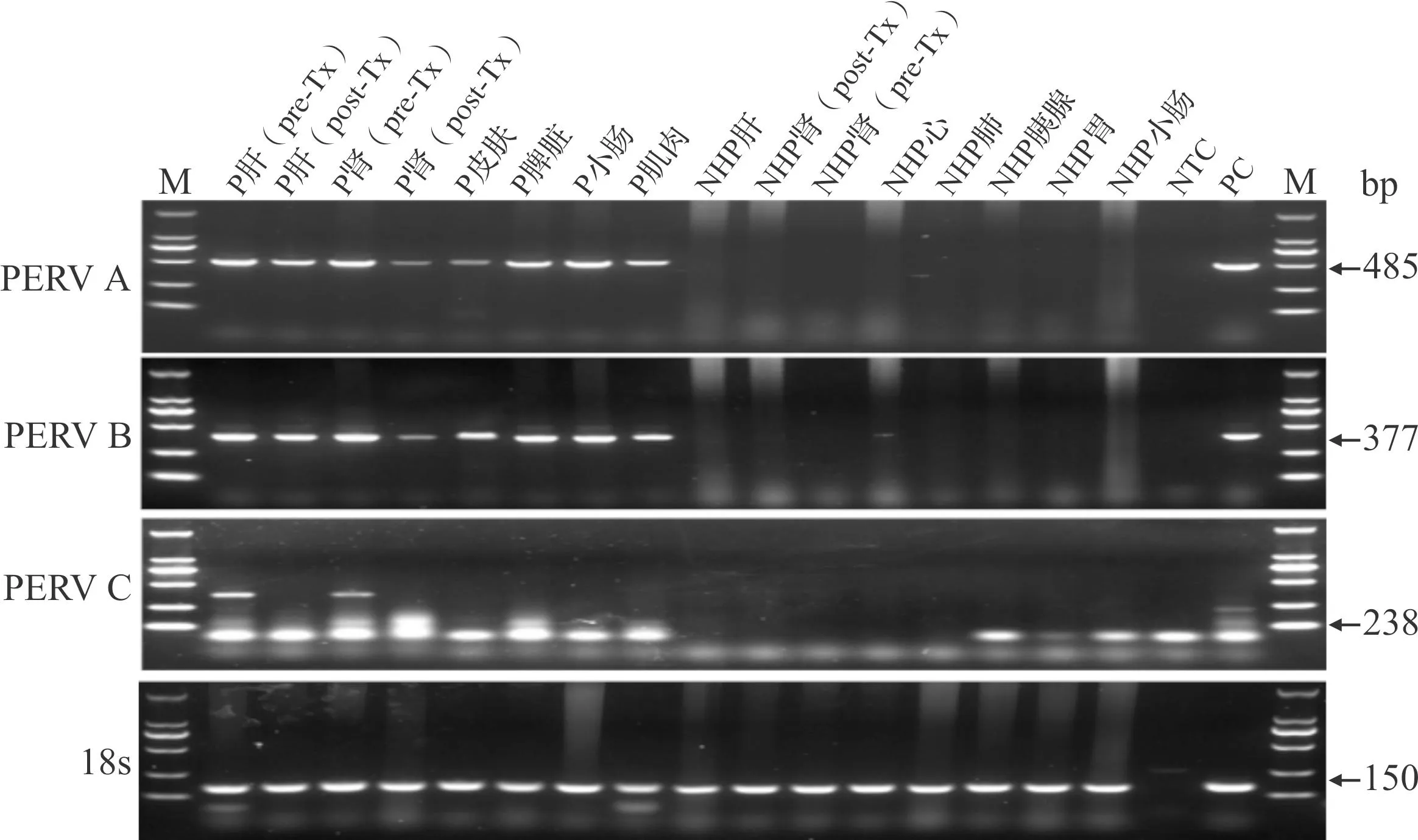
M:DL2000分子质量标准;P:供体猪;NHP:非人灵长类受体恒河猴;NTC:阴性对照(以ddH2O为模板);PC:阳性对照(以PK15细胞gDNA为模板);Pre-Tx:移植前;Post-Tx:移植后。图2 PCR检测异种肝肾联合移植供受体不同组织中PERV亚型的表达
2.3 异种肝肾联合移植供受体中猪特异性线粒体细胞色素B基因的表达
哺乳动物细胞中存在大量线粒体,且线粒体基因组比gDNA更适用于少量供体细胞的检测[12]。因此,我们通过PCR技术检测了异种移植术前术后供受体不同组织样本DNA中猪特异性线粒体细胞色素B基因的表达,电泳结果显示:猪的肝脏、肾脏等组织表达猪特异性线粒体细胞色素B基因,移植终点时受体肝脏、肾脏等组织中未检出猪特异性线粒体细胞色素B基因(图3)。上述结果表明,在异种移植术后14 d内,供体体内的猪特异性线粒体细胞色素B基因未向受体体内传播。

M:DL2000分子质量标准;P:供体猪;NHP:非人灵长类受体恒河猴;NTC:阴性对照(以ddH2O为模板);PC:阳性对照(以PK15细胞gDNA为模板);Pre-Tx:移植前;Post-Tx:移植后。图3 PCR检测异种肝肾联合移植供受体不同组织中猪特异性线粒体细胞色素B基因的表达
3 讨论
人畜共患病微生物的跨物种传播是影响异种移植发展的关键性因素。目前在异种移植背景下已经发现可能造成人畜共患病的病毒有猪巨细胞病毒/猪玫瑰病毒[13]、E型肝炎病毒[14]、PERV[15]以及猪淋巴嗜疱疹病毒[16]。猪体内存在的大部分病毒微生物可以通过接种疫苗或抗病毒药物、早期断奶以及胚胎移植后无病原体等级培养的方法消除,但PERV是整合在猪基因组中难以通过以上方式消除的内源性逆转录病毒,并且PERV的隐形感染可能会导致受体基因调控的改变、引发肿瘤或DNA重组[17]。因此,PERV的安全性是异种移植发展过程中人们关注的热点问题。
研究表明PERV能够在体外感染人类细胞,并在细胞培养过程中整合到人类基因组中[18]。也有研究证实在异种肾移植术后受体的膀胱组织中存在PERV序列[9]。PERV的传播速度与其亚型和病毒载量有关[19]。PERV-A和PERV-B能感染不同物种细胞,而PERV-C仅能感染猪细胞。因此,国际异种协会建议通过筛选不表达PERV-C及低表达PERV-A和PERV-B的PERV源猪群作为移植供体来降低病毒传播的风险[20]。在本研究中,我们检测了供体猪不同器官中PERV亚型的表达,结果显示本次实验供体只表达PERV-A和PERV-B亚型,不表达PERV-C亚型,这提示产生强感染效率的PERV-A/C重组体的可能性很小。我们的研究结果也显示PERV-A在猪皮肤和肌肉中的含量低于肝脏和肾脏,提示PERV亚型在不同组织器官中的表达量不同,这与PERV在不同品系的猪群和不同组织器官中的表达存在差异的报道相一致[19]。
PERV作为内源性病毒整合在宿主基因组中能够通过遗传传播,而失活的内源性病毒在特定情况下可能会重新感染细胞,并且异种移植过程中使用免疫排斥药物也容易引起慢性免疫抑制相关的感染以及产生宿主适应性病毒的风险[21]。因此,异种移植过程中需要对PERV进行检测和监控。现在已有多种检测手段用于PERV的定性及定量检测,如PCR、RT-PCR、Southern印迹杂交及荧光原位杂交技术等。本研究采用RT-PCR和PCR的方法检测了异种肝肾联合移植前后供受体体内PERV基因的表达,结果显示PERV-A和PERV-B亚型在供体猪体内存在,而在移植终点时受体体内未检出。PERV的gag和pol基因是病毒产生的先决条件。因此,我们检测了供受体不同组织中gag和pol的表达。结果显示,供体猪的不同组织中均能检测到gag和pol基因,而移植终点时受体组织中未检测到gag和pol基因。研究证明实体器官移植术后在受体不同组织中存在含量较低的循环供体细胞,而线粒体基因组的检测常被用于确定异种移植环境中是否存在循环供体细胞[12]。本实验中猪特异性线粒体细胞色素B基因的检测结果证明移植术后受体中不存在循环猪细胞。以上结果均说明在6-基因编辑猪-恒河猴异种肝肾联合移植过程中供体猪中的PERV基因均未向受体传播。但本实验受体存活时间仅14 d,并不能判断随着异种移植时间的延长,PERV病毒是否会向受体体内传播,这是本实验的局限性。
综上所述,PERV的跨物种传播是猪器官应用为异种移植供体急需解决的关键性问题。本研究表明在6-基因编辑猪-恒河猴的异种肝肾联合移植的模型中,受体存活14 d内猪体内的PERV基因未向受体传播。但这只是单次实验的结果,PERV基因的传播性还需在多次异种移植实验中进行探究。虽然目前没有单一的方法能够完全消除PERV理论上的风险,但是移植前筛选合适的供体猪,以及移植过程中对PERV的安全性进行监测对推动实体器官异种移植的临床应用具有非常重要的意义。
