游泳运动可能通过调控Nrf2/HO-1/Keap1通路改善尼古丁胁迫大鼠肝损伤
2024-01-23孔海军谌晓安
孔海军,张 亮,熊 伟,谌晓安
《中国吸烟危害健康报告2020》显示,我国吸烟人群已超过3亿,每年由吸烟造成的死亡病例超过100万以上,吸烟已成为危害公共健康的重大隐患[1]。尼古丁是烟草制品中的主要成分,具有较强的毒性和成瘾性,长期吸烟或摄入尼古丁可能导致机体白细胞介素(Interleukin)、肿瘤坏死因子(Tumor necrosis factor)和血管内皮生长因子(Vascular endothlial growthfactor,VEGF)等血管生成因子,以及纤维化介质和细胞外基质蛋白的增殖[2]。尼古丁能导致烟酰胺腺嘌呤二核苷酸磷酸(Nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶系统的激活,抑制谷胱甘肽等抗氧化途径,并诱导肝脏自由基脂质过氧化、肝星状细胞活化和系膜细胞活化[3]等。队列研究显示,与不吸烟者比较,长期吸烟者的碱性磷酸酶(Alkaline phosphatase,ALP)和谷氨酰转肽酶(Glutamyl transpeptidase,GGT)等肝代谢酶水平明显升高[4]。黄小溪等[5]的研究发现,长期的香烟烟雾暴露会导致大鼠肝细胞变性、细胞浸润、门周纤维化、肝实质退化以及中央和门静脉充血等。此外,亦有多项研究证实了尼古丁摄入或长期吸烟与肝细胞坏死、肝组织损伤有一定的关联性[6]。
尼古丁通过炎症和细胞凋亡途径,如,NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)和含半胱氨酸的天冬氨酸蛋白水解酶3(cysteinyl aspartate specific proteinase 3,Caspase-3)等的全身效应作用于心血管系统,从而形成多器官影响效应[7]。有研究发现,核因子E2相关因子2(nuclear factor erythroid 2 related factor 2,Nrf2)/血红素氧合酶1(Heme Oxygenase-1,HO-1)/Kelch样环氧氯丙烷相关蛋白1(Kelch-1ike ECH-associated protein l,Keap1)通路通过转导NLRP3和Caspase-3信号分子调节肝组织脂质过氧化、自由基损伤和内皮细胞的功能障碍。Sudhir Chowdhry等的研究发现,Nrf2活性受损可能是导致急、慢性肝损伤向肝纤维化演变的主要风险因素[8]。大量研究也报道了运动对非酒精性脂肪肝或化学物质(如,CCl4、D-氨基半乳糖等)致肝损伤的保护效应,运动干预改善肝脏损伤的机制主要是通过激活肝细胞自噬和清除过剩氧化物,进而减轻肝细胞凋亡、组织氧化应激和炎症反应[9]。但现阶段,尚缺乏运动对尼古丁致肝损伤保护作用的直接证据。基于此,本研究旨在构建尼古丁胁迫(Nicotine stress,NS)模型,通过游泳运动干预,验证Nrf2/HO-1/Keap1通路在NS大鼠肝代谢、炎症反应、氧化应激和纤维化蛋白中的具体作用,为运动干预在NS致肝损伤的康复治疗中提供理论和实验依据。
1 材料与方法
1.1 实验动物与分组
40只6周龄SPF级雄性SD大鼠由新疆医科大学医学实验动物中心提供,实验动物许可证编号为SYXK(新)2016-0002。实验室条件适应性饲养3 day后随机分组,分别为假手术组(Sham组,n=10)、游泳运动组(Ex组,n=10)、尼古丁胁迫组(NS组,n=10)及尼古丁胁迫+游泳运动组(NS+Ex组,n=10)。
1.2 主要仪器和试剂
主要仪器有大鼠恒温泳池(上海软隆科技公司)、KH-Q330全自动组织切片机(湖北阔海医疗科技公司)、TE2000-U显微图像分析系统(日本奥林巴斯公司)、imark酶标仪(美国Bio-Rad公司)、5424R高速冷冻离心机(德国艾本德公司)、AlphaImager EP凝胶成像系统(美国ProteinSimple公司)、Gene Pulser Xcell电泳系统(美国Bio-Rad公司)、170-3930蛋白转印系统(美国Bio-Rad公司)、Eppendorf紫外分光光度计(德国艾本德公司)、SCIEX Triple TOF©4600 AB ACQUITY液相色谱系统(美国AB公司)和Micromass Quattro Micro API质谱仪(美国AB公司)。
试剂方面,尼古丁购自美国Sigma公司;谷丙转氨酶(Alanine aminotransferase,ALT)、谷草转氨酶(Aspartate aminotransferase,AST)、碱性磷酸酶(Alkaline phosphatase,ALP)、丙二醛(Malondialdehyde,MDA)、超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)、白介素6(Interleukin-6,IL-6)、白介素1β(Interleukin-1β,IL-1β)和肿瘤坏死因子-α(Tumor necrosis factor,TNF-α)试剂盒均购自南京建成生物工程研究所有限公司;Trizol总RNA抽提试剂、cDNA合成试剂盒、双链cDNA合成试剂盒、dNTP Mixture、Taq PCR MasterMix、免疫组织化学染色及DAB试剂盒均购自上海碧云天生物技术有限公司;cDNA引物Oligo购自上海生工生物工程股份有限公司;α-SMA、SMAD3、Caspase-3和NLRP3抗体购自Proteintech公司;Nrf2、NQO-1、HO-1、Keap-1和β-Actin抗体购自Abcam公司;Bax、Bcl-2和NF-kB抗体购自Thermo Fisher公司。
1.3 尼古丁胁迫模型及运动方案
首先,NS组和NS+Ex组大鼠接受尼古丁腹腔注射(2.5 mg/kg·bw/d),连续4周,灭菌注射用水配置尼古丁所需浓度;Sham组和Ex组不接受腹腔药物给药,正常饲养。其次,尼古丁胁迫模型建立后,Ex组和NS+Ex组大鼠进行适应性游泳训练,3 d,1次/d,15 min/次;Sham组和NS组不接受运动干预,正常饲养。再者,适应性游泳训练后,Ex组和NS+Ex组进行连续8周的自由游泳运动:(1)1~2周:2次/d,20 min/次;(2)3~4周:2次/d,25 min/次;(3)5~8周:2次/d,30 min/次。Sham组及NS组大鼠保持正常饲养及自由活动,不参与游泳运动干预方案。
1.4 样本采集
末次游泳运动后的次日,麻醉、尾静脉取血,全血室温自凝45 min,4 ℃、2 000 r/min离心10 min,取上清即为血清;迅速取肝脏,称取1 g肝脏加入PBS匀浆介质,1 500 r/min匀浆30 s,匀浆液转移至离心管,4 ℃、6 000 r/min,离心10 min,取上清于-80 ℃保存。
1.5 酶联免疫吸附试验
分别取肝组织匀浆液和血清,采用试剂盒法检测谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、白介素6(IL-6)、白介素1β(IL-1β)和肿瘤坏死因子-α(TNF-α)水平。
1.6 苏木素-伊红染色和免疫组织化学染色
取大鼠肝组织,制作切片并脱蜡、复水,苏木素-伊红染色后,镜下观察,切片中心视野采集图像。经抗原修复,分别加抗α-SMA抗体(1∶300)和抗SMAD3抗体(1∶400),4 ℃孵育过夜,PBS缓冲液清洗,二抗孵育,按照DAB显色试剂盒流程进行显色反应。
1.7 LC-MS法检验

1.8 RT-PCR法检测
取200 μL肝组织匀浆液,采用Trizol法提取组织液总RNA,逆转录为cDNA,采用实时荧光定量PCR(qRT-PCR)法检测mRNA相对表达水平。PCR反应体系(20 μL)分别为cDNA模板1 μL、ddH2O 7 μL、正向引物1 μL、反向引物1 μL、2×Taq PCR master mix10 μL,条件为95 ℃初始变性55 s;然后在95 ℃变性10 s,57 ℃退火30 s,40个循环。引物序列如表1所示。

表1 目标基因引物序列表
1.9 Western Blot检测蛋白表达量

1.10 统计学分析
采用SPSS 25.0统计学软件进行统计分析,数据结果以平均数±标准差(mean ± SD)表示,两样本平均数间比较采用t检验分析,多样本平均数间比较采用单因素方差分析(one way ANOVA),组间比较采用LSD检验,P<0.05表示有显著性差异。
2 结 果
2.1 各组大鼠肝重、肝系数及肝功能
与Sham组比较,NS组和NS+Ex组大鼠肝系数和肝组织ALT、AST和ALP水平显著上升(P<0.05);Ex组ALT水平显著降低(P<0.05)。与NS组比较,NS+Ex组大鼠肝系数和肝组织ALT、AST和ALP水平显著降低(P<0.05)(见表2)。

表2 各组大鼠肝重、肝系数及肝功能指标统计表Table 2 Liver weight, liver coefficient and liver function indexes of rats in each group
2.2 各组大鼠血清和肝组织氧化应激
与Sham组比较,NS组大鼠血清和肝组织MDA水平显著上升,SOD和GSH-px水平显著降低(P<0.05);NS+Ex组大鼠血清和肝组织MDA水平显著上升,肝组织SOD显著降低(P<0.05);Ex组血清、肝组织GSH-px和肝组织MDA、SOD水平显著上升(P<0.05)。与NS组比较,NS+Ex组大鼠血清和肝组织MDA水平显著降低,SOD和GSH-px水平显著上升(P<0.05)(见表3)。

表3 各组大鼠血清和肝组织氧化应激统计表
2.3 有氧运动对NS大鼠血清和肝组织炎症因子的影响
与Sham组比较,NS组大鼠血清IL-1β、IL-6和TNF-α水平显著上升(P<0.05);Ex组大鼠血清IL-1β和TNF-α水平显著降低(P<0.05)。与NS组比较,NS+Ex组大鼠血清IL-1β、IL-6和TNF-α水平显著降低(P<0.05)(见表4)。

表4 各组大鼠血清炎症因子水平统计表
2.4 各组大鼠肝脏病理形态学特征
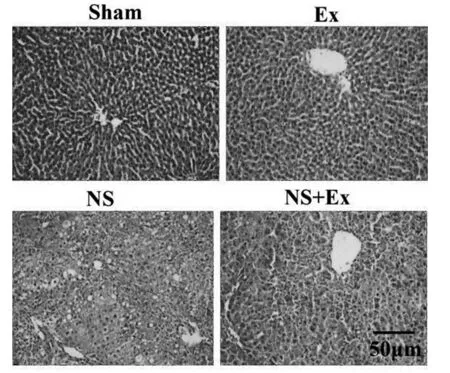
图1 各组大鼠肝组织HE染色图(200×)Figure 1 HE staining of rat liver tissues in each group (200×)
Sham组和Ex组大鼠肝小叶结构正常,肝细胞排列整齐,肝窦清晰连续且无坏死区域。其中,NS组大鼠肝细胞胞质深染,肝细胞索结构不清晰,出现大量坏死灶和炎性细胞浸润,肝损伤明显;NS+Ex组大鼠肝组织坏死灶减少,炎性细胞浸润减轻,肝结构逐渐趋于正常,肝组织损伤减轻(见图1)。
2.5 各组大鼠肝组织代谢组学
通过Met PA通路富集分析各组大鼠肝组织代谢通路,结果表明,游泳运动对NS大鼠肝组织代谢影响度较高的通路包括甘氨酸和苏氨酸代谢通路、抗坏血酸和藻酸盐代谢通路、花生四烯酸代谢通路、α-亚油酸代谢通路和甘油酯代谢通路等(见表5)。
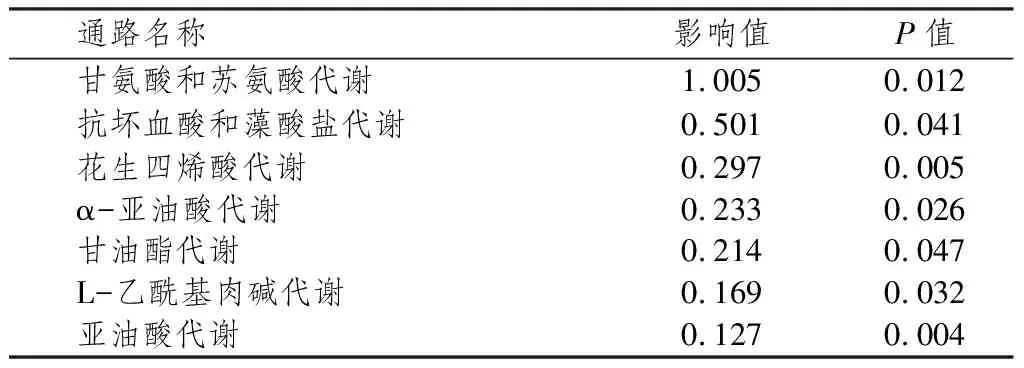
表5 肝组织代谢通路Met PA分析表
2.6 各组大鼠肝组织纤维化蛋白表达
与Sham组比较,NS组和NS+Ex组大鼠肝组织α-SMA和SMAD3阳性细胞数量显著上升(P<0.05);Ex组大鼠肝组织α-SMA阳性细胞显著降低(P<0.05)。与NS组比较,NS+Ex组大鼠肝组织α-SMA和SMAD3阳性细胞数量显著降低(P<0.05)(见图2)。
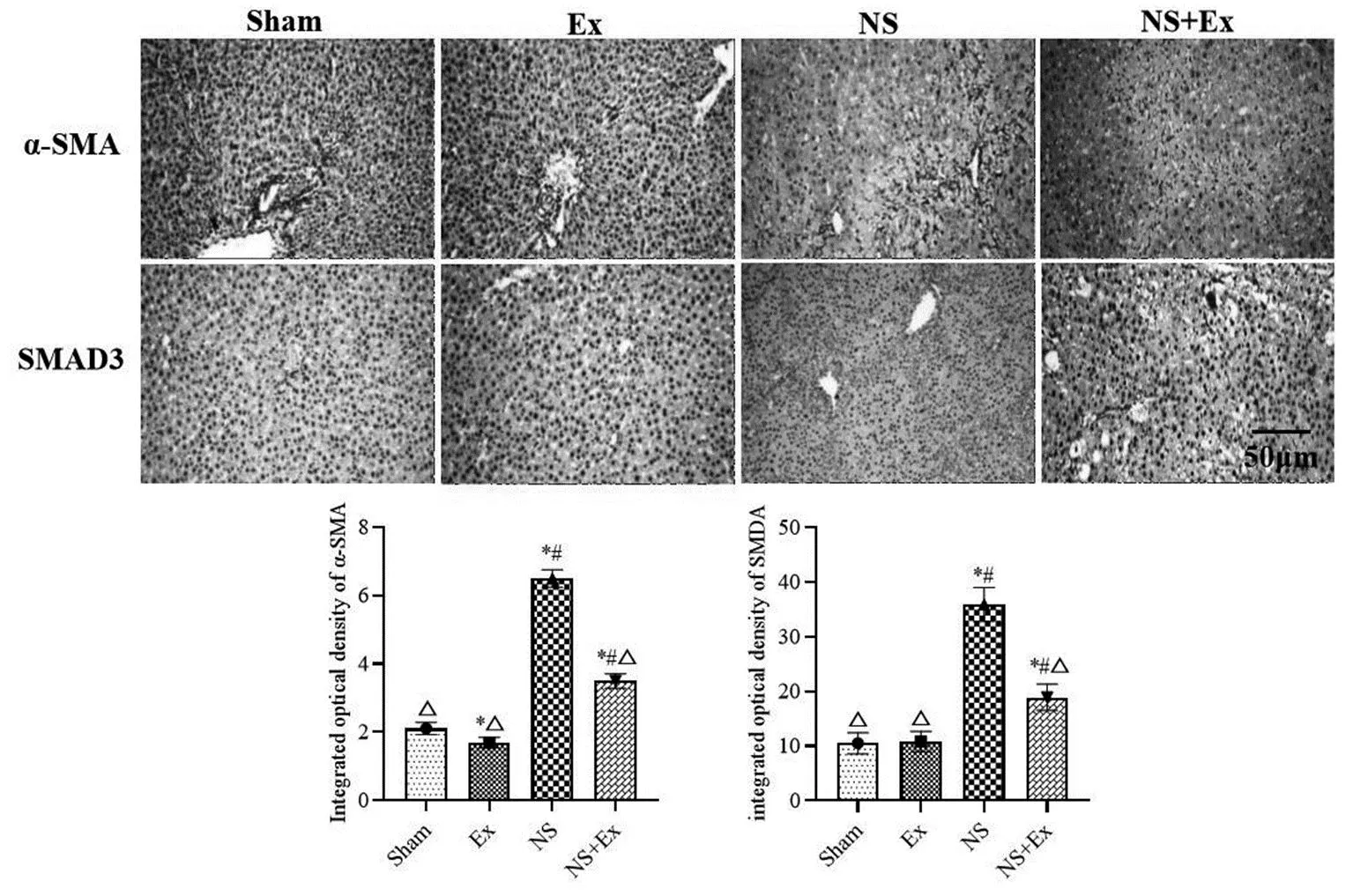
图2 各组大鼠肝组织α-SMA、SMAD3免疫组织化学染色图Figure 2 Immunohistochemical staining of α-SMA and SMAD3 in liver tissue of rats in each group
2.7 各组大鼠肝组织炎症反应及凋亡相关蛋白表达
与Sham组比较,NS组大鼠肝组织Bcl-2、Caspase-3、NLRP3和NF-кB蛋白表达显著上升(P<0.05),Bax蛋白表达显著降低(P<0.05);NS组大鼠肝组织Bax和NLRP3蛋白表达显著下降(P<0.05);NS+Ex组大鼠肝组织Bcl-2、Caspase-3和NF-кB蛋白表达显著上升(P<0.05),Bax蛋白表达显著降低(P<0.05)。与NS组比较,NS+Ex组大鼠肝组织Bcl-2、Caspase-3、NLRP3和NF-кB蛋白表达显著下调(P<0.05),Bax蛋白表达显著上调(P<0.05)(见图3)。
2.8 各组大鼠肝组织Nrf2、HO-1和Keap-1 mRNA表达
与Sham组比较,NS组大鼠肝组织Nrf2和HO-1 mRNA表达显著降低(P<0.05),Keap-1 mRNA表达显著上升(P<0.05);Ex组大鼠肝组织Nrf2和HO-1 mRNA表达显著上升(P<0.05),Keap-1 mRNA表达显著降低(P<0.05);NS+Ex组大鼠肝组织Keap-1 mRNA表达显著上升(P<0.05)。与NS组比较,NS+Ex组大鼠肝组织Nrf2和HO-1 mRNA表达显著上调(P<0.05),Keap-1 mRNA表达显著下调(P<0.05)(见图4)。

图4 各组大鼠肝组织Nrf2、HO-1和Keap-1 mRNA表达图Figure 4 mRNA expression of Nrf2,HO-1 and Keap-1 in liver tissues of rats in each group
2.9 各组大鼠肝组织Nrf2/HO-1/Keap1通路相关蛋白表达
与Sham组比较,NS组大鼠肝组织Nrf2、NQO-1和HO-1蛋白表达显著降低(P<0.05),Keap-1蛋白表达显著上升(P<0.05);Ex组大鼠肝组织Nrf2和HO-1蛋白表达显著上升(P<0.05),Keap-1蛋白表达显著降低(P<0.05);NS+Ex组大鼠肝组织Nrf2蛋白表达显著降低(P<0.05),Keap-1蛋白表达显著上升(P<0.05)。与NS组比较,NS+Ex组大鼠肝组织Nrf2、NQO-1和HO-1蛋白表达显著上调(P<0.05),Keap-1蛋白表达显著下调(P<0.05)(见图5)。
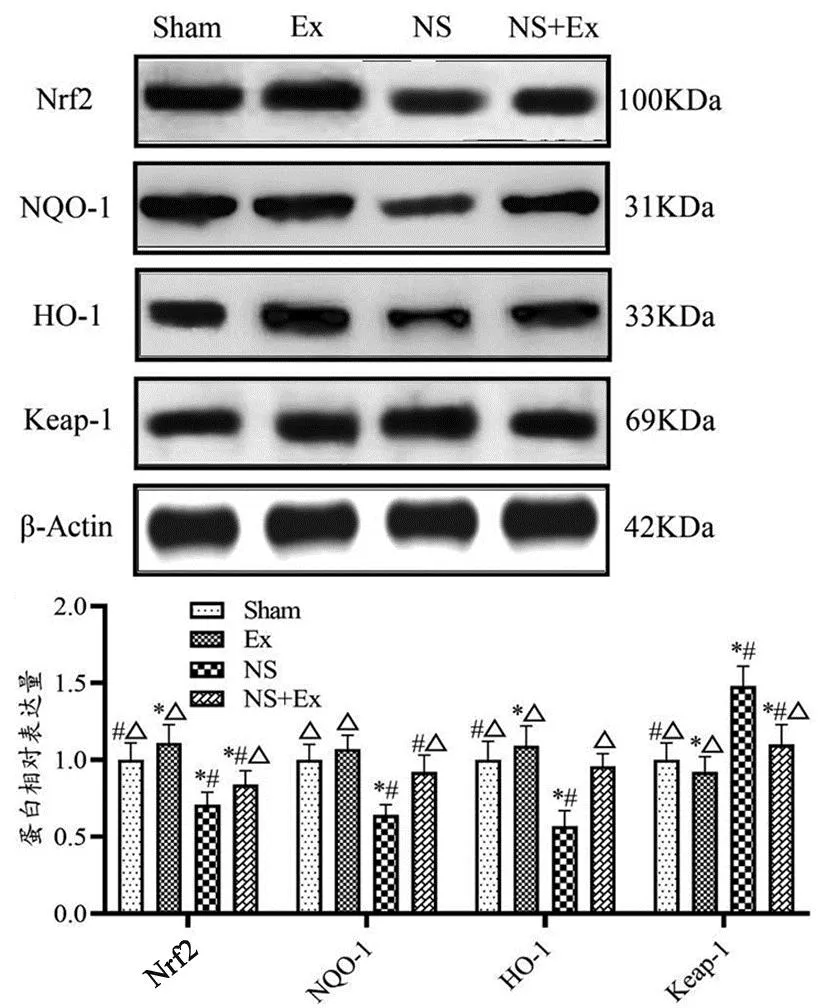
图5 各组大鼠肝组织Nrf2/HO-1/Keap1通路相关蛋白表达图Figure 5 Expression of Nrf2/HO-1/Keap1 pathway related proteins in liver tissue of rats in each group
3 讨 论
3.1 游泳运动对尼古丁胁迫大鼠炎症反应和肝功能的影响
肝脏是负责清除或转化药物、酒精和其他有害物质的重要器官。流行病学证据显示,吸烟或尼古丁摄入会增加慢性乙型、丙型肝炎病毒患者肝纤维化和原发性胆汁性肝硬化(Primary biliary cirrhosis,PBC)的风险,并降低抗病毒药物的治疗效果[10]。队列研究显示,长期吸烟者罹患上呼吸道感染的几率显著高于非吸烟者[11]。尼古丁通过抑制核糖核苷酸还原酶和T细胞抗原信号干扰抗体的形成,从而阻碍T淋巴细胞的分化和增殖。此外,尼古丁通过增强Fas/CD95死亡受体表达诱导淋巴细胞凋亡、细胞毒性T淋巴细胞和促炎细胞因子(TNF-α、IL-6、IL-1)表达上升,并造成NK细胞活性受损[12]。体育运动尤其是有氧运动可以参与机体免疫调节,有研究认为,运动通过激活T细胞抗原介导的信号转导通路和核糖核苷酸还原酶,促进淋巴细胞增殖和分化[13]。此外,有氧运动被证实可以下调Fas/CD95死亡受体表达抑制淋巴细胞凋亡,进而抑制TNF-α、IL-6和IL-1等促炎细胞因子的生成[14]。本研究也观察到类似的现象,游泳运动有效抑制了NS造成的肝脏氧化应激激活和炎症反应。
肝功能是反映机体肝损伤的金标准,常采用肝脏代谢酶水平进行评估。Wannamethee等[15]的研究表明,在调整年龄、性别、BMI、酒精和咖啡饮用量等多变量风险后,吸烟者的血清总蛋白和白蛋白水平显著降低,谷氨酰转肽酶(Glutamyl transpeptidase,GGT)水平显著上升。因此,吸烟或尼古丁摄入无疑是肝损伤进展中未被充分认识的病理学因素。肝系数上升是肝损伤或纤维化的早中期特征,这可能与肝组织水肿、充血或增生肥大等病理现象有关。本研究发现,4周高剂量尼古丁注射后,大鼠肝系数显著上升,提示肝组织可能出现水肿或纤维化增生,病理学观察也发现肝组织出现大量坏死灶和炎性细胞浸润。分析认为,可能是高剂量尼古丁提高了肝组织工作负担、尼古丁的直接毒性作用合并诱发了肝组织损伤和结构性增生。目前,尚缺乏运动对尼古丁诱导肝损伤的干预研究,但部分间接证据显示,运动干预可以有效改善心肌梗死、高强度急性运动和糖尿病等诱导的肝功能异常[16]。有研究发现,7周跑台运动可以显著降低酒精性肝损伤小鼠血清和肝组织AST、ALT和MDA水平[17]。有动物实验发现,有氧运动显著降低了心肌梗死小鼠血清AST、ALP和ALT活性[18]。本研究也发现,8周游泳运动可以显著降低NS大鼠肝组织ALT、AST和ALP水平,说明有氧运动可以有效缓解NS诱导的肝损伤进程。
3.2 游泳运动对尼古丁胁迫大鼠肝脏代谢功能的影响
肝损伤中常常会观察到肝功能异常和相关代谢紊乱,为了确定NS诱导肝损伤的代谢学特征,本研究对其肝组织代谢组学进行了分析。结果表明,NS导致大鼠肝组织差异代谢物出现显著扰动现象,甘氨酸和苏氨酸、抗坏血酸和藻酸盐、花生四烯酸等肝损伤标志物表达下降;而游泳运动通过逆转差异代谢物扰动并上调甘氨酸和苏氨酸、抗坏血酸和藻酸盐、花生四烯酸等肝损伤标志物,从而减轻了NS诱导的肝损伤。有研究认为,甘氨酸和苏氨酸代谢受损与诸多肝脏疾病诱导的肝损伤密切相关[19]。临床和动物实验证据显示,非酒精性脂肪性肝病(Nonalcoholic fatty liver disease,NAFLD)患者和小鼠肝组织甘氨酸生物合成基因丙氨酸-乙醛酸氨基转移酶1(Alanine-glyoxylate aminotransferase 1,AGXT1)被显著抑制[20]。甘氨酸参与构成蛋白质结构链,同时调控谷胱甘肽合成和单碳代谢,在肥胖、2型糖尿病和NAFLD相关的代谢紊乱中,肝组织甘氨酸水平呈下降趋势。临床研究表明,补充甘氨酸可以对肝脏代谢产生有益效果[21]。尼古丁可能通过肠道—肝脏代谢轴影响体内甘氨酸代谢,动物实验证据显示,尼古丁注射小鼠肠道、肝组织内甘氨酸、丝氨酸和天冬氨酸水平降低[22]。有学者认为[23],尼古丁诱导肝脏甘氨酸代谢失衡的机制包括:(1)尼古丁的毒性作用造成肠道微循环障碍,肠道甘氨酸吸收效率降低;(2)体内甘氨酸生物合成效率下降;(3)甘氨酸分解代谢或尿液排泄速率上升。本研究游泳运动干预后,NS诱导肝损伤甘氨酸和苏氨酸代谢效率显著上升,表明游泳运动可以显著改善大鼠NS诱导肝损伤甘氨酸和苏氨酸代谢的能力。
3.3 游泳运动对尼古丁胁迫大鼠肝组织纤维化和细胞凋亡的影响
研究认为,长期吸烟、烟雾暴露或尼古丁摄入可以诱导肝组织纤维化[24]。肌成纤维细胞活化是肝纤维化发生的核心环节,α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和信号转导分子3(Mothers against decapentaplegic homolog 3,SMAD3)的激活与转化是肌成纤维细胞活化的主要来源,因而成为纤维化诊断和治疗的靶点。内质网应激(Endoplasmic reticulum stress,ERS)作为细胞的重要保护机制,参与调节Nrf2、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、核因子NF-κB(Nuclear factor kappa-B,NF-κB)和c/EBP同源蛋白等多种细胞因子,在炎症过程、细胞防御性氧化应激和细胞凋亡过程中发挥着调控作用[25]。半胱氨酰天冬氨酸特异性蛋白酶-3(Caspase-3)作为Caspase级联反应下游最关键的凋亡执行者,其激活在很大程度上依赖于NLRP3的释放,而B淋巴细胞瘤(B-cell lymphoma,Bcl)家族中的Bcl-2和Bax基因是目前已知的细胞凋亡中最重要的调控基因,可以通过线粒体途径介导NLRP3等物质的释放[26]。Bax不仅作为Caspase-3的上游调控机制参与对Caspase-3活性的调节,还可作为Caspase-3的直接底物作用于Caspase-3下游,二者在细胞凋亡传导过程中既相互联系又相互制约。本研究发现,尼古丁腹腔注射4周后,大鼠肝组织Bcl-2、Caspase-3、NLRP3、NF-кB蛋白表达和α-SMA、SMAD3阳性细胞数量显著上升(P<0.05),Bax蛋白表达显著降低,表明NS导致大鼠肝细胞炎症反应和凋亡反应激活,肝组织纤维化水平上升,且NS诱导的细胞炎症反应和凋亡反应可能是肝损伤的内源性因素。有研究证实,有氧运动可以发挥损伤组织凋亡调控的作用。如,有氧运动和抗阻运动均可以有效地抑制糖尿病脂肪肝大鼠肝脏ERS及其介导的细胞凋亡[27]。亦有部分研究证实,有氧运动可以有效抑制烟雾刺激和低氧暴露诱导的ERS和肝组织凋亡反应[28]。本研究发现,游泳运动显著降低了NS大鼠肝组织Bcl-2、Caspase-3、NLRP3、NF-кB蛋白表达和α-SMA、SMAD3阳性细胞数量,显著提高了Bax蛋白表达。提示游泳运动可能通过抑制ERS调控的炎症过程和细胞凋亡,减轻NS大鼠肝组织损伤。
3.4 游泳运动对尼古丁胁迫大鼠肝组织Nrf2/HO-1/Keap1通路的影响
核因子E2相关因子2(Nrf2)作为转录因子参与调控细胞氧化应激反应,在氧化还原平衡、代谢和炎症反应应答中发挥重要作用[29]。有研究表明,在氧化应激及其他有害刺激作用下,脑、肝脏和肾脏等器官Nrf2表达上升[30]。Kelch样ECH相关蛋白1(Keap1)、表观遗传学和磷脂酰肌醇3激酶(Phosphatidylin-ositol-3-kinase,PI3K)/蛋白激酶B(Protein kinase B,PKB)是调节Nrf2信号的三个关键途径。Keap1在生理条件下通过E3连接酶诱导Nrf2泛素化,导致Nrf2被26S蛋白酶体分解,Nrf2从细胞质向细胞核的易位被抑制[31]。血红素氧合酶1(HO-1)和醌NADH脱氢酶1(Recombinant NADH Dehydrogenase, Quinone 1,NQO-1)是细胞内重要的保护酶,具有抗炎和抗氧化作用,同时参与调节Nrf2-ARE抗氧化反应系统[32]。然而,Nrf2与HO-1和NQO-1相互作用的机制仍不清楚。但多项研究证实,长期烟雾暴露或尼古丁摄入导致动物肝组织Nrf2、HO-1、NQO-1基因和蛋白表达降低,继而调节多个下游靶基因表达,因此,可以认为Nrf2是多种肝脏疾病肝组织损伤的生物靶点。
动物实验证实,NAFLD大鼠肝组织Nrf2基因表达下调显著加剧了其纤维化进程,相反,特异性敲除Keap1基因后,大鼠Nrf2的表达增强,蛋氨酸和胆碱缺乏饮食诱导的脂肪肝症状减轻[33]。本研究结果表明,NS诱导大鼠肝组织Nrf2、NQO-1、HO-1 mRNA和蛋白表达显著降低(P<0.05),Keap-1 mRNA和蛋白表达显著上升,表明尼古丁注射导致大鼠肝组织Nrf2/HO-1/Keap1通路活性被抑制。有证据表明,运动参与了肝组织Nrf2调节,即,有氧运动可以上调肝脏纤维化患者外周血单个核细胞Nrf2表达[34]。有动物实验证实,8周跑台训练方案后,NAFLD大鼠肝脏Nrf2转录活性增加,HO-1蛋白表达上升,肝组织凋亡介质表达显著降低[35]。Nrf2激活诱导HO-1活化也可以在抗炎机制中发挥作用,HO-1可以显著降低肝脏、脑和肾脏等多个器官中NF-κB和NLRP3活性,同时降解炎症介质。说明规律运动可以通过激活Nrf2/HO-1通路活性减轻肝脏炎症损伤和细胞凋亡,但遗憾的是,运动激活Nrf2/HO-1的具体机制尚不清楚。因此,可以认为游泳运动通过激活Nrf2/HO-1/Keap1通路活性,抑制NS诱导的肝组织炎症反应和细胞凋亡。
4 结 论
4周尼古丁腹腔注射(2.5 mg/kg·bw/d)可以诱导大鼠肝组织损伤;游泳运动干预可能通过调控尼古丁胁迫大鼠肝组织纤维化和Nrf2/HO-1/Keap1通路活性抑制炎症反应和细胞凋亡,调节肝组织代谢,进而减轻大鼠肝组织损伤。
