低温胁迫对暗纹东方鲀肠道氧化应激、细胞凋亡及肠道微生物组成的影响
2024-01-22付东勇张艺然王浩哲毕宜慧孙亦如尹绍武
付东勇, 张艺然, 褚 鹏, 王浩哲, 张 凯,毕宜慧, 孙亦如, 王 涛, 尹绍武
(南京师范大学海洋科学与工程学院,江苏省特色水产育种与绿色高效养殖技术工程研究中心,江苏 南京 210023)
暗纹东方鲀(Takifugu fasciatus)隶属于鲀形目(Tetraodontiformes) 鲀科 (Tetraodonidae)东方鲀属(Takifugu),广泛分布在南海、东海、中国内陆水域和朝鲜半岛并具有溯河洄游习性,在中国长江中下游地区具有悠久的消费历史[1-2]。除此之外,暗纹东方鲀肉质鲜嫩,蛋白质和脂肪的含量丰富,在日本和韩国作为一种生鱼片的原材料,广受欢迎,是一种高经济价值的养殖鱼类。
水温是一种重要的环境因子,对于洄游的暗纹东方鲀更为重要,在自然水体和养殖水体中,均会遇到低温情况。已有研究表明,低温胁迫对暗纹东方鲀肝脏和肌肉的氧化应激、细胞凋亡[3-5]和肠道微生物多样性[6]均有影响,但低温胁迫下暗纹东方鲀肠道氧化应激和细胞凋亡,以及二者与肠道微生物组成的改变之间的联系未被探究。
氧化应激是体内氧化和抗氧化作用失衡,产生自由基导致的负面作用。当氧化应激产生时,鱼体为维持稳态产生应答。低温会诱导暗纹东方鲀肌肉产生活性氧(ROS),扰乱细胞质稳态,导致氧化应激和细胞凋亡[7],例如,以往的研究发现,低温胁迫导致总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSHPx)的活性增加,丙二醛(MDA)含量增加,SOD、CAT和GSH-Px的mRNA表达量相应提高[8-9]。此外,产生的活性氧增加,SOD和GSH-Px活性增加,以补偿过CAT的消耗[10-11],这些都表明低温胁迫会产生氧化应激,并且低温可以激活一种保护性的抗氧化防御反应。低温胁迫同样会诱导细胞凋亡基因表达,细胞凋亡是一种细胞的自主死亡,可以去除不需要或异常的细胞,从而维持内环境的稳定。在小鼠(Mus musculus)的海马体中已经被证明冷暴露与细胞凋亡有关[12],其中含半胱氨酸的天冬氨酸蛋白水解酶(caspase)家族、BCL2-Associated X的蛋白质(BCL2-Associated X,Bax)、B淋巴细胞瘤-2基因(Bcl-2)和p53基因均与细胞凋亡相关[5,13-14]。
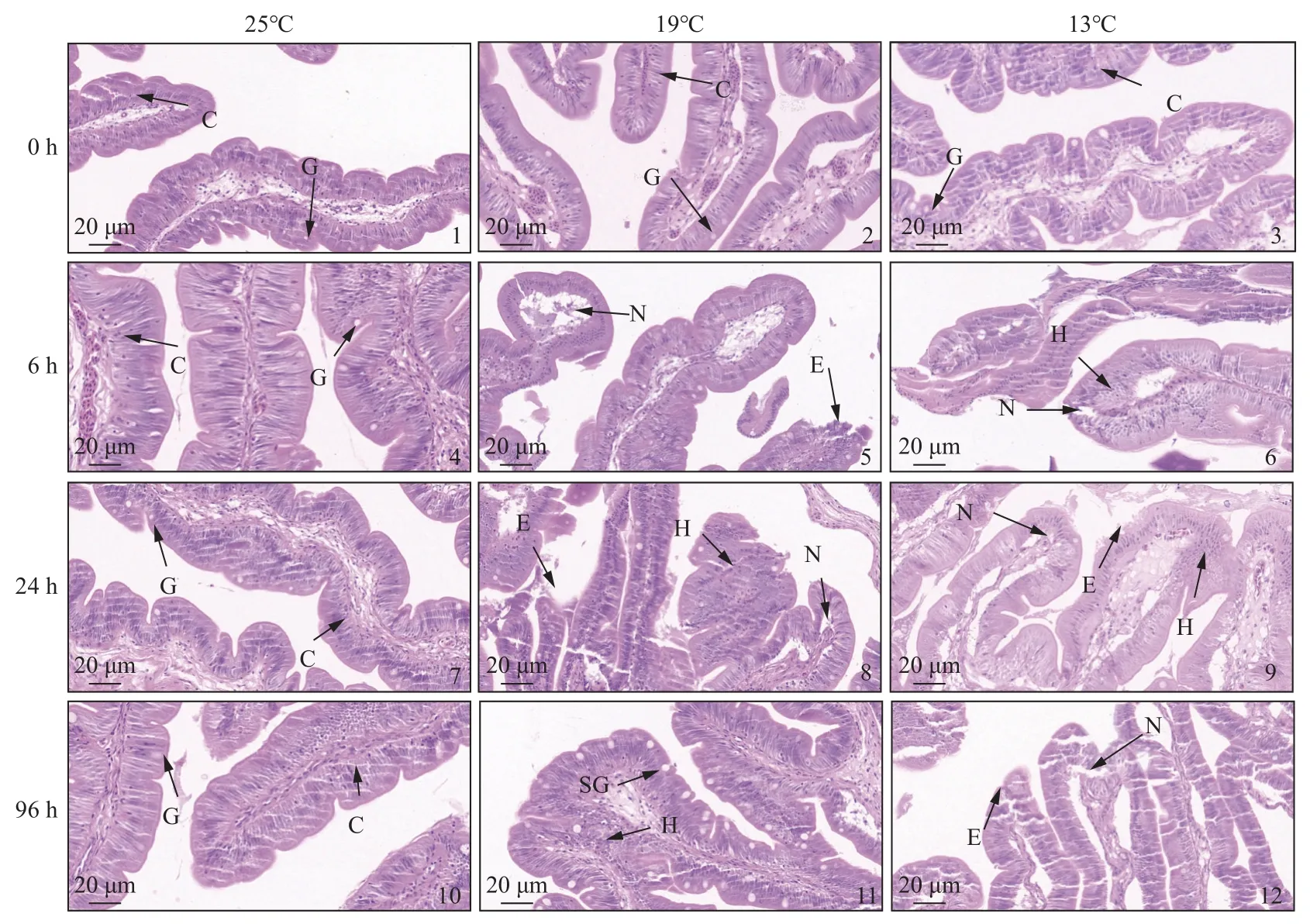
图版 低温胁迫对暗纹东方鲀肠道显微结构的影响C. 柱状细胞,G. 杯状细胞,SG. 杯状细胞肿胀,H. 细胞增生,N. 黏膜层坏死,E. 绒毛糜烂。Plate Effects of low temperature stress on the intestinal microstructure of T. fasciatusC. columnar cells, G. goblet cells, SG. swelling of goblet cells, H. hyperplasia, N. necrosis in the mucosal layer, E. erosion of villi.
肠道菌群是一个复杂的生态系统,能不断适应宿主环境,发挥调节宿主免疫、从食物中获取能量、防止病原体定殖等功能[15]。肠道微生物功能是微生物群-宿主共同进化的结果,并且冷暴露导致微生物群组成的显着变化,称为冷微生物群[16]。肠道通过改变其菌群组成的多样性和微生物的丰度而达到应对低温胁迫的目的。例如,降低肠道微生物的多样性,以达到减缓了饮食发酵并削弱能量需求的目的,或者通过刺激其精氨酸和脯氨酸代谢途径,在促进宿主对低温胁迫的抵抗力方面发挥着至关重要的作用[17-20]。
本研究目的在于探讨低温胁迫对暗纹东方鲀肠道氧化应激、细胞凋亡及肠道微生物组成的影响,以及肠道微生物组成的变化与氧化应激和细胞凋亡的相关性,以期为暗纹东方鲀健康养殖和培育抗寒新品种提供参考。
1 材料与方法
1.1 实验对象
暗纹东方鲀由江苏中洋集团股份有限公司提供。鱼在正式实验前驯化了14 d,期间喂食商业饲料(江苏中洋股份有限公司提供,蛋白质42.0%、脂肪8.0%、Ca 0.35%~0.50%、P 1.2%、NaCl 0.3%~2.5%)每天2次,直到正式实验处理前24 h。将270 尾暗纹东方鲀幼鱼[体长(13.00±1.55) cm,体重(25.00±1.85) g]随机转移到9个有生物过滤的循环水养殖水族箱(配备冷却和加热功能,体积为80 L, 流速为2 L/min),每个水族箱中30尾。单个水族箱的温度为(25.0±0.5) °C,盐度约为3,溶解氧>7 mg/L,光周期为 12 h/12 h,pH值为7.0±0.5。盐度使用AZ 8 372盐度计(衡欣科技股份有限公司)进行测量。温度、溶解氧含量和氢离子浓度使用8 631 AZ IP67复合水表(衡欣科技股份有限公司)测量。
1.2 实验设计和样本处理
暗纹东方鲀的最适温度为23~32 °C,摄食率在19 °C开始下降,13 °C出现冻伤和静止现象,但在实验过程中不存在冻死情况,因此,参照前期研究[21],设计了一个温度和时间双因素实验(温度:25、19和13 °C,时间:0、6、24和96 h),其中13和19 °C作为实验处理温度,每个处理重复3次。本实验中,水温以0.85 °C/h的速率从25 °C分别下降到19和13 °C,以防鱼体因温度快速降低而出现急性应激反应,其中19 °C处理组在13 °C处理组由25 °C降到19 °C后同时降温,以保证13、19和25 °C的0 h在同一时间进行取样。每个处理组的9尾鱼从3个平行循环水养殖水箱中随机抽取(每个平行3尾),用MS-222 (10 mg/L)麻醉,立即收集暗纹东方鲀肠道中肠组织,然后用预冷的0.86%生理盐水冲洗2次去除血液,收集后储存在–80 °C,用于分子实验。另取每组处理的3尾鱼中肠,保存于4%的多聚甲醛溶液中,用于显微结构观察。本研究获得了南京师范大学实验动物伦理委员会批准(SYXK2015-0028),实验过程中操作人员严格遵守南京师范大学实验动物伦理规范,并按照南京师范大学实验动物伦理委员会制定的规章制度执行。
1.3 氧化应激酶活性测定
肠组织按照1∶9 (质量体积比)在生理盐水中匀浆,4 °C、2 500 r/min离心10 min,静止取上清液,分装保存在−20 °C。T-SOD、CAT、GSH-Px的活性以及MDA的含量使用商业试剂盒(南京建成生物工程研究所)进行测定,匀浆的蛋白质浓度使用Bradford 的方法[20]。
1.4 肠道组织病理观察
根据Al-Bairuty等[22]报道的方法进行肠道显微结构的观察,即4% 多聚甲醛中24 h后用不同浓度的乙醇(75%、85%、90%、95%和99.5%)脱水。然后将脱水的组织包埋在石蜡中。将样品制备成7 μm厚度,并用苏木精-伊红(H.E) 染色。图像使用 Nikon Eclipse E100 显微镜和 NIKON DS U3 成像系统获得。使用Pan noramic Viewer 软件(3DHISTECH Ltd.,匈牙利)捕获摄影图像。
1.5 细胞凋亡相关基因的表达测定
使用高纯度 RNA 快速提取试剂(BioTeke,中国)提取总 RNA。使用HiScript®Reverse Transcriptase (Vazyme, 美国)将纯化的RNA逆转录成cDNA,然后立即储存在−20 °C以进行后续实时定量PCR (qRT-PCR),测定细胞凋亡相关基因(caspase-3、caspase-7、caspase-9、Bcl-2、Bax和p53)的表达量。β - actin用作对照基因[20],每个实验重复3次。每个基因的相对表达水平由2−ΔΔCt方法确定。用于qRT-PCR的引物见表1。

表1 引物列表Tab. 1 List of primers used in this study
1.6 16S rRNA二代测序
根据Zheng等[20]报道的实验方法,使用商业试剂盒QIAamp®Fast DNA Stool Mini Kit (Qiagen,德国)从肠道内容物中提取细菌DNA。总DNA浓度用NanoDrop 分光光度计 (Thermo Scientific Inc.,Waltham,美国),OD260/OD280比率为1.8~2.0,并通过 1%琼脂糖凝胶电泳,以提取的DNA为模板扩增细菌16SrRNA的V3~V4区。使用引物338F(ACTCCTACGGGAGGCAGCA)和806R (GGACTACHVGGGTATTCTAAT) 扩增该区域。Phusion High-Fidelity PCR Master Mix 和来自商业试剂盒New England Biolabs (Ipswich,美国)的GC缓冲液用于PCR:95 °C 2 min; 98 °C 10 s,62 °C 30 s,68 °C 30 s,27个循环;最后68 °C 10 min。然后使用Qiagen凝胶提取试剂盒(Qiagen,Hilden,德国)纯化 PCR 产物。
16SrRNA的Illumina HiSeq™ 2500测序由GENE Denovo (武汉)在PCR扩增子文库中进行。基于之前的研究[20],将测序数据经过去引物、拼接、质量过滤等步骤,聚类形成操作分类单元(OTU)。使用基于SILVA数据库(https://www.arbsilva.de/)的RDP分类器(2.2版),使用原生贝叶斯模型对暗纹东方鲀肠道菌群的代表性序列进行分类,置信度阈值为 0.8 和1.0。使用Krona (2.6 版)可视化每个分类学分类的丰度统计数据。使用R Core Team (2017) 计算并绘制了基于加权Unifrac距离的组间alpha指数和主坐标分析(PCoA)的比较。使用Welch的t检验、Wilcoxon 秩检验、Tukey氏的HSD检验、Kruskal-WallisH检验以及R中Adonis和Anosim检验进行数据的统计分析。
1.7 数据分析
实验所得数据均使用平均值±标准差的方式表示,所有数据均用SPSS 22.0软件进行统计分析。利用方差分析(One-Way ANOVA)进行显著性检验,用最小显著性差异法(LSD)分析差异。
2 结果
2.1 暗纹东方鲀肠道H.E染色切片
在25 °C时,0、6、24和96 h肠道没有明显损伤。但在13和19 °C时,肠道发生明显损伤,包括杯状细胞肿胀(SG)、细胞增生(H)、黏膜层肿胀(N)、绒毛糜烂(E)和绒毛断裂(F),且随着温度的降低,损伤加重,在13 °C下的24和96 h最严重(图版)。
2.2 暗纹东方鲀肠道氧化应激指标
在25 °C时,T-SOD、CAT和GSH-Px的活性以及MDA的含量随着时间的变化没有产生显著影响(图1)。与对照组相比,T-SOD的活性在19和13 °C显著提升,在13 °C 24 h达到最高。MDA含量在13 °C时显著升高,并且在24 h达到最高。GSH-Px的活性在13 °C时显著升高,并且分别在19 °C 24 h和13 °C 96 h达到最高。CAT的活性在13 °C时显著升高,并且在13 °C 24 h达到最高(图1)。
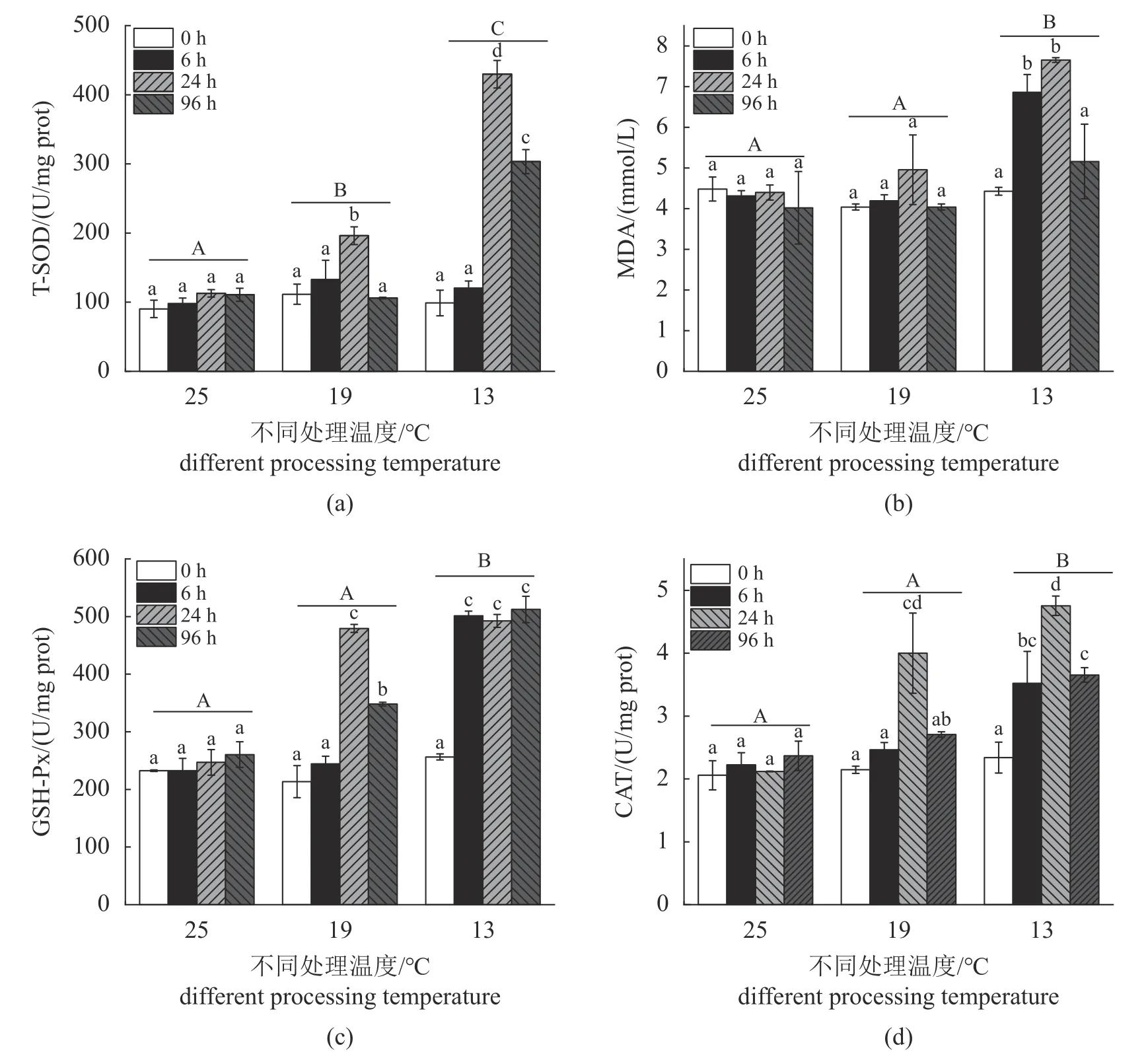
图1 低温胁迫对暗纹东方鲀肠道氧化应激的影响(a) T-SOD,(b) MDA,(c) GSH-Px,(d) CAT;不同小写字母代表各处理间差异显著(P<0.05),不同大写字母代表不同温度间差异显著(P<0.05),下同。Fig. 1 Effects of low temperature stress on the intestinal oxidative stress of T. fasciatus(a) T-SOD, (b) MDA, (c) GSH-Px, (d) CAT; different lowercase letters represent significant differences among treatments (P<0.05), and different uppercase letters indicate significant differences between treatments at different temperatures (P<0.05), the same below.
2.3 细胞凋亡相关基因表达
参与细胞凋亡的caspase-3、caspase-7、caspase-9、p53、Bcl-2和Bax的mRNA表达水平。在对照组(25 °C)的4个时间段内没有显著差异。与对照组相比,19和13 °C表达量显著升高,caspase-3、caspase-9、Bcl-2、Bax和p53在13 °C 24 h表达量达到最高,caspase-7的表达量在13 °C 96 h达到最高(图2)。
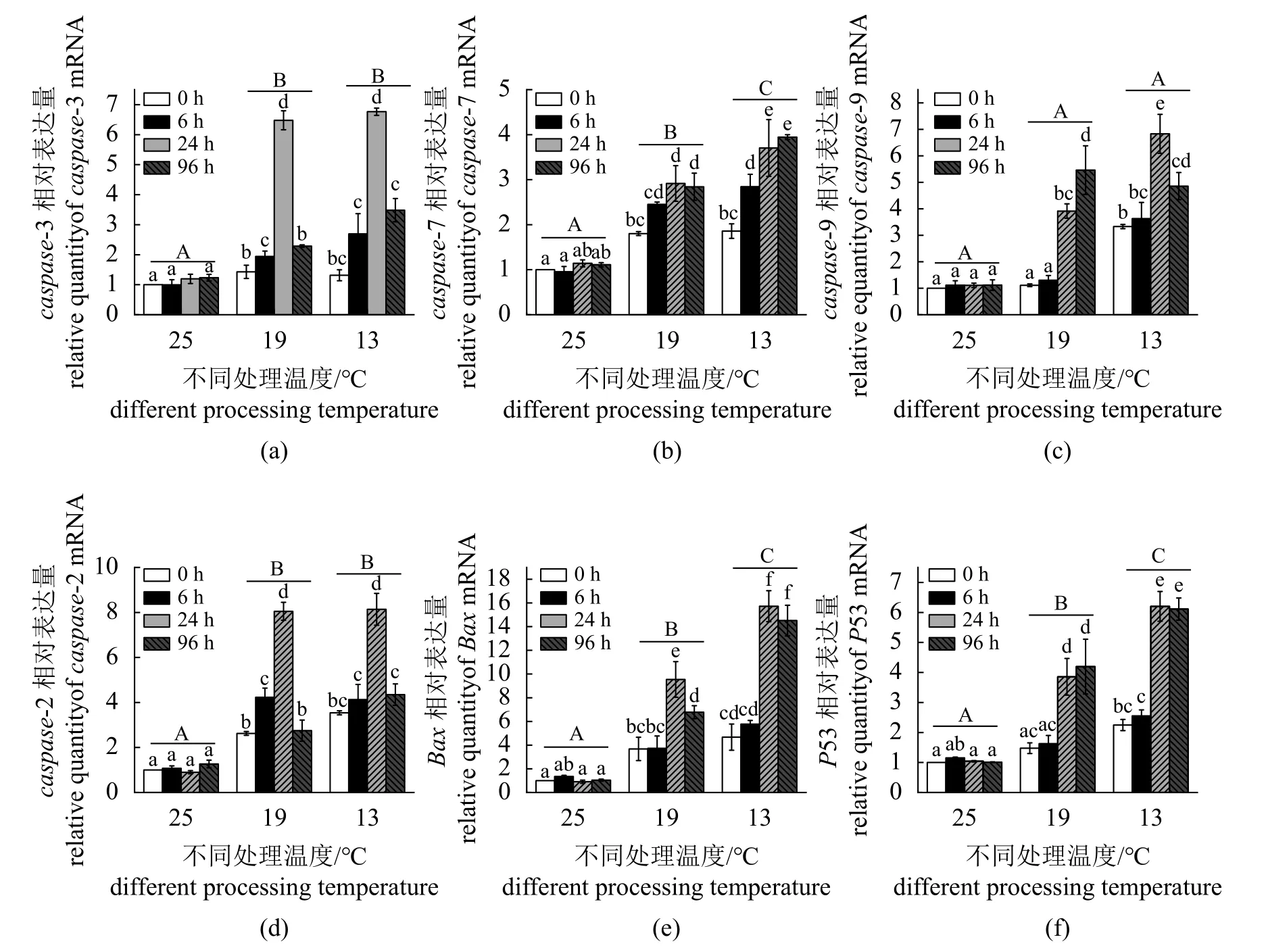
图2 低温胁迫对暗纹东方鲀肠道细胞凋亡的影响Fig. 2 Effects of low temperature stress on the apoptosis of intestinal cells of T. fasciatus(a) caspase-3, (b) caspase-7, (c) caspase-9, (d) Bcl-2 , (e) Bax, (f) p53.
2.4 肠道微生物组成
肠道微生物的主成分会随着温度和时间的变化而发生改变。不同温度下的肠道具有独特的肠道微生物组成和部分相同的肠道微生物组成,其中相同肠道微生物种类为67种。且随着温度的降低,微生物多样性呈下降趋势。肠道微生物的门水平中,变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)相对丰度较高,随着温度的降低,厚壁菌门与拟杆菌门(Bacteroidetes)的比值降低(图3)。
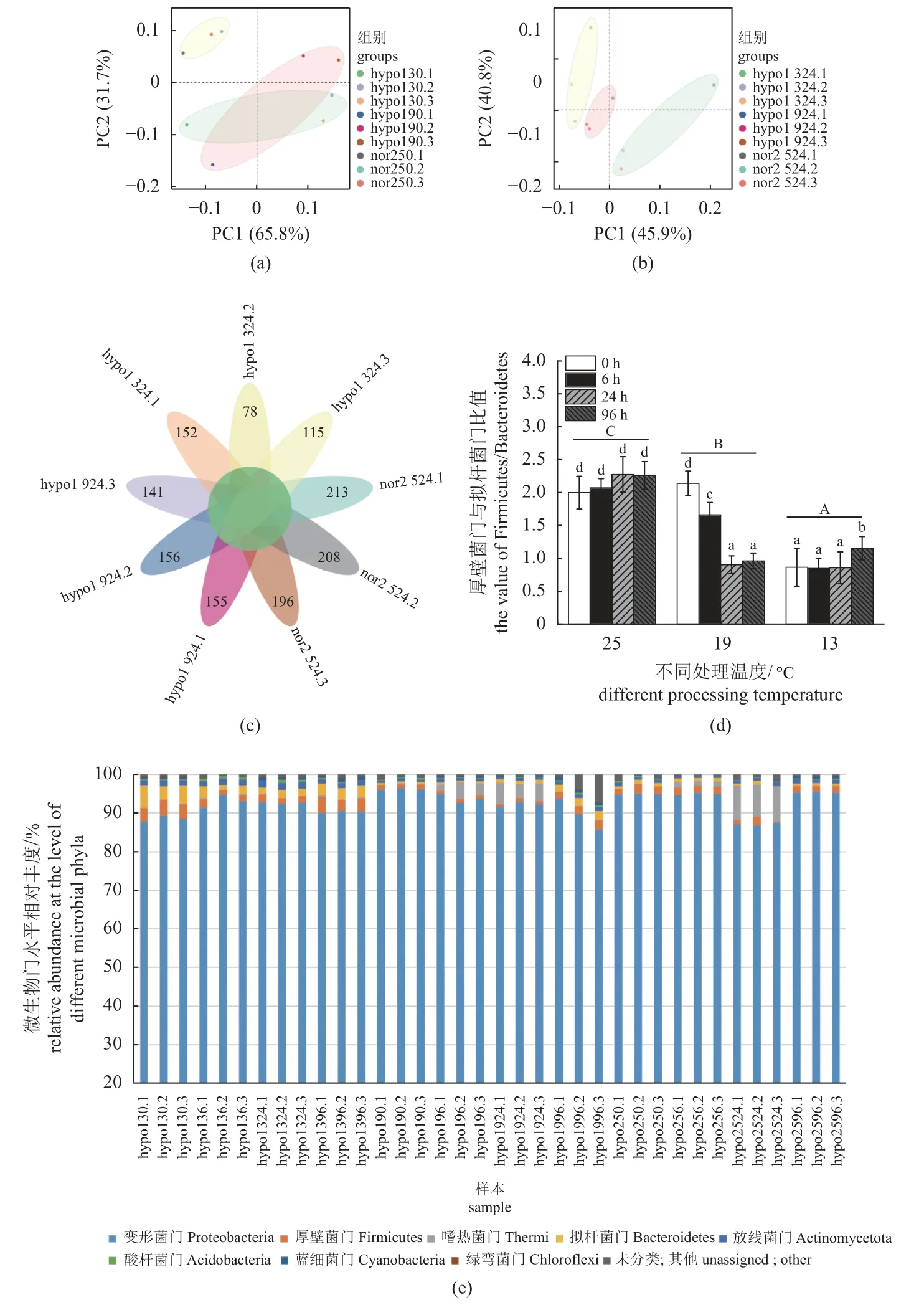
图3 低温胁迫对暗纹东方鲀肠道微生物组成的影响(a) 0 h肠组织的主坐标分析(PCoA),(b) 24 h肠组织的主坐标分析(PCoA),(c) 肠道微生物组成多样性,(d) 图e中,厚壁菌门与拟杆菌门之间的比值,不同小写字母代表各个处理间差异显著(P<0.05),不同大写字母代表不同温度之间差异显著(P<0.05);(e) 不同微生物门水平的相对丰度。hypo代表低温处理,nor代表常温处理,13、19和25代表处理温度(°C),0代表时间为0 h,24代表时间为24 h,1~3代表生物学重复。Fig. 3 Effects of low temperature stress on the intestinal microbial composition of T. fasciatus(a) principal coordinate analysis (PCoA) of intestinal tissue at 0 h, (b) PCoA of intestinal tissue at 24 h, (c) diversity of gut microbial composition, (d) in panel e, the ratio between Firmicutes and Bacteroides, different lowercase letters represent significant differences among treatments (P<0.05), and different uppercase letters indicate significant differences between treatments at different temperatures (P<0.05), (e) relative abundance at the level of different bacterial phyla. hypo stands for low temperature treatment groups, nor for normal temperature, 13, 19 and 25 for treatment temperature (°C), 0 for 0 hour, 24 for 24 hour, 1-3 stand for biological replicates.
2.5 肠道微生物属水平丰度变化与氧化应激、细胞凋亡间的Pearson相关性分析
肠道微生物属水平丰度随着时间和温度的变化而变化。与对照组相比,19和13 °C,黄色杆菌属(Xanthobacter)、副球菌属(Paracoccu)、乳球菌属(Lactococcus)和双歧杆菌属(Bifidobacterium)呈现显著上升;梭菌属(Clostridium)、气单胞菌属(Aeromonas)和嗜热芽孢杆菌属(Geobacillus)呈现显著下降。其中副球菌属、乳球菌属和双歧杆菌属在13 °C 96 h达到最高,乳球菌属在13 °C 24 h达到最高,气单胞菌属和嗜热芽孢杆菌属在13 °C 24 h达到最低,梭菌属在13 °C 6 h之后丰度为0 (表2)。在测定的氧化应激、细胞凋亡等相关基因表达量与肠道微生物丰度的Pearson相关性中,双歧杆菌属仅与MDA含量无显著相关性。乳球菌属仅与CAT、MDA和caspase3具有Pearson相关性。嗜热芽孢杆菌属和副球菌属与氧化应激和细胞凋亡所有测定基因均具有Pearson相关性,黄色杆菌属和气单胞菌属与MDA含量和caspase-3无相关性,梭菌属与T-SOD活性和MDA含量无显著相关性(图4)。
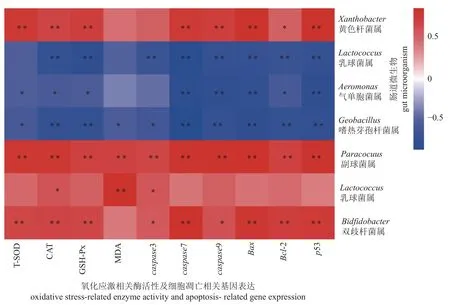
图4 暗纹东方鲀肠道微生物组成与细胞凋亡、氧化应激之间的Pearson相关性分析相关系数为正表示正相关,为负表示负相关。*. P<0.05,**. P<0.01。Fig. 4 Pearson correlation analysis between intestinal microbes, apoptosis and oxidative stress of T. fasciatusA positive correlation coefficient indicates a positive correlation, and a negative correlation indicates a negative correlation. *. P<0.05, **. P<0.01.
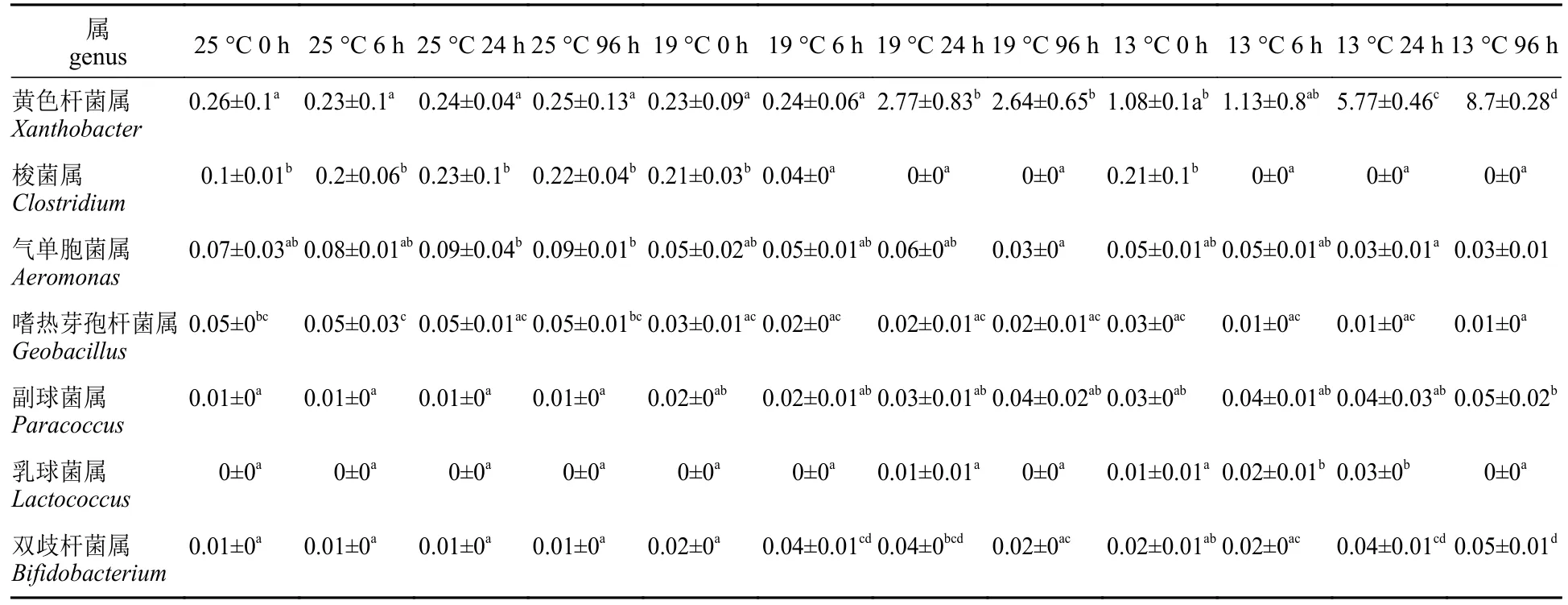
表2 暗纹东方鲀肠道微生物属水平相对丰度Tab. 2 Relative abundance of the intestinal microbial genus in T. fasciatus%
3 讨论
3.1 低温诱导暗纹东方鲀肠道损伤和氧化应激
H.E染色切片结果显示,与正常的对照组相比,随着温度降低和时间延长,肠道发生生理损伤并且加重,如杯状细胞肿胀、细胞增生、黏膜层坏死和绒毛糜烂[22-23]。已知杯状细胞主要分布在消化道,是一种黏液细胞,具有酸性和中性黏蛋白,可润滑上皮并帮助消化,当上皮细胞受损和免疫防御时,可以参与警报信号[24]。而低温应激会使杯状细胞发生肿胀,损害肠道功能。此外,肠道黏膜层发挥着吸收水分的作用,绒毛起着增大肠道吸收面积的功能,黏膜层和肠道绒毛的损坏,会破坏肠道的完整性和损害肠道的免疫功能和吸收功能。已有的研究表明,细胞凋亡在维持肠黏膜细胞稳态中也起到重要作用[23],本实验的研究结果也显示,低温胁迫会对肠道的显微结构产生影响,破坏肠道完整性。
低温会诱导ROS产生过量,扰乱细胞质稳态,导致氧化应激。而过量的ROS受ROS清除系统的调节,以此保持平衡。在以往的研究中发现,低温胁迫诱导凡纳滨对虾(Litopenaeus vannamei)肝胰腺的 SOD、CAT、MDA和GSH-Px表达量增加[10],这和本研究结果类似,与对照组相比,在低温实验中氧化应激升高。其中,SOD是已知使用自由基作为底物并催化超氧阴离子歧化的酶,同时谷胱甘肽过氧化物酶的生理功能主要是催化谷胱甘肽(GSH)参与过氧化反应,在体内协同CAT参与过氧化氢分解为H2O和O2,从而降低不饱和脂肪酸的氧化程度,保持细胞膜的稳定性[25]。并且低温诱导MDA含量升高,表明造成了脂质过氧化作用,产生的超氧自由基更多[20]。而氧化的终产物为MDA[20],与SOD的变化吻合。实验表明,在低温应激的早期,SOD、CAT、MDA和GSH-Px显著升高,但在更长期低温96 h时,会有下降趋势。推测肠道在低温应激时产生大量ROS,所以需要更多的SOD来消除氧化应激,SOD作为酶保护系统的第一道防线,活性增加也被证实是一种抵抗寒冷的重要机制[26-27]。与此同时,CAT和GSH-Px的活性提高辅助氧化应激的消除,氧化的最终产物MDA也会增高。但在长期低温(96 h)应激下,鱼体会有修复机制,导致仍处于氧化应激,但程度降低[21]。本实验结果表明,与对照组相比,实验组中SOD、CAT、MDA和GSH-Px活性显著上升,在96 h有所降低,但是暗纹东方鲀依然处于氧化应激状态。
3.2 低温诱导暗纹东方鲀肠道细胞凋亡
氧化应激与细胞凋亡是密切相关的生理现象[28]。已有报道,低温应激会诱导暗纹东方鲀肝脏和血液中发生细胞凋亡[29]。在细胞凋亡的路径中,Bcl-2是细胞凋亡的关键调节剂,能抑制细胞凋亡,对发育、组织稳态和抵御病原体至关重要[30]。而Bax在体内与Bcl-2发生同源二聚体并形成异源二聚体,过度表达的Bax还对抗Bcl-2抑制活性。而且Bax/Bcl-2是一个细胞凋亡的主要参数,它们之间的平衡决定了细胞的生存和凋亡[31]。它们通过控制线粒体膜的通透性来调节细胞凋亡激活物如细胞色素C的释放,从而调节细胞凋亡。在本研究中,与对照组相比,Bax和Bcl-2的表达含量增高,Bax/Bcl-2的比值升高。推测,比值的升高是Bcl-2的表达相对Bax被抑制,因为形成的二聚体减少,导致了细胞凋亡加剧,此结果与布氏田鼠(Lasiopodomys brandtii)心肌细胞中的研究报道一致[14]。在以往的研究中,包括p53、caspase家族在内的凋亡相关基因在应对低温应激时也往往表达上调[29,32]。Caspase9参与细胞凋亡,在细胞凋亡途径中,前凋亡信号启动后,将激活下游的caspase,从而导致DNA修复的抑制并启动DNA降解[33]。p53作为一种核转录因子,调节许多参与细胞凋亡的基因,主要通过与Bcl-2家族蛋白相互作用并拮抗来介导线粒体凋亡途径,而Bcl-2 家族蛋白可以激活随后的caspase级联[34]。例如,在小鼠角膜内皮细胞(CEC)冷冻损伤后caspase3被激活[32]。瘤背石磺(Onchidium reevesii)冷应激条件下肝胰腺中caspase9和caspase3的表达水平均显著上调[35]。低温胁迫诱导暗纹东方鲀肝脏和血液中包括p53、caspase9和caspase3在内的凋亡相关基因表达上调[29]。此次肠道实验结果中观察到的现象也一致,呈现低温胁迫导致caspase9、caspase3、caspase7和p53的表达量随着温度下降而升高。此外,除caspase3,在19或13 °C的0 h时,低温胁迫后与细胞凋亡相关的基因也出现了表达量上升的情况,推测外界低温诱导肠道发生了细胞凋亡,并且启动了caspase和p53途径,这可能是暗纹东方鲀应对低温胁迫的一种调控机制。这些现象在其他物种中也有所发现,例如斑马鱼(Danio rerio)调节细胞凋亡和p53信号通路来抵御低温胁迫[5];遮目鱼(Chanos chanos)肝细胞在低温胁迫下caspase3活性上调,进而诱导细胞凋亡[13];低温胁迫诱导布氏田鼠心肌线粒体Bax/Bcl-2蛋白含量升高[14]。这些都可以说明细胞凋亡被低温胁迫所诱导。
3.3 低温胁迫改变暗纹东方鲀肠道微生物的组成
本研究的主坐标分析结果表明,与对照组相比,13和19 °C组的暗纹东方鲀肠道微生物的组成发生改变,而且不同温度的暗纹东方鲀肠道微生物构成不同。在前期研究中发现,冷应激会降低凡纳滨对虾微生物群落的组成,总体上改变细菌群落并降低对病原体的免疫力和抗菌活性[36]。此外,体重200 g左右的暗纹东方鲀在低温下肠道微生物的群落组成也发生改变,多样性呈下降趋势[6],这与体重为25 g左右的暗纹东方鲀幼鱼中的研究结果一致。花瓣图也表明,微生物的多样性随着温度的降低而降低。这种现象可能是因为低温(19和13 °C)胁迫导致。而且,较少的微生物组成群落也会有较低的能量需求。结果显示,微生物门水平相对丰度表达也发生变化,其肠道中拟杆菌门和放线菌门丰富[37],这与小鼠在低温胁迫下的研究结果相似。厚壁菌门/拟杆菌门在肠道中是一个重要的比值,往往与肠道中的代谢和短链脂肪酸相关[38-40]。在本研究中,暗纹东方鲀肠道中厚壁菌门和拟杆菌们是优势菌,且厚壁菌门/拟杆菌门比值随着温度的降低而降低。有研究表明,厚壁菌门/拟杆菌门比例下降导致机体产生短链脂肪酸含量下降[41],结合本研究结果,可以推测暗纹东方鲀肠道减少了短链脂肪酸的产生,从而应对低温胁迫。
3.4 暗纹东方鲀在低温胁迫下的肠道微生物与氧化应激和细胞凋亡相关性
在肠道中有许多微生物与机体的肠道正常功能和健康状况息息相关,在以往的研究中可以看出,黄色杆菌属、气单胞菌属和副球菌属是致病菌,双歧杆菌属、乳球菌属、嗜热芽孢杆菌属和梭菌属是益生菌[17-20]。暗纹东方鲀低温胁迫下,肠道中属水平微生物相对丰度也发生改变,如致病菌黄色杆菌属和副球菌属相对丰度上升,气单胞菌属下降;益生菌双歧杆菌属和乳球菌属上升,嗜热芽孢杆菌属和梭菌属下降。并且,在低温胁迫时肠道氧化应激和细胞凋亡发生。随着肠-脑轴概念的提出[42],发现肠道微生物发挥着多种关键功能,包括调节宿主免疫、从食物中获取能量、防止病原体定殖等[15]。在实验测定的所有氧化应激和细胞凋亡指标中,双歧杆菌属仅与MDA含量无Pearson相关性;乳球菌属仅与CAT活性、MDA含量和caspase3表达量具有Pearson相关性;黄色杆菌属和气单胞菌属仅与MDA含量和caspase3无Pearson相关性;梭菌属仅与T-SOD活性和MDA含量无Pearson相关性。其中嗜热芽孢杆菌属和副球菌属与氧化应激和细胞凋亡所有测定基因均具有Pearson相关性。推测嗜热芽孢杆菌属和副球菌属可能与暗纹东方鲀肠道氧化应激和细胞凋亡的发生具有密切联系。
4 结论
低温胁迫会导致暗纹东方鲀肠道发生损伤,诱导氧化应激和细胞凋亡,改变肠道微生物组成,并且肠道微生物的改变与氧化应激、细胞凋亡存在Pearson相关性。其中,副球菌属和嗜热芽孢杆菌属可能是一种可用来反映暗纹东方鲀是否处于氧化应激和细胞凋亡状态的潜在微生物。
(作者声明本文无实际或潜在的利益冲突)
