3 种沉水植物对微囊藻的抑制作用及其周丛藻类响应
2024-01-22李龙飞魏颖赵建南董静张景晓高肖飞张曼袁华涛高云霓李学军
李龙飞,魏颖,赵建南,董静,张景晓,高肖飞,张曼,袁华涛,高云霓*,李学军
1. 河南师范大学水产学院,河南 新乡 453007;2. 河南省丹江口水库水域生态系统野外科学观测研究站,河南 南阳 474450
沉水植物因其能够吸收利用营养物质、减少泥沙悬浮、提供栖息生境、化感抑制浮游藻类等作用维持淡水生态系统清水稳态(吴振斌等,2001)。重建沉水植物群落对富营养水体生态系统结构和功能的恢复具有重要作用。在武汉东湖、杭州西湖等浅水湖泊的部分子湖已通过重建沉水植被恢复清水稳态(邱东茹等,1997;Bai et al.,2020)。但在水华蓝藻密度相对较高的水体,沉水植被重建也会受到水华蓝藻及其代谢产物影响(尚媛媛,2013;吴婷婷等,2015)。同时,重建沉水植被对水华蓝藻控制和清水稳态维持的长效性还与所处生态系统中各类生物群落有关(Zhang et al.,2018;Yu et al.,2021),但各类生物如何响应和影响这一过程还不清楚。因此,亟待深入研究沉水植物对水华蓝藻抑制作用的生态响应机制,进一步完善沉水植被恢复理论,提高富营养水体中沉水植被恢复成效。
周丛藻类与沉水植物处于同一生态位,在淡水生态系统稳态转换方面同样具有重要作用(Vadeboncoeur et al.,2002)。周丛藻类的生活史较短,主要固定生活于其所处生境。在环境变化时具有反应迅速、受干扰后群落恢复快等特点,在水体健康监测中对环境指示作用灵敏而成为重要的指示生物(O’Driscoll et al.,2012;Stewart et al.,1985)。在大型沉水植物消亡的富营养湖泊中,随着沿岸沉水植被消退以及浮游藻类得到控制,下层周丛藻类取而代之,在水体食物链中提供更为重要的作用(Soren et al.,2016)。同时,周丛藻类对水层上覆水中营养盐尤其是磷具有良好的吸收作用,并参与维持水体透明度的稳定,促进沉水植物恢复(Guzzon et al.,2008;Zhang et al.,2016;)。但是这一结论目前仍存在争议,周丛藻类与沉水植物在生存空间、养分与光照的竞争也被认为是沉水植物消亡的原因之一(Jones et al.,2003;Zhang et al.,2019)。包括周丛藻类在内的周丛生物群落能够有效控制微囊藻水华,并降解微囊藻毒素(Wu et al.,2010,2011)。那么,周丛藻类群落如何响应和影响沉水植物与微囊藻的相互作用?目前还不清楚。
微囊藻(Microcystis)是广泛分布于温带至热带富营养水体的非固氮水华蓝藻(Xiao et al.,2018),在中国太湖、滇池、美国伊利湖等100 余个富营养水体中检测到微囊藻(Davis et al.,2016;Harke et al.,2016)。已有研究显示穗花狐尾藻(Myriophyllum spicatum)、苦草(Vallisnerianatans)、伊乐藻(Elodea nutttallii)、轮叶黑藻(Hydrillaverticillata)等沉水植物在0.5—10 g·L-1的密度水平能有效抑制密度不高于1×106cells·mL-1的微囊藻(王立新,2005;张兵之,2008;He et al.,2016)。我们最近的研究显示,2 g·L-1穗花狐尾藻对5×106cells·mL-1的微囊藻也可产生一定程度的抑制作用,但沉水植物也会受到一定程度的影响(Gao et al.,2023)。但生态修复中常用的其他沉水植物对高密度微囊藻的抑制作用如何还不清楚。
为此,本研究选择生态修复实践中常用的3 种水鳖科沉水植物苦草、轮叶黑藻和伊乐藻和2 株微囊藻,通过室内可控条件下的草藻共培实验,分析沉水植物和微囊藻相互作用,监测周丛藻类群落结构响应和水质参数变化,进一步探究沉水植物对高密度微囊藻的抑制作用及其周从藻类的响应,为微囊藻占优势水体沉水植物生态修复实践提供理论指导。
1 材料与方法
1.1 实验材料
实验所用苦草、轮叶黑藻、伊乐藻采自湖北省洪泽湖,用清水将植物洗净后室内驯化培养3 个月,培养用水族缸(70 cm×40 cm×50 cm)中铺设15 cm厚水草泥,水温25 ℃,光照强度为3 000 lx,光暗比为12 h∶12 h。实验前1 周向水族缸中添加1/10 BG11 预处理使植物适应营养水平,用于后期实验。预实验和前期研究显示,1/10 BG11 培养基可以满足室内条件下沉水植物正常生长(Gao et al.,2022)。实验用 2 株微囊藻(S1,FACHB1005;S2,FACHB915)藻株均购自中国科学院水生生物研究所(FACHB)淡水藻种库,采用无菌1/10 BG11 培养基进行驯化培养,培养条件与植物相同,培养7 d 至藻类处于指数生长期后用于实验。
1.2 实验设计
共设置11 个实验组,包括3 种植物与2 株微囊藻共培组、3 种植物对照组、2 株微囊藻对照组。对照组设置3 个重复,共培组设置4 个重复。实验采用1 L 烧杯(直径为9 cm,高为15 cm),底部铺设3 cm厚的玻璃珠(直径1—2 cm),高温高压灭菌后再加入500 mL 无菌1/10 BG11 培养液。挑选长势一致、生长状况良好的植物,依次用自来水、无菌水洗净植株表面附着的杂质,吸水纸吸干水分,称量植株鲜质量,暂存于无菌水中。将处理好的植株(苦草平均株长为(39±0.5) cm,轮叶黑藻、伊乐藻平均株长10 cm)按起始鲜质量 (2±0.05) g·L-1种植到植物对照组与草藻共培组烧杯中,再在微囊藻对照组和草藻共培组中分别接种处于指数生长期的S1 与S2 微囊藻藻株,起始密度为 (3.5±0.1)×106cells·mL-1,该细胞密度属于富营养化水体微囊藻水华的密度范围(Xu et al.,2010)。实验周期18 d,培养条件与预培养时相同。
实验期间各组水质指标无明显差异,其中溶解氧维持在 8—9 mg·L-1、电导率在 0.25—0.38 mS·cm-1、溶解性固体总量在124.1—179.2 mg·L-1、pH 维持在7—9、盐度0.13‰—0.18‰、氧化还原电位在101.9—302.3 mV。通过用软毛刷轻轻刷洗3 种植物叶片表面附植藻类,收集刷洗液后加入鲁哥试液固定,鉴定出附植藻类3 门14 属,分别为绿藻门的小球藻(Chlorella)、绿球藻(Chlorococcum)、鞘藻(Oedocladium)等;硅藻门的菱形藻(Nitzschia)、舟形藻(Navicula)、卵形藻(Cocconeis)、异极藻(Gomphonema)等和蓝藻门的泽丝藻(Limnothrix)、细 鞘 丝 藻(Leptolyngbya)、 假 鱼 腥 藻(Pseudanabaena)、色球藻(Chroococcus)等。
1.3 样品采集与指标测定
每3 天采集样品分析微囊藻细胞密度和氨氮、可溶性磷含量变化。藻细胞生长指标收集1 mL 藻液加入鲁哥试剂固定,混匀后取0.1 mL 注入浮游生物计数框,在光学显微镜(E100,Nikon Eclipse,日本)下观察计数。另取10 mL 藻液过0.45 μm 混合纤维水系滤膜,收集滤液稀释后采用纳氏试剂分光光度法测定氨氮,采用钼锑抗分光光度法测定可溶性磷含量。
实验结束时采集植物,分别采用电子天平和钢尺测定植物鲜质量和株长。倾倒各组烧杯中剩余溶液后,再加入50 mL 蒸馏水,采用软毛刷刷取底部玻璃珠及烧杯内壁中藻类,收集刷洗液加入鲁哥试剂固定后定容,鉴定计数(胡鸿钧等,2006)。
1.4 数据分析
使用Microsoft Excel 2016 和SPSS 26.0 软件对所有数据进行统计分析,采用Origin Pro 2023 分析绘图,采用Canoco 5 分析周丛藻类多样性。
2 结果与分析
2.1 微囊藻生长
共培养条件下,3 种沉水植物对2 株微囊藻生长抑制效果显著。第3 天时,苦草、轮叶黑藻、伊乐藻对微囊藻S1 藻株的抑制率分别为25%、25%、47%,对S2 藻株的抑制率分别为43%、55%、61%。伊乐藻对2 株藻抑制率大于轮叶黑藻和苦草。第6 天抑制率均超过80%,9 d 后抑制率均接近100%(图1)。
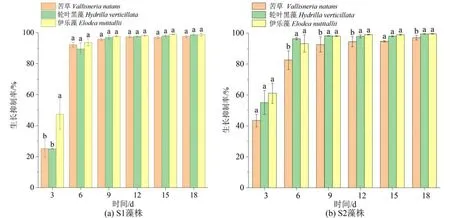
图1 苦草、轮叶黑藻和伊乐藻对2 株微囊藻的生长抑制率Figure 1 Growth inhibition rate of two strains of Microcystis by V. natans, H. verticillata and E. nutttallii
2.2 沉水植物生长
实验期间,伊乐藻和轮叶黑藻鲜质量和株长有轻微增长,单培组增加更多,而苦草部分长叶片从第6 天开始变黄衰败,与微囊藻共培组分解更明显。与植物单培对照组相比,共培组3 种沉水植物株长均受到不同程度抑制,微囊藻S1 和S2 藻株对苦草株长抑制率分别为45%和65%,而对轮叶黑藻和伊乐藻株长的抑制率均低于25%,对伊乐藻株长影响最小(图2)。
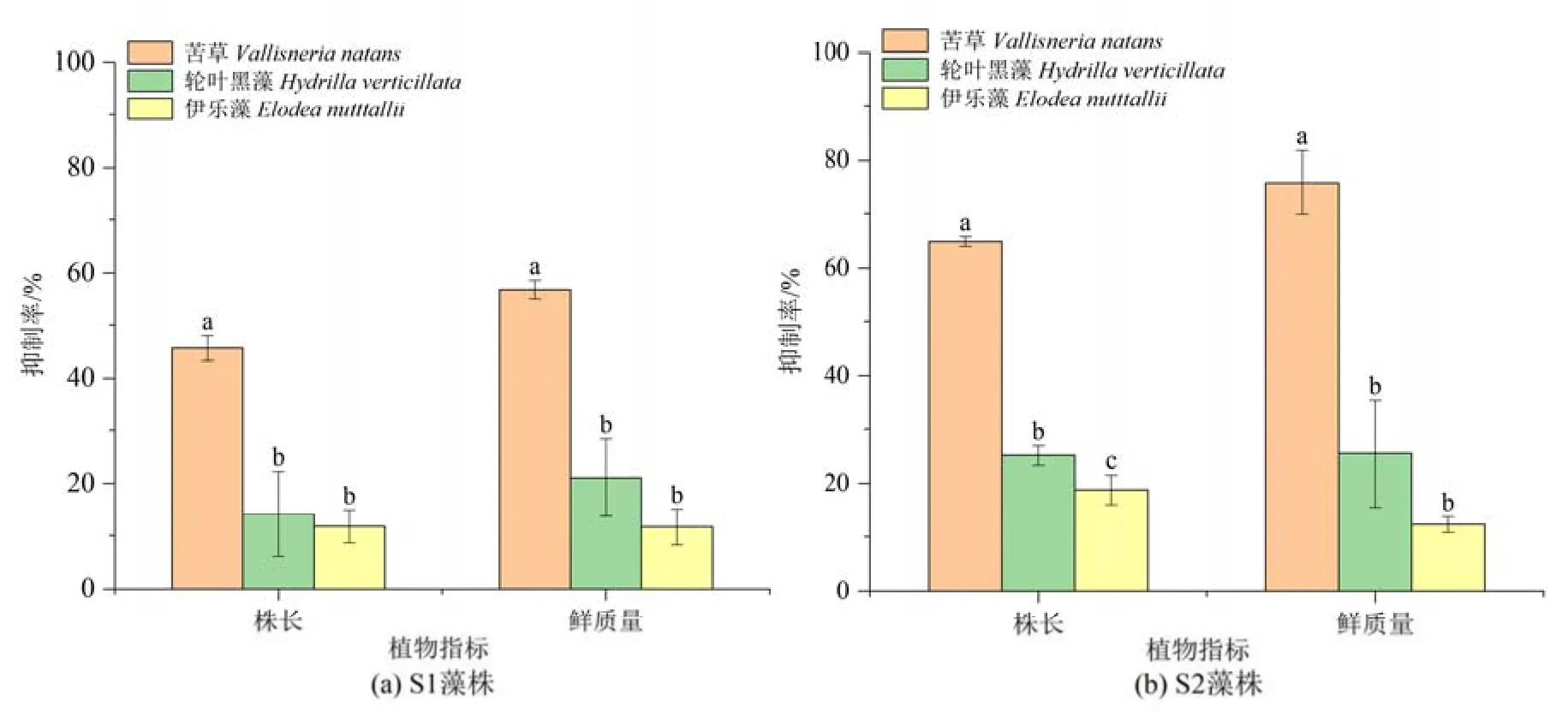
图2 2 株微囊藻对苦草、轮叶黑藻和伊乐藻株长和鲜质量抑制率Figure 2 Inhibition rate on length and fresh weight of V. natans, H. verticillata and E. nutttallii by two strains of Microcystis
实验结束时对照组3 种植物鲜质量均有增长,伊乐藻和轮叶黑藻与微囊藻共培组植物鲜质量也增加,但对照组中植物鲜质量显著高于共培组(轮叶黑藻:P=0.021、P=0.027;伊乐藻:P=0.006、P=0.001)。与植物单培对照组相比,微囊藻S1 和S2藻株对苦草植物鲜质量抑制率最高,分别达到55%和75%,而对轮叶黑藻和伊乐藻植物鲜质量抑制率均在30%以下,对伊乐藻鲜质量影响最小(图2)。
2.3 周丛藻类群落结构
第9 天后,逐步观察到各实验组底部玻璃珠和烧杯内壁出现附着藻类,第18 天实验结束,采集和鉴定周丛藻类,共发现周丛藻类4 门29 科25 属32种,其中苦草组周丛藻类4 门19 属21 种,轮叶黑藻组3 门22 属24 种,伊乐藻组3 门17 属20 种。15 种(属)藻类在3 种沉水植物中都有发现,占总种数的46.9%(图3)。各植物组中周丛藻类总密度明显上升,轮叶黑藻组差异显著(P=0.04、P=0.003)。
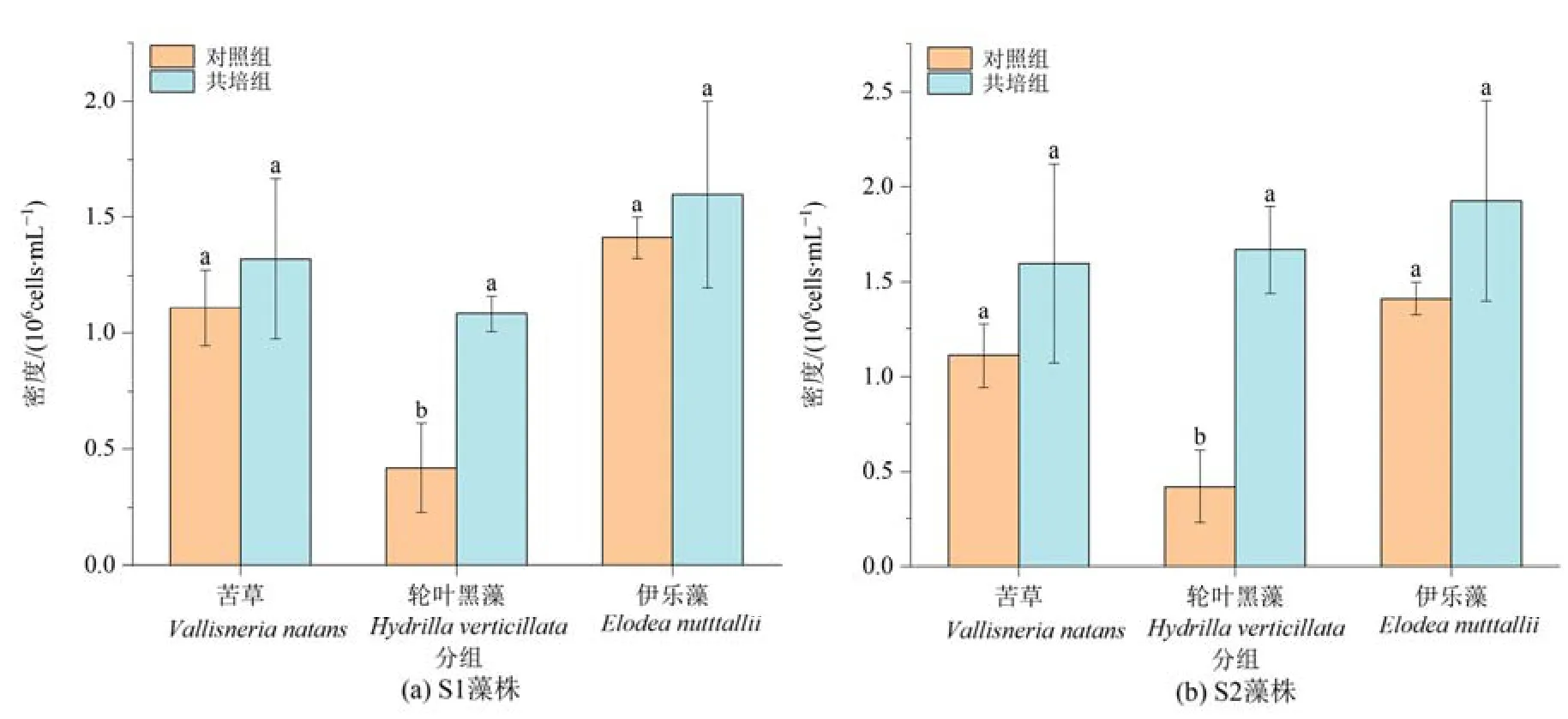
图3 实验结束时苦草、轮叶黑藻和伊乐藻单培对照组及其与微囊藻共培组中周丛藻类密度Figure 3 Density of periphytic algae in monoculture controls of V. natans, H. verticillata and E. nutttallii and co-culture groups with Microcystis
各植物组周丛藻类主要以蓝藻、硅藻和绿藻门藻类为主。苦草单培组绿藻门占绝对优势,轮叶黑藻单培组蓝藻和绿藻占优势,伊乐藻单培组蓝藻、硅藻和绿藻相对密度均较高。与单培对照组相比,苦草与微囊藻共培组硅藻门相对密度均增加,绿藻门均明显减少分别降低了36%和38%;轮叶黑藻与微囊藻共培组中绿藻门相对密度均相应减少,蓝藻门相对密度分别提高了26%和39%;伊乐藻与微囊藻共培组蓝藻门相对密度均增加,硅藻门均减少(图4)。
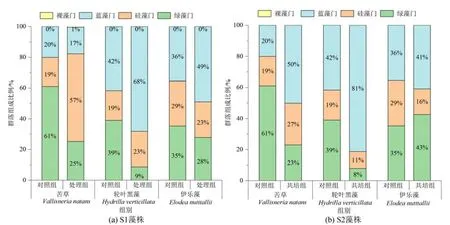
图4 苦草、轮叶黑藻和伊乐藻单培对照组及其与微囊藻共培组中周丛藻类门水平群落组成Figure 4 Community composition of periphytic algae at phylum level in monoculture controls of V. natans,H. verticillata and E. nutttallii and co-culture groups with Microcystis
采用非度量多维尺度分析(NMDS),利用距离矩阵法Bray Curtis 来确定组间差异(图5),应力值为0.014,表明NMDS 解释度良好。第一个轴显示轮叶黑藻组的周丛藻类群落与苦草组、伊乐藻组不同,第二轴显示了3 种植物S1 共培组和S2 共培组周丛藻类群落组成相似,与植物对照组存在差异。
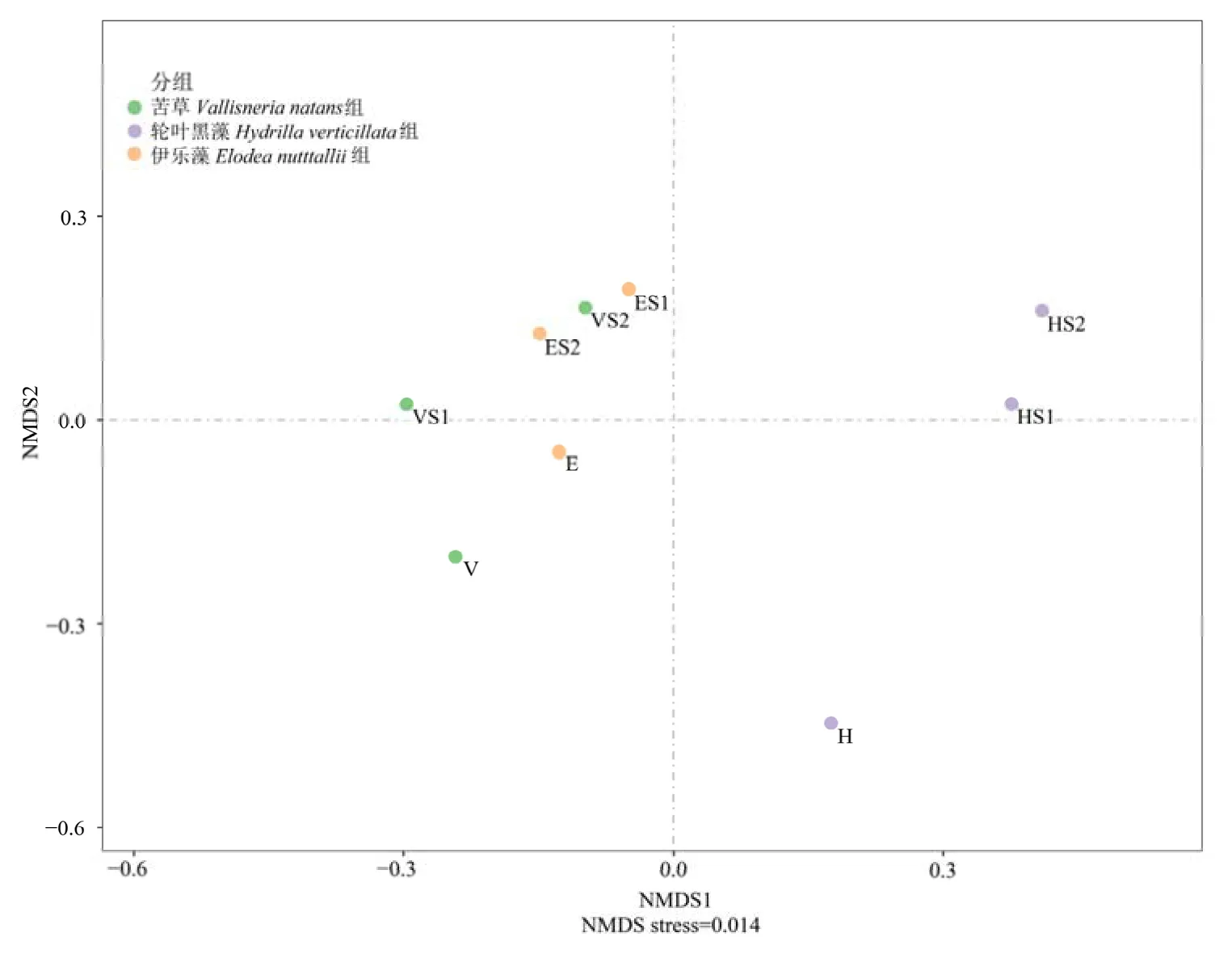
图5 苦草、轮叶黑藻和伊乐藻单培对照组及其与微囊藻共培组中周丛藻类NMDS 分析Figure 5 Non-metric multidimensional scaling (NMDS) diagram of periphytic algae in monoculture controls of V. natans, H. verticillata and E. nutttallii and co-culture groups with Microcystis
由图6 可见,3 种植物对照组中周丛藻类群落结构在属种水平上相似。3 种植物共培组周丛藻类群落结构与植物单培对照组相比差异明显,而3 种植物共培组组间差异不明显。苦草共培组蓝藻门细鞘丝藻(Leptolyngbyasp.)和泽丝藻(Limnothrixsp.)、硅藻门菱形藻(Nitzschiasp.)相对密度明显高于其单培对照组,其中苦草S2 共培组中细鞘丝藻和泽丝藻密度最高分别为3.58×105、4.13×105cells·mL-1;但绿藻门绿球藻(Chlorococcumsp.)明显低于其单培对照组,分别降低了53%和66%。轮叶黑藻共培组蓝藻门色球藻(Chroococcussp.)、细鞘丝藻和泽丝藻相对密度明显高于其单培对照组。其中轮叶黑藻S2 共培组中色球藻和细鞘丝藻密度最高分别为5.84×105、4.61×105cells·mL-1。伊乐藻共培组蓝藻门泽丝藻和菱形藻相对密度明显高于其单培对照组,伊乐藻S2 共培组泽丝藻密度达到7.66×105cells·mL-1,菱形藻密度达到 2.27×105cells·mL-1。
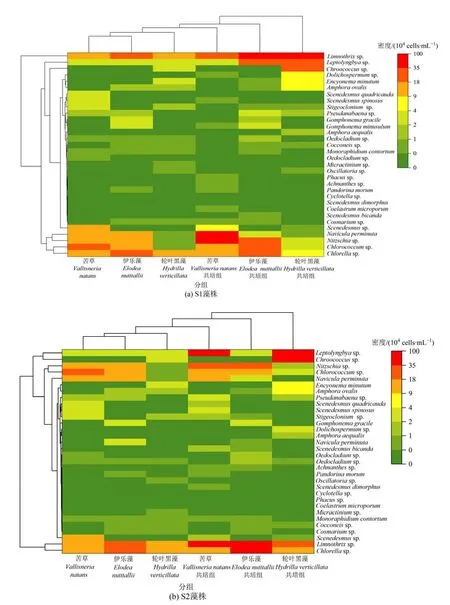
图6 苦草、轮叶黑藻和伊乐藻单培对照组及其与微囊藻共培组中周丛藻类属(种)水平群落组成Figure 6 Community composition of periphytic algae at genus level in monoculture controls of V. natans,H. verticillata and E. nutttallii and co-culture groups with Microcystis
与植物单培对照组相比,植物共培组周丛藻类多样性指数大部分低于其单培对照组。苦草与2 株微囊藻共培组Berger-Parker 指数均与对照组差异显著(P=0.001、P=0.001),其他各共培组与单培组间Berger-Parker 指数、Margalef 指数、Shannon 指数间无显著性差异(图7)。

图7 苦草、轮叶黑藻和伊乐藻单培对照组及其与微囊藻共培组中周丛藻类多样性指数Figure 7 Diversity indices of periphytic algae in monoculture controls of V. natans, H. verticillata and E. nutttallii and co-culture groups with Microcystis
2.4 水化指标
由图8 可知,实验期间植物单培对照组中氨氮含量维持在0.5 mg·L-1左右,微囊藻单培对照组中氨氮含量基本保持在0.5—2.0 mg·L-1之间。从第6天开始,植物与藻株共培组中氨氮含量随时间显著上升,并在第9—12 天时达到峰值,然后逐渐下降,直至实验结束;其中苦草与微囊藻S1 和S2 共培组第12 天时氨氮质量浓度最高,分别达到4.7 mg·L-1和5.7 mg·L-1,是对照组的6.8 倍和8.3 倍。
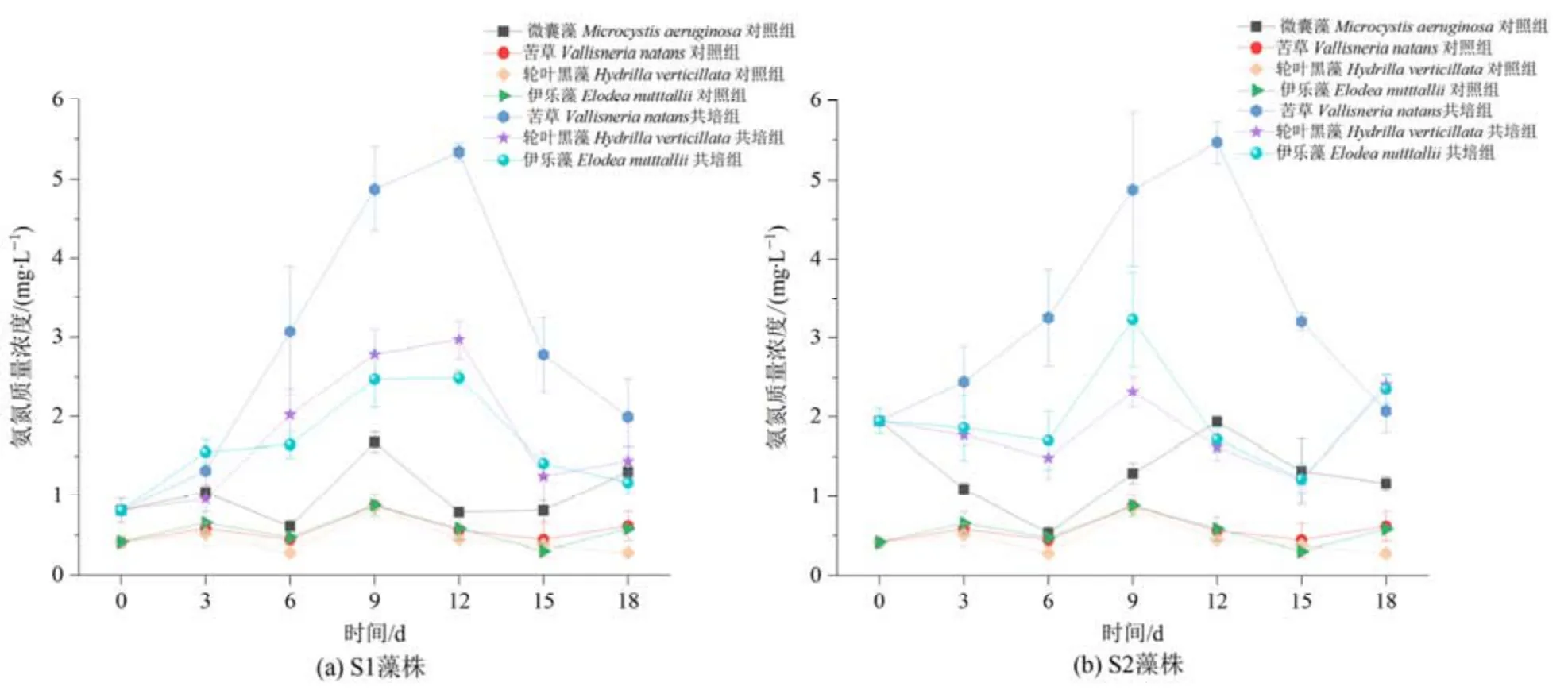
图8 苦草、轮叶黑藻和伊乐藻单培对照组及其与微囊藻共培组中氨氮质量浓度的变化动态Figure 8 Dynamic changes in ammonia concentrations in monoculture controls of V. natans, H. verticillata and E. nutttallii and co-culture groups with Microcystis
由图9 可知,各实验组可溶性磷含量从第3 天开始显著下降,植物和微囊藻单培对照组中可溶性磷含量由起始的0.3—0.5 mg·L-1快速下降到0.05 mg·L-1,并一直保持到实验结束。而各植物共培组第9—12 天时可溶性磷含量出现轻微上升,其中苦草组与微囊藻S1 和S2 共培组第12 天时可溶性磷质量浓度上升最多,分别为0.06 mg·L-1和0.14 mg·L-1,是对照组的3.2 倍和7.1 倍。第15 天开始至实验结束,各组可溶性磷含量继续降低,接近0 mg·L-1。
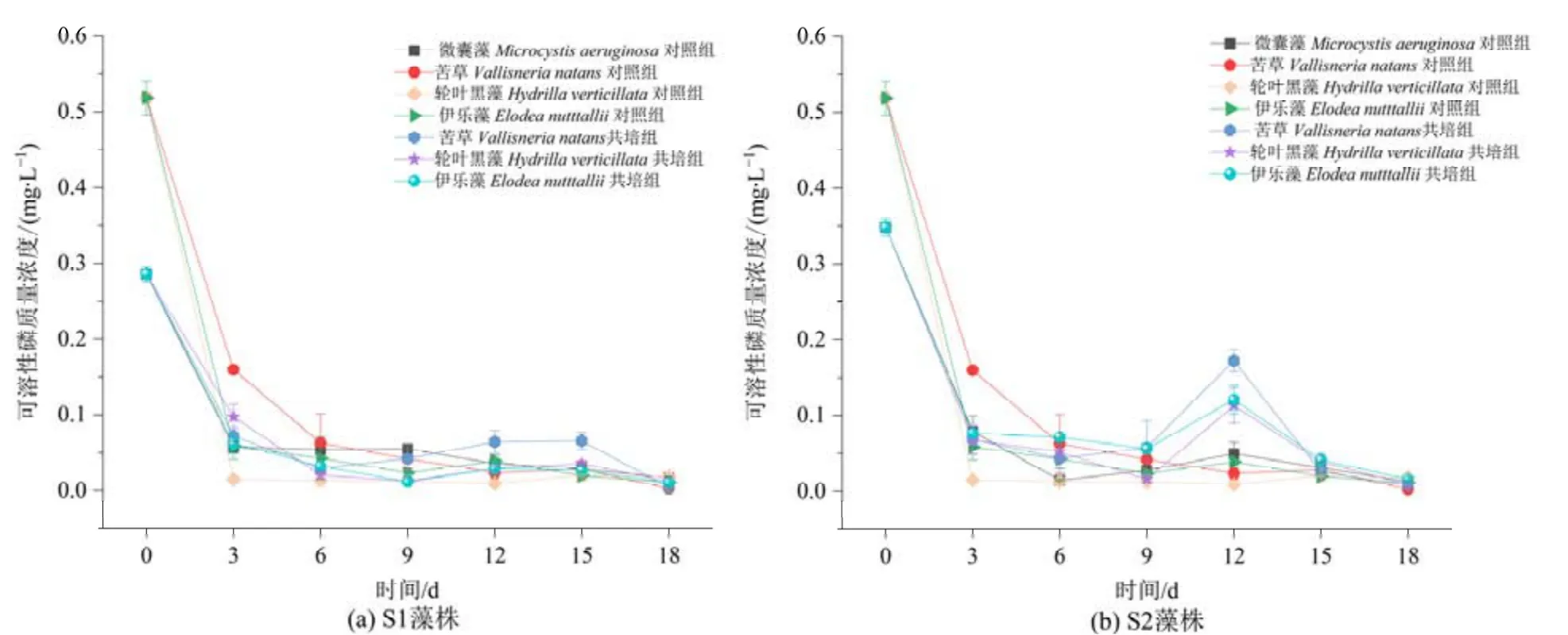
图9 苦草、轮叶黑藻和伊乐藻单培对照组及其与微囊藻共培组中可溶性磷含量的变化动态Figure 9 Dynamic changes in phosphate concentrations in monoculture controls of V. natans, H. verticillata and E. nutttallii and co-culture groups with Microcystis
3 讨论
通过室内可控条件下沉水植物与微囊藻混合共培养实验,发现苦草、轮叶黑藻和伊乐藻3 种水鳖科沉水植物在鲜质量为2.0 g·L-1对起始密度高达(3.5±0.1)×106cells·mL-1的2 株微囊藻均表现出快速抑制作用。以上3 种沉水植物在10.0 g·L-1密度水平的浸提物和分泌物对2 株起始密度为1.0×106cells·mL-1微囊藻生长抑制率仅40.0%—80.0%之间(Wu et al.,2009)。共存状态下水鳖科沉水植物有效抑藻密度更低。由此进一步说明,在排除扰动、浊度、捕食等干扰因素的条件下,水体中水鳖科沉水植物对微囊藻生长繁殖的直接控制潜力可能更大。这可能与共存状态下沉水植物不仅可通过持续释放化感物质,还能通过生态位竞争等机制对微囊藻产生综合影响有关(Gao et al.,2017,2023)。3 种植物相比,伊乐藻的抑藻效率最高,其株长和鲜质量受到2 株微囊藻的影响也最小,而苦草植株受到2 株微囊藻的影响最大。这可能与此次选用苦草为植物成株有关,相对于从根部新长出的苦草叶片,成株叶片较长,对微囊藻的耐受能力可能更弱。但仍需实验进一步验证。不同叶形沉水植物对蓝藻的抑制能力可能存在差异,已有报道显示轮叶黑藻、穗花狐尾藻等针叶形沉水植物比苦草等宽叶形沉水植物对假鱼腥藻生长和异味物质合成的抑制作用更高,可作为先锋物种控制水体异味问题(Yang et al.,2023)。在富营养程度水体恢复沉水植被实践中,伊乐藻和轮叶黑藻常作为先锋物种定植,这可能与其较强的抵抗有害蓝藻和高营养胁迫能力有关(吴振斌等,2011)。
在3 种沉水植物完全抑制2 株微囊藻生长繁殖一段时间后,从植物所处的微生态系统中检测到多种附着在底质、烧杯内壁等处的周丛藻类。与单培对照组相比,植物与微囊藻共培组周丛藻类密度增加,多样性指数降低,藻类群落结构在门和属种水平上也发生了较为明显的变化。由此可见,沉水植物与微囊藻相互作用过程中,随着微囊藻细胞从第6 天开始不断分解死亡,水体透明度增加,更多营养物质释放到水环境中,为周丛藻类生长繁殖创造了条件。整个实验期间单培对照组氨氮含量未出现明显变化,但植物与微囊藻共培组氨氮含量在9—12 d 出现一个峰值,随后逐步下降。共培组中可溶性磷含量在12 d 左右出现轻微上升,同时期我们观察到实验体系中开始出现周丛藻类。周丛藻类通过吸收水体和底部氮磷等营养物质,降低水环境中的营养负荷,有助于沉水植物控制微囊藻后不会受到高浓度营养胁迫,从而持续维持清水稳态(何月,2015;王涛,2021)。
除了附着在底部和杯壁的周丛藻类,沉水植物表面也有附着藻类,观察结果显示,周丛藻类中出现的物种在附植藻中均有出现,进一步证明本实验体系中周丛藻类的来源即为附植藻类。同时附植藻类与沉水植物之间存在更为复杂和多变的相互作用。一方面,附着在沉水植物生物膜上的藻类能够受氮负荷的刺激而生长,并参与协同沉水植物的脱氮过程(Yan et al.,2018)。另一方面,水体中周丛藻类生物量增加,可能通过遮光作用缩短沉水植物占优势的清水阶段(Roberts et al.,2003)。实际水环境中,附着在植物表面、水体底质、其他自然或人工基质上的周丛藻类群落结构的形成和演替可能更为复杂,与沉水植物间存在更为复杂的相互作用(Gubelit et al.,2020;Wijewardene et al.,2022)。在更长时间和空间尺度上,周丛藻类是否有助于沉水植物维持水体清水稳态还有待深入研究(Zhao et al.,2023)。
本研究中还发现植物与微囊藻共培组中,随着微囊藻细胞死亡分解,周丛藻类中泽丝藻、细鞘丝藻等丝状蓝藻密度比植物单培对照组更高,尤其是苦草和轮叶黑藻实验组。泽丝藻和细鞘丝藻已在自然水体中多种沉水植物附着藻类样品中检出,其中细鞘丝藻被报道能够产生和释放微囊藻毒素(Mohamed et al.,2010;Gaget et al.,2017)。附着型比浮游型丝状蓝藻在生长速度、光合能力和磷(P)亲和力等方面更具优势(Zhang et al.,2020)。在较高营养水平、浊度和存在甲壳类的无鱼生态系统中,丝状蓝藻的生物量更为丰富(Romo et al.,2004)。富营养化浅水湖泊实验和实地观测数据也表明,一些适荫性的丝状蓝藻,可能参与主导了富营养化浅湖的浑浊演替(Nicklisch et al.,1989;Scheffer et al.,1997)。因此,在沉水植物控制微囊藻进程中,有必要加强对丝状蓝藻的种类与生物量监控。
4 结论
1)苦草、轮叶黑藻、伊乐藻等3 种水鳖科沉水植物在 2 g·L-1密度下有效抑制起始密度为(3.5±0.1)×106cells·mL-1的2 株微囊藻生长,伊乐藻抑制效果最强。相反,伊乐藻受微囊藻影响最小,而苦草受影响最大。
2)与单培对照组相比,3 种沉水植物有效抑制微囊藻后,共培组周丛藻类密度更高,多样性更低,这可能对消除微囊藻死亡分解释放的氨氮和可溶性磷等营养物质具有积极作用,但在共培组中也发现泽丝藻、细鞘丝藻等丝状蓝藻生物量增加,应加强监测与防控。
