纳米氧化镍暴露下人工湿地运行性能及微生物群落的响应
2024-01-22李璇钱秀雯黄娟王鸣宇肖君
李璇,钱秀雯,黄娟*,王鸣宇,肖君
1. 江苏省环境工程技术有限公司,江苏 南京 210019;2. 东南大学土木工程学院,江苏 南京 210096
颗粒尺寸为1—100 nm 的材料通常被定义为纳米颗粒(Nanoparticle,NPs)(Klaine et al.,2008),其中纳米氧化镍(NiO NPs)是一种具有特殊的光学和电化学性质的“过渡性纳米粒子”,在食品包装、医疗药品、电子技术、环境修复及污水处理等领域具有广阔的应用前景(Qu et al.,2013;Gebre et al.,2019;Pirzada et al.,2019;Khalaf et al.,2023)。进入环境的NiO NPs 易被生物摄取,引发毒性胁迫从而影响动植物和微生物生长代谢。例如,NiO NPs可通过氧化应激诱导水生动物细胞毒性(Aziz,2021),还可能令番茄幼苗产生应激反应并诱发植物细胞死亡(Faisal et al.,2013)。对微生物而言,NiO NPs 可引起细胞不规则收缩和变形,对细菌产生显著抑制(Saleem et al.,2017)。50 mg·L-1NiO NPs 暴露导致微生物氨单加氧酶(AMO)和羟胺氧化还原酶(HAO)活性明显降低,活性氧(ROS)水平升高(Liu et al.,2023)。相较于其他纳米颗粒,NiO NPs 可能具有更大的毒性威胁。Nogueira et al.(2015)评估了NiO NPs 等3 种金属纳米氧化物的潜在生态毒性,发现NiO NPs 的生物毒性显著高于TiO2NPs 和Fe2O3NPs。
环境介质中的NiO NPs可通过径流和管网收集等途径进入各污水处理系统(Wang et al.,2017)。人工湿地(Constructed wetlands,CWs)作为一种成熟的生态处理系统,不可避免接纳待处理污水中的NiO NPs,其内部生态因子对NiO NPs 的响应可能导致湿地运行性能的变化。例如0.1—1 mg·L-1NiO NPs 长期暴露(120 d)抑制了CW 系统的脱氢酶等关键酶活性,降低了细菌多样性,改变了微生物组成,并明显抑制了氨氧化和反硝化功能基因的转录,从而导致TN、TP 去除率分别降低15.3%—17.6%和14.2%—27.8%(Xiao et al.,2021)。其他纳米氧化物在CWs 中的暴露表现出类似的胁迫效应。50—150 mg·L-1TiO2NPs 短期暴露即导致NH4+-N 和NO3--N 去除率降低23.9%—38.8%及26.5%—71.4%,且细菌损伤增加(Han et al.,2021)。15—90 nm ZnO NPs 显著抑制人工湿地反硝化微生物索氏菌属(Thauera),令NH4+-N 和TN 去除率降低15.3%—22.0%及3.8%—11.0%(王文悦等,2021)。此外,0.5—5 mg·L-1CuO NPs 暴露改变了罗河杆菌属(Rhodanobacter)、索氏菌属、硝化螺旋菌(Nitrospira)等氮降解微生物,降低了不动杆菌属(Acinetobacter)等聚磷菌丰度,从而抑制了CWs 脱氮除磷性能(Yan et al.,2023)。然而,现阶段鲜有研究讨论NiO NPs短期或长期暴露对湿地生态因子及运行性能的影响。另一方面,在时间尺度上继续提升NiO NPs的处理浓度以探寻湿地系统的耐受性与稳定程度未见报道。
基于此,本研究旨在探索稳定运行的人工湿地在NiO NPs 暴露下运行性能的变化及微生物的响应,揭示NiO NPs 暴露浓度对人工湿地生态功能的影响。本研究的结果可为探讨人工湿地生态技术应对NiO NPs长期胁迫的可持续性及可恢复性提供理论依据和技术支持。
1 材料与方法
1.1 纳米氧化镍分散液制备
本研究采用的NiO NPs(CAS 号:1313-99-1)购自中国上海阿拉丁试剂有限公司,平均粒径<30 nm,纯度>99.5%,密度=6.67 g·cm-3。制备50 mg·L-1NiO NPs 原液分散液的步骤如下:在1 L 合成废水中加入50 mg NiO NPs 粉末;25 ℃、250 W、40 kHz下超声处理0.5 h。分散液制备完成后采用Zeta 电位仪(Malvern,Zetasizer Nano ZS MPT-2)进行电位分布分析,悬浮液的Zeta 电位为 (-22.3±6.29)mV,具有良好的色散性。
1.2 试验装置与运行
本试验采用垂直潜流式人工湿地,搭建于东南大学四牌楼校区。湿地装置为圆柱形,高60 cm(上层35 cm,下层25 cm),直径15 cm,基质层总高55 cm,从上至下依次为:15 cm 厚粗砾石(粒径10—20 mm)、20 cm 厚细砾石(粒径5—8 mm)、20 cm 厚石英砂(粒径1—2 mm),湿地孔隙率为40.0%。湿地采用连续流进水,上端设置进水口,连接蠕动泵进水,底部设出水口。装置上层种植3—4 株长势相近的湿地植物黄菖蒲。
湿地运行初期,通过接种污泥给湿地基质挂膜。挂膜期间湿地间歇运行,HRT 为3 d,持续45 d。挂膜完成后装置采用蠕动泵连续进水,HRT 仍为3 d,进水流量为1.41 L·d-1,试验时间为2019年6 月至2020 年1 月,分为3 阶段:NiO NPs 加药前(前102—0 d)、10 mg·L-1NiO NPs 处理期(0—60 d)、30 mg·L-1NiO NPs 处理期(60—120 d)。
1.3 合成污水配制及水质检测
本试验参照Xiao et al.(2021)的研究配制人工合成废水为进水,分别以CH3COONa·3H2O、CO(NH2)2、(NH4)2SO4、KNO3,KH2PO4为COD、有机氮、NH4+-N、NO3--N、TP,对应理论进水质量浓度分别为200、4、15、6、3 mg·L-1。此外,进水还包括镁、铁等微量元素。本试验制备进水的药品纯度均为AR。加药前装置稳定运行102 d,投加10 和30 mg·L-1NiO NPs 后分别运行60 d,每3 天检测COD、NH4+-N、NO3--N、TN 和TP 进出水含量。本试验的水质检测方法参考国标方法(国家环境保护总局,2002)。
1.4 基质酶活性检测
本试验通过检测5 种基质酶活性以评估NiO NPs 暴露的生物毒性水平。脱氢酶(Dehydrogenase,DHA)、脲酶(Urease,URE)、磷酸酶(Phosphatase,PST)、氨单加氧酶(Ammonia Mono Oxygenase,AMO)、硝酸盐还原酶(Nitrate Reductase,NAR)。5 种基质酶的检测方法主要参考《土壤酶及其研究法》(关松荫,1986)和之前的研究(Hu et al.,2018;Wang et al.,2016a)。其中DHA、URE、PST 分别采用氯化三苯基四氮唑(TTC)比色法、苯酚钠-次氯酸钠比色法和磷酸苯二钠法测定,AMO 和NAR 分别采用重氮偶合分光光度法及NO3--N 消耗分光光度法测定。
1.5 微生物群落结构检测
在加药前、10 mg·L-1和30 mg·L-1NiO NPs 处理3 阶段末期,分别从装置3 个深度(5、10、15 cm)的不同位置采集至少3 个基质样本,充分混合以确保样本能更准确地代表湿地内部的一般情况。使用OMEGA Soil DNA Kit(M5635-02)(OMEGA Bio-Tek,Norcross,GA,USA)提取DNA 后,进行高通量测序以调查和分析细菌群落的变化,其中上游引物为338F(5′-ACTCCTACGGGAGGCAGC A-3′),下游引物为806R(5′-GGACTACHVGGGWT CTAAT-3′)。选择细菌16S rRNA 的V3—V4 区作为分类特异性片段,在上海派森诺公司的Illumina MiSeq PE300 平台上进行测序。
1.6 数据处理
通过SPSS 26(IBM,USA)软件对水质指标和酶活性进行ANOVA 和LSD 分析,如果P<0.05,则认为差异显著。通过 OriginPro 2021、Adobe Illustrator 2022 等软件绘制图形。
2 结果与讨论
2.1 纳米氧化镍暴露下出水水质动态变化
加药前和不同浓度NiO NPs暴露下人工湿地对有机物的去除情况存在差异。由图1a,加药前装置COD 平均去除率为67.2%,出水浓度呈波动下降趋势,表明有机物降解性能随着运行逐渐稳定而提高。据报道,NiO NPs 在水处理中具有促进COD去除的潜力,可能因为NiO NPs 是一种高导电性材料,可作为关键电子介质,推动碳代谢进程(Mishra et al.,2018)。本研究10 mg·L-1NiO NPs 暴露下(0—30 d 和30—60 d)出水COD 浓度持续下降,去除率分别提高16.5%(P=0.001)和20.8%(P=0.000),说明10 mg·L-1NiO NPs 暴露对有机物去除有一定刺激作用。而30 mg·L-1NiO NPs(60—120 d)暴露下出水COD 浓度存在较大波动,且COD 去除稳定性降低,但整体去除水平仍较加药前高5.24%—12.3%。
NiO NPs 暴露整体对湿地脱氮性能产生协同促进作用。从硝化过程分析(图1b),加药前出水NH4+-N 浓度逐渐下降,去除率随之上升,但因为前期装置不稳定,水质波动较大,加药前NH4+-N平均去除率为30.1%。投加10 mg·L-1NiO NPs 后(0—60 d)出水NH4+-N 浓度趋于稳定,去除率较加药前提高63.9%—66.4%(P=0.000),表明NiO NPs暴露60 d 可稳定刺激NH4+-N 转化,一定程度上强化硝化功能。Huang et al.(2020)认为低水平NiO NPs 可强化NH4+-N 去除,因为低剂量NiO NPs 可通过诱导相关酶合成和促进物质转移提高细菌活性,从而提高微生物脱氨效率(Zhang et al.,2017)。当NiO NPs 质量浓度提升至30 mg·L-1,出水NH4+-N 含量产生较大波动,30 mg·L-1NiO NPs 暴露前期(60—90 d)去除率较加药前提升53.0%(P=0.000),表明高浓度NiO NPs 胁迫对硝化的促进潜力降低,后期(90—120 d)去除率逐渐上升至92.9%(较加药前高62.8%,P=0.000),说明系统逐渐适应了高浓度NiO NPs 胁迫,恢复对NH4+-N 转化的促进,并重新趋于稳定。
从反硝化过程看(图1c),加药前至10 mg·L-1NiO NPs 暴露期间(前102—60 d)出水NO3--N 含量较稳定,平均去除率均高于90%。投加10 mg·L-1NiO NPs后NO3--N去除率较加药前略微降低1.65%—5.46%,说明10 mg·L-1水平的NiO NPs 对反硝化无明显影响。而当质量浓度提升至30 mg·L-1,出水NO3--N 产生较大波动,NO3--N 去除率陡然降低至32.6%—52.3%,两阶段分别较加药前低 44.7%(P=0.000)和64.4%(P=0.000),表明30 mg·L-1NiO NPs 显著抑制了湿地反硝化功能,影响系统稳定。研究显示NiO NPs的致毒机制主要为自身的纳米效应(Wang et al.,2016b),纳米毒性可能致关键酶活性降低,参与氮磷循环的功能微生物受抑制(Li et al.,2022)。其他研究也证明了NiO NPs 抑制反硝化速率,导致NO3--N 积累,这可能与NiO NPs 暴露下主要反硝化菌属相对丰度降低有关(Xiao et al.,2021)。
由图1d,由于出水NH4+-N 含量在总氮素中占主导,故TN 动态变化与NH4+-N 类似,出水浓度基本呈现加药前波动降低,10 mg·L-1NiO NPs 暴露后持续低水平,NiO NPs 剂量增大后先升高后降低的规律。投加10 mg·L-1NiO NPs 后(0—60 d)TN去除率较加药前提高22.3%—34.7%(P=0.000),且在暴露前期(0—30 d)TN 去除水平最高,为93.06%。表明NiO NPs 暴露60 d 可能促进TN 去除,但随时间推移存在波动。30 mg·L-1NiO NPs 暴露前期(60—90 d)TN 去除率降低,略高于加药前(高7.72%),这是NH4+-N 和NO3--N 去除率同时降低的结果。后期(90—120 d)TN 去除率逐渐上升至74.7%(较加药前高16.3%,P=0.002),但仍低于10 mg·L-1NiO NPs 处理的情况,说明尽管系统可逐渐适应高浓度NiO NPs 胁迫,恢复对TN 去除的促进,但高浓度水平NiO NPs 暴露下TN 去除率劣于较低浓度水平。
NiO NPs 暴露整体对湿地除磷性能产生促进作用,但不同投加剂量下促进程度与有机物降解和脱氮效果相反(图1e)。加药前湿地出水TP 含量波动下降,投加10 mg·L-1NiO NPs 后TP 出水浓度继续下降但仍存在较大波动;而30 mg·L-1NiO NPs 暴露后逐渐趋于稳定。从平均水平看,10 mg·L-1NiO NPs 处理时TP 去除率较加药前提高56.0%—61.1%(P=0.000),当质量浓度为30 mg·L-1时,60—90 d和90—120 d 的TP 平均去除率分别为91.2%和84.8%,较加药前高62.5%—68.9%(P=0.000),表明NiO NPs 也具有一定的除磷强化潜力,且在高浓度水平时更明显。
2.2 纳米氧化镍暴露下基质酶活性的变化
基质脱氢酶(DHA)作为传递氢的载体,有助于催化有机物氧化还原反应,促进有机物的生物降解(Chaperon et al.,2008;Jackson et al.,2013)。如图2a,相较于加药前,NiO NPs 暴露后DHA 活性先下降后上升,最后恢复至加药前水平,表明NiO NPs 短期暴露对DHA 活性产生抑制,但随时间推移DHA 活性逐渐恢复;10 mg·L-1和30 mg·L-1NiO NPs 暴露下DHA 相对活性较加药前分别低36.7%—51.5%、2.58%—23.2%,说明NiO NPs 对DHA 产生胁迫。
脲酶(URE)是一种C-N 键水解酶,能有效促进酰胺(如尿素)水解为氨及CO2,其活性可以反映土壤无机氮的供应能力,也可以用于表征土壤氮素状况(Fingler et al.,2004;王娟等,2008;Jośko et al.,2014)。如图2b 所示,10 mg·L-1NiO NPs 暴露下的两个阶段,URE 相对活性较加药前分别提高225%(P=0.002)和389%(P=0.000),且随时间增大。30 mg·L-1NiO NPs 暴露下URE 相对活性较加药前进一步提高456%—460%(P=0.000)。类似的,Ni NPs 对土壤URE 活性也产生刺激作用(Jośko et al.,2014)。
基质磷酸酶(PST)能促进有机磷化物的水解,其活性大小可以间接反映微生物对磷吸收能力的强弱(陈永华等,2010)。如图2c,投加NiO NPs后PST 活性先降低后提升,甚至高于加药前。10 mg·L-1NiO NPs 暴露前期(0—30 d)PST 相对活性较加药前降低44.7%,后期(30—60 d)比加药前高36.6%。随着暴露剂量提升至30 mg·L-1,在60—90 d 内PST 活性略有降低,但仍比未暴露高11.1%,而在30 mg·L-1NiO NPs 暴露后期(90—120 d)PST 相对活性较加药前高93.1%(P=0.033),表明NiO NPs 可协同促进PST 活性,且随时间推移效果更为明显。
从脱氮角度看,氨单加氧酶(AMO)和硝酸还原酶(NAR)分别对应硝化和反硝化的第一步。AMO 具有催化NH4+氧化为NO2-的能力(刘志培等,2004)。如图2d,投加NiO NPs 抑制了AMO活性,在时序上整体呈先下降后恢复的趋势。10 mg·L-1NiO NPs 暴露两时段AMO 相对活性较加药前分别降低46.7%和59.6%(P=0.019),而30 mg·L-1暴露下相对活性进一步降低至23.6%,较加药前低76.4%(P=0.015),表明NiO NPs 对AMO 的抑制可能随浓度的提升而增大,这与高浓度下NH4+-N去除率降低相符。30 mg·L-1NiO NPs 暴露后期(90—120 d)AMO 活性略有提升,对应的NH4+-N 去除也有所提升。
NAR 是硝酸盐代谢关键酶,促进NO3--N 还原为NO3--N,影响CWs 脱氮能力(王利群等,2003)。不同剂量的NiO NPs 对NAR 的影响存在差异。如图2e,10 mg·L-1NiO NPs 暴露下NAR 相对活性较加药前高73.0%—584%,而30 mg·L-1NiO NPs 处理时NAR 整体受抑制,在60—90 d 较加药前低33.7%,表明高浓度NiO NPs 抑制NAR 活性,削弱NO3--N 还原能力,从而导致NO3--N 去除率降低。
2.3 纳米氧化镍暴露下微生物群落结构的响应
微生物群落结构的变化可直接反映微生物对NiO NPs 暴露的响应。从门水平看(图3a),湿地运行期间丰度较高的微生物门包括变形菌门(Proteobacteria,48.1%—55.5%)、绿弯菌门(Chloroflexi , 18.2% — 20.4%)、放线菌门(Actinobacteria,5.65%—13.4%)、拟杆菌门(Bacteroidetes,5.62%—7.91%)等。变形菌门是自养反硝化菌的主要门(Han et al.,2020),10 mg·L-1NiO NPs 对变形菌门略有促进,而30 mg·L-1NiO NPs 令其相对丰度较加药前降低7.98%。绿弯菌门是污水处理系统中常见的丝状菌门(Jia et al.,2020),相对丰度在10 和30 mg·L-1NiO NPs 暴露下分别较加药前降低 6.09%和 10.4%。10—30 mg·L-1NiO NPs 还降低了酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)、硝化螺旋菌门(Nitrospirae)等微生物门的丰度,且抑制程度随NiO NPs 浓度升高而增大,表明高浓度NiO NPs 更具毒性威胁,可能对微生物群落结构带来不利影响。另一方面,NiO NPs 可刺激部分微生物活性,如在湿地系统中广泛分布的放线菌门和拟杆菌门(Chen et al.,2017;Xu et al.,2020),NiO NPs 暴露下放线菌门和拟杆菌门活性较加药前分别提升69.4%—137%和23.6%—40.9%,且随着NiO NPs 质量浓度从10 mg·L-1提升至30 mg·L-1,两者相对丰度进一步提升39.8%和14.0%,表明放线菌门和拟杆菌门可能是NiO NPs 耐受微生物,可在高浓度NiO NPs 暴露下富集。
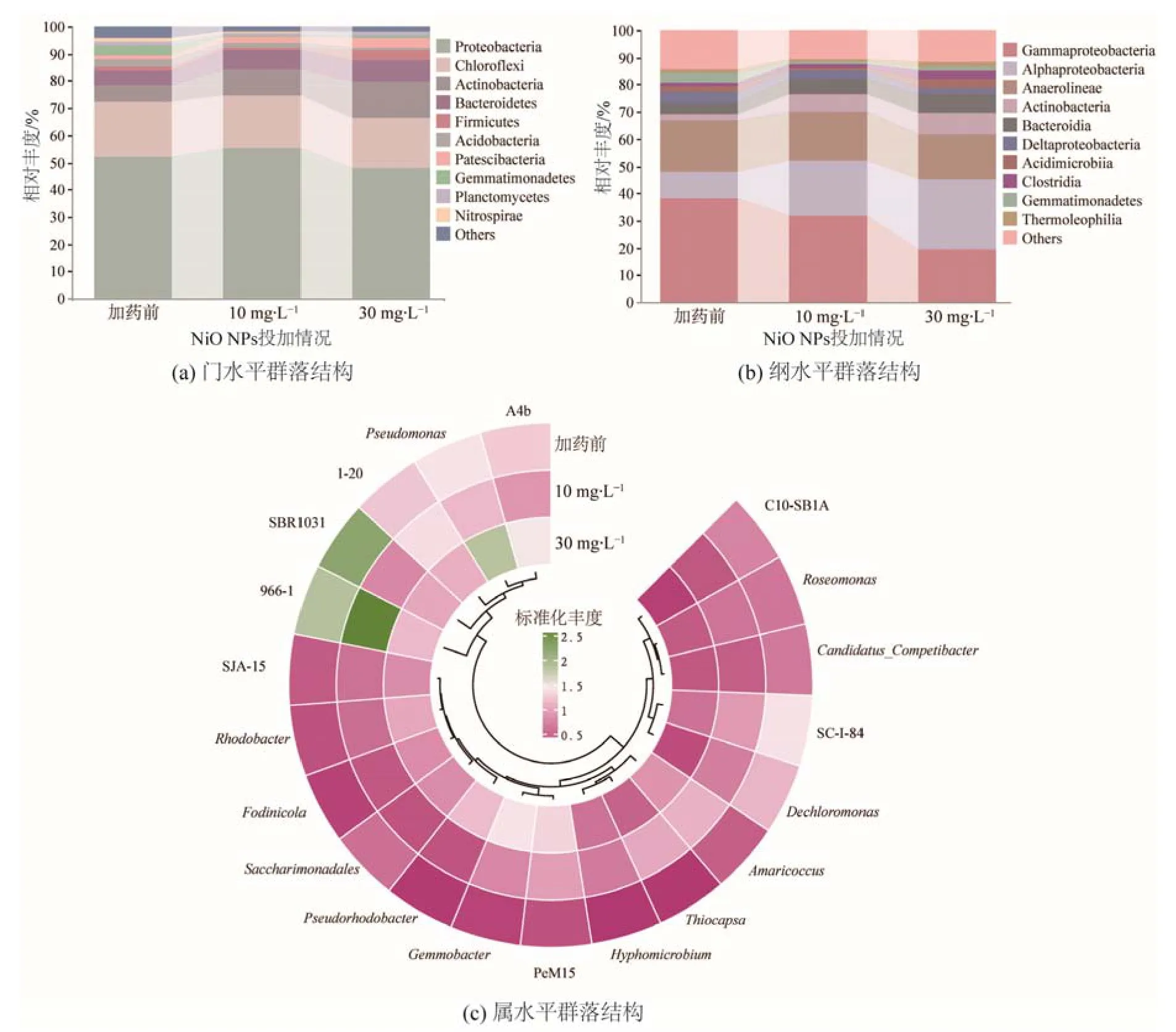
图3 NiO NPs 暴露前后的微生物群落结构Figure 3 Microbial community structure with/without NiO NPs exposure
从纲水平看(图3b), γ- 变形菌纲(Gammaproteobacteria)、 α- 变形菌纲(Alphaproteobacteria)、厌氧绳菌纲(Anaerolineae)是丰度较高的微生物纲,总占比为61.6%—69.9%。10 和30 mg·L-1NiO NPs 暴露下,α-变形菌纲相对丰度较加药前提高107%和168%,说明其对NiO NPs 的耐受性。而NiO NPs 对γ-变形菌纲和厌氧绳菌纲产生抑制,且两者在30 mg·L-1NiO NPs 暴露下的相对丰度较10 mg·L-1时进一步降低40.0%和8.2%,表明在10—30 mg·L-1范围内,随NiO NPs剂量增大,对γ-变形菌纲和厌氧绳菌纲的抑制作用增强。 另外, NiO NPs 处理令放线菌纲(Actinobacteria)和拟杆菌纲(Bacteroidia)丰度增大164%—212%和25.1%—60.6%,从而导致门水平上放线菌门和拟杆菌门相对丰度的提高。
从属水平看(图3c),10 和30 mg·L-1NiO NPs暴露对部分微生物属产生抑制,包括SBR1031、SC-I-84、脱氯单胞菌(Dechloromonas)、Candidatus_Competibacter等,较加药前分别降低60.6%—62.3%、28.4%—63.4%、32.6%—76.5%、29.5%—49.3%。另外,不同浓度NiO NPs 暴露对一些微生物属产生的影响相异。例如,在30 mg·L-1NiO NPs 胁迫时966-1、1-20、玫瑰单胞菌属(Roseomonas)、热单胞菌属(Thermomonas)等微生物属丰度降低。与之相反,假单胞菌属(Pseudomonas)、黄杆菌属(Flavobacterium)、食酸菌属(Acidovorax)等在10 mg·L-1NiO NPs 暴露下降低9.96%—70.3%,而在剂量提升至30 mg·L-1时相对丰度较加药前分别提升17.2%、323%、326%,表明这些微生物属逐渐适应NiO NPs 胁迫,属于耐受菌属。
进一步分析脱氮、除磷功能微生物以分析CW除污性能变化的主要机制。由图4a,对于脱氮微生物,氨氧化菌(AOB)亚硝化单胞菌(Nitrosomonas)受NiO NPs 促进,可能导致本试验中NH4+-N 去除率有所提升(图1b);而亚硝酸盐氧化菌(NOB)硝化螺旋菌属则较加药前丰度降低84.0%—91.7%,说明NiO NPs对微生物氧化NO2--N存在抑制作用。尽管10 mg·L-1NiO NPs 刺激了一些反硝化细菌(DNB),如红细菌属(Rhodobacter)、热单胞菌属等(Xu et al.,2019),但对多数常见反硝化细菌(DNB)产生不利影响,如假单胞菌属、脱氯单胞菌、噬氢菌属(Hydrogenophaga)、黄杆菌属、食酸菌属、动胶菌属(Zoogloea)等(Gao et al.,2020;Zhang et al.,2020),相对丰度较加药前降低5.69%—70.3%,表明NiO NPs 对DNB 存在威胁,进而抑制湿地系统反硝化进程。Xiao et al.(2021)也观察到NiO NPs 对假单胞菌属、脱氯单胞菌、噬氢菌属等DNB 的抑制。当NiO NPs 质量浓度提升至30 mg·L-1,热单胞菌属由促进转为抑制(丰度较10 mg·L-1时降低97.0%),而脱氯单胞菌、噬氢菌属、动胶菌属抑制程度加剧(丰度较加药前降低42.6%—93.3%),而其他DNB 则有所提升,可能是部分功能微生物逐渐适应NiO NPs 胁迫,从而导致相对丰度增加。对于除磷功能菌(图4b),在10 mg·L-1NiO NPs 暴露后关键聚磷微生物(PAOs),如芽殖杆菌属(Gemmobacter)和不动杆菌属较加药前分别提高273%和100%,当NiO NPs 质量浓度提升至30 mg·L-1时,两者相对丰度进一步增大,较加药前高453%和600%,表明本试验中投加10—30 mg·L-1NiO NPs 对除磷功能菌产生刺激作用,且随暴露浓度增大,该作用更显著。这可能是PST 在投加NiO NPs 后(30—120 d)活性增强的原因(图2c),也解释了NiO NPs 暴露下TP 去除率的显著提升,且在高浓度时增幅更大(图1a)。
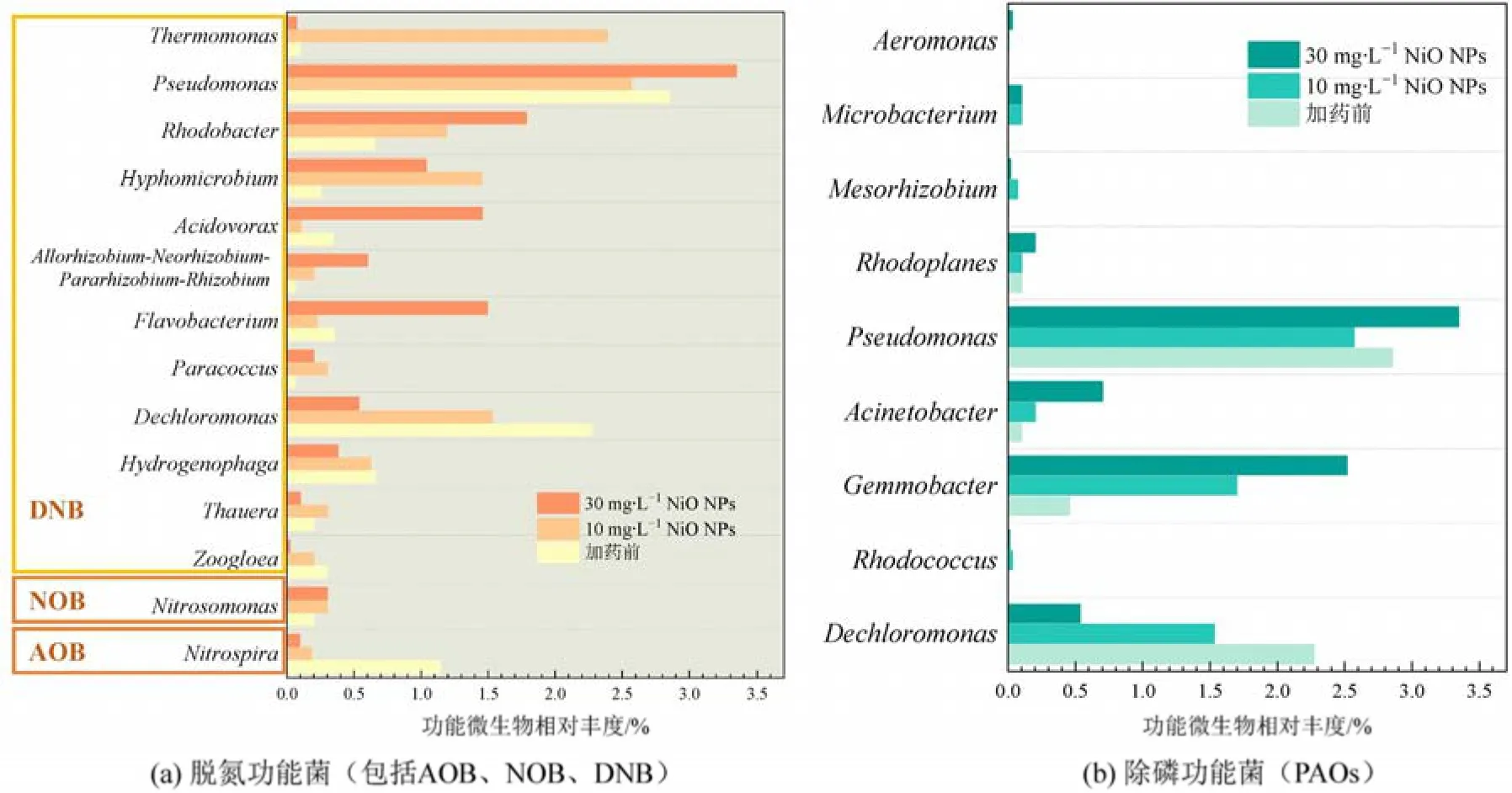
图4 NiO NPs 暴露前后装置功能菌属的相对丰度Figure 4 Relative abundance of functional genera in CW with/without NiO NPs
3 结论
1)NiO NPs 暴露对人工湿地COD、NH4+-N、TN、TP 的去除效果有一定程度提升。10 mg·L-1NiO NPs 轻微抑制NO3--N 去除,而在暴露60 d 后将质量浓度提升至30 mg·L-1,NO3--N 还原率显著降低,表明高浓度NiO NPs 抑制了反硝化过程。
2)对于基质酶,NiO NPs 整体抑制了DHA 和AMO 活性,而对URE 和PST 产生刺激作用;NAR活性在时间尺度上随NiO NPs 质量浓度从10 mg·L-1提升至30 mg·L-1时呈现先促进后抑制的趋势。
3)NiO NPs 暴露改变了湿地微生物群落组成,其中绿弯菌门受抑制,而放线菌门和拟杆菌门发生富集。对于功能微生物,NiO NPs 对AOB 产生刺激,但降低了NOB 丰度。脱氯单胞菌、噬氢菌属、动胶菌属等常见DNB 受NiO NPs 暴露抑制,可能是本试验中NO3--N 去除率降低的原因。而芽殖杆菌属、不动杆菌属等PAOs 丰度提升,进而促进了微生物除磷作用。
