血府逐瘀汤对肺动脉内皮细胞间质转化的影响及机制
2024-01-22曾作梅王昕玥田雷瑜崔力丹陈俞材
曾作梅,王昕玥,田雷瑜,崔力丹,郭 健,陈俞材
(北京中医药大学中医学院,北京 100050)
肺动脉高压(pulmonary hypertension, PH)是一种肺血管疾病,由远端肺小血管致病性重构诱发,导致肺动脉阻力和肺动脉压力持续性升高,最终出现右心衰竭甚至死亡[1]。PH最为关键的病理特征是肺血管重构,涉及到肺动脉内皮细胞功能障碍,平滑肌细胞异常增殖,以及成纤维细胞的过度激活和细胞外基质的沉积[2]。其中内皮细胞功能障碍在PH形成过程中扮演了重要角色,除了内皮血管活性介质释放导致的血管收缩和舒张的不平衡外,内皮细胞还通过向间充质细胞转化(endothelial-mesenchymal transition, EndMT)这一重要的生物学过程参与肺血管重构[3]。多项研究表明,在PH患者和动物模型的病变肺血管中发现了EndMT的存在[4-5]。目前临床治疗PH的方法主要针对肺血管收缩而非肺血管重构,虽然在短期内取得了一定的成效,但由于并没有解决肺血管重构这一关键问题,患者的长期预后依旧不良。通过抑制肺血管EndMT以减轻肺血管重构可能是PH治疗的可行性选择,寻找以EndMT为靶点的药物对治疗PH具有十分重大的意义。
依据PH患者呼吸困难、活动后气促、喘咳、胸痛等临床症状,中医将其归属于“肺胀”范畴。本病的病机主要表现为气血水三者合而为病,血瘀贯穿于疾病的始终,活血化瘀法是其治疗的重要手段[6]。血府逐瘀汤具有活血化瘀、行气止痛的功效,是治疗“胸中血府血瘀”诸症的名方。现代药理研究表明,本方可以保护血管内皮功能、改善微循环、抗炎、抗氧化应激、抑制血管重构[7]。多项临床研究证实,血府逐瘀汤已被用于治疗PH并且取得了较好的临床疗效,它可以显著降低患者平均肺动脉压力、中医证候评分,改善患者氧合指数和血液高凝状态[8-9]。目前对于血府逐瘀汤治疗PH尚无深入的机制研究,血府逐瘀汤对PH的治疗是否与干预EndMT有关尚不明确。
转化生长因子-β1(transforming growth factor-β1, TGF-β1)经多研究证实可诱导EndMT的发生,故本研究将TGF-β1作为刺激剂诱导大鼠肺微血管内皮细胞(pulmonary microvascular endothelial cells, PMVECs)发生间质转化构建EndMT细胞模型,观察血府逐瘀汤对肺动脉EndMT的影响,探究其具体作用机制,以期为血府逐瘀汤临床治疗PH提供相应的理论依据。
1 材料与方法
1.1 细胞系PMVECs购自北纳生物(BNCC)。
1.2 药物与试剂血府逐瘀汤由桃仁、红花、当归、生地黄、牛膝、赤芍、枳壳、甘草、川芎、桔梗、柴胡,按8 ∶6∶6∶6∶6∶4∶4∶4∶3∶3∶2比例组成,药材颗粒剂购自北京康仁堂药业有限公司。TGF-β1(HY-P7118)和SB 431542(HY-10431)购于美国MedChemExpress公司;DAPI(G1012)购于Servicebio公司;抗体CD31(11265-1-AP)、β-actin(66009-1)、二抗(SA00001-2、SA00001-1)均购于Proteintech公司;抗体α-SMA(19245)、Snail(3879)、p-Smad2(18338)、p-Smad1/5(9516)、RIPA(9806)均购于美国Cell Signaling Technology公司;蛋白酶抑制剂(CW2200S)、磷酸酶抑制剂(CW2383S)、BCA蛋白定量试剂盒(CW0014S)、SDS-PAGE凝胶制备试剂盒(CW0022S)、电泳液(CW0045S)、TBST(CW0043S)、TBS(CWOO42S)、化学发光检测试剂盒(CW0049S/M)均购于康为世纪;DMEM培养基(C12430500BT)、胎牛血清(10099-141C)、胰酶(25200-056)、青-链霉素双抗(15140-122)均购于美国Gibco公司;PBS(21-040-CVC)购自康宁公司;Hoechst 33342染色液(ab228551)和鬼笔环肽染色液(ab176753)均购于Abcam公司;CCK-8检测试剂盒(CK04)购于日本同仁化学研究所。
1.3 仪器二氧化碳培养箱(赛默飞世尔科技有限公司)、垂直层流洁净工作台(青岛海尔特种电器有限公司);iMark酶标仪(美国BIO-RAD公司);化学发光成像系统(上海勤翔科学仪器有限公司);B032荧光倒置生物显微镜(尼康)。
1.4 方法
1.4.1血府逐瘀汤药液制备 用DMSO作为溶剂,将血府逐瘀汤颗粒剂与DMSO充分混匀,涡旋震荡溶解,配置成3×103g·L-1的母液,过滤除菌后于-20℃保存。加药前用DMEM培养基将母液分别稀释成所需要的浓度。
1.4.2PMVECs的培养 复苏PMVECs,使用含有体积比1%青-链霉素双抗和10%的胎牛血清的高糖DMEM培养基,在含有5%CO2的37℃恒温细胞培养箱中培养。实验所用PMVEC为第3~6代。每间隔24~48 h更换一次培养基,待细胞融合度到达80%~90%时,按照实验需要,采用胰酶进行消化,加入DMEM培养基配置成一定比例的细胞混悬液,进行相应的传代、种板或种皿。
1.4.3 CCK8细胞活力检测将PMVECs用DMEM完全培养基稀释至3×107·L-1,加入到96孔板中,每孔接种100 μL PMVEC混悬液。待细胞生长贴壁融合至80%左右后,加入不同浓度的血府逐瘀汤(0、1 、3、10、30、100、300 mg·L-1、1 g·L-1, 3 g·L-1)。放置培养箱内培养48 h后,分别在每孔加入CCK-8溶液(10 μL/孔)后继续培养1~2 h,然后在酶标仪450 nm处测量各孔的吸光值。
1.4.4 细胞分组与给药设置空白组和模型组(5 μg·L-1TGF-β1)。根据“2.3”CCK-8细胞活力检测和文献研究结果将血府逐瘀汤给药浓度设定为3、10、30 mg·L-1。血府逐瘀汤低浓度组(DMEM培养基+3 mg·L-1XFZYD+5 μg·L-1TGF-β1),血府逐瘀汤中浓度组(DMEM培养基+10 mg·L-1XFZYD+5 μg·L-1TGF-β1),血府逐瘀汤高浓度组(DMEM培养基+30 mg·L-1XFZYD+5 μg/L TGF-β1)。SB 431542阳性药(DMEM培养基+5 μmol·L-1SB 431542+5 μg·L-1TGF-β1)。
1.4.5细胞免疫荧光实验 将PMVECs用DMEM完全培养基稀释至1×108·L-1,加入到96孔板中,每孔接种100 μL PMVECs细胞混悬液。待细胞贴壁融合至80%左右,按以上分组加入相应浓度的药液,并给予TGF-β1刺激剂造模,置于培养箱内培养。48 h后去除培养基,PBS洗2次,4%多聚甲醛室温固定20 min,PBS洗2次。使用0.1% TritonX-100破膜处理15 min,去除Triton,3%BSA在37℃环境下封闭30 min,将一抗按照(CD31, 1 ∶200; α-SMA, 1 ∶200)稀释,去除封闭液后,加入一抗4℃孵育过夜。弃一抗,PBS洗3次后,加入按1 ∶200配制的Alexa Fluor 488或Alexa Fluor 555偶联二抗。37℃环境下避光孵育2 h。弃二抗,PBS洗3次,最后加入按1 ∶1 000配制的Hoechst 33342染液染细胞核15 min,PBS洗涤5遍后于倒置荧光显微镜下观察拍照。
1.4.6鬼笔环肽染色实验 细胞分组与种板同细胞免疫荧光实验,每孔加入0.2% TritonX-100于室温环境下破膜15 min。吸弃Triton,每孔加入100 μL的Phalloidin 1×染液,37℃避光孵育1 h。加入按1 ∶1000配制的Hoechst 33342染液染细胞核15 min,然后使用PBS洗涤5遍,最后于倒置荧光显微镜下观察每组细胞骨架改变情况。
1.4.7形态学观察 取PMVECs细胞混悬液,以1×108个/L细胞密度,每孔100 μL接种于96孔板中。待细胞贴壁生长融合至80%左右时,按1.4.4项下方法分组给药,并给予TGF-β1刺激剂,于培养箱内培养。48 h后将培养板取出,于光镜下观察PMVECs形态改变。
1.4.8Western blot 弃掉培养皿中的培养基,用生理盐水清洗2次,加入配置好的蛋白裂解液80 μL,细胞刮板刮下细胞收集到离心管中,冰上裂解30 min后,在4℃,1000 r·min-1离心10 min。取上清液,使用BCA检测试剂盒进行蛋白定量,后加入5×蛋白上样缓冲液涡旋混匀。将混匀后的样品于100℃沸水中加热10 min使蛋白充分变性,然后进行分装储存于-80℃冰箱。每孔上样10 μL进行10%SDS-PAGE凝胶电泳,将蛋白以200 mA电转到PVDE膜上,采用5%BSA在37℃环境下封闭1 h。给予相应一抗于4℃冰箱孵育过夜,TBST洗膜5次后,给予相应二抗在37℃恒温摇床中孵育1 h 30 min,TBST洗膜5次后,配置显影液显影,采用ImageJ图像分析系统对各组细胞蛋白的相对密度进行检测分析。
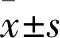
2 结果
2.1 血府逐瘀汤对PMVECs生长活力的影响采用CCK-8法检测了不同浓度的血府逐瘀汤对PMVECs细胞活力的影响。与血府逐瘀汤0浓度组相比,随着血府逐瘀汤浓度的上升,PMVECs细胞活力逐渐降低。血府逐瘀汤1~30 mg·L-1浓度对细胞活力无较大影响,在100 mg·L-1浓度时细胞活力有了明显的降低,差异具有统计学意义,故选择了将3、10、30 mg·L-1作为血府逐瘀汤药效学检测的最终低、中、高给药浓度。
2.2 血府逐瘀汤对TGF-β1诱导的PMVECs内皮间质转化的抑制作用为了探讨血府逐瘀汤是否能抑制EndMT过程,采用TGF-β1构建了内皮细胞EndMT模型,并通过免疫荧光和Western blot方法对PMVEC内皮细胞标志物CD31和间充质细胞标志物α-SMA进行了相关检测。SB 431542是TGF-β1的受体激酶抑制剂,被用作阳性药。在免疫荧光的实验结果中显示,给予TGF-β1刺激剂后,模型组相较于空白组CD31的红色荧光表达明显降低,血府逐瘀汤给药后,红色荧光表达较模型组显著升高;α-SMA的绿色荧光表达在模型组中明显升高,血府逐瘀汤高浓度组α-SMA的绿色荧光表达降低较为明显。蛋白免疫印迹法检测实验结果表明,模型组与空白组相比,CD31表达下调,α-SMA表达上调,在血府逐瘀汤给药后,CD31蛋白表达明显升高,α-SMA蛋白表达虽然没有统计学差异,但是存在较为明显的下降趋势。这说明血府逐瘀汤可以通过上调内皮细胞标志蛋白CD31,下调间充质细胞标志蛋白α-SMA的表达,对TGF-β1诱导的肺动脉内皮细胞间质转化具有抑制作用。
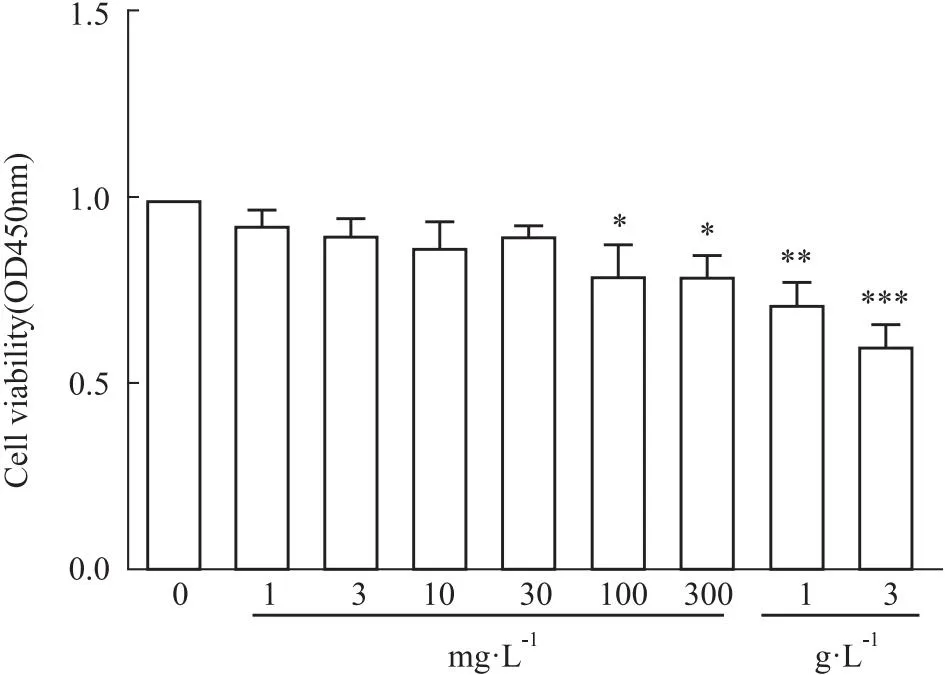
Fig 1 Effect of Xuefu Zhuyu decoction on viability of PMVECs (n=6)
2.3 血府逐瘀汤对TGF-β1诱导PMVEC细胞形态学的影响EndMT伴随着细胞骨架的改变,鬼笔环肽染色是研究细胞内肌动蛋白微丝分布的有力工具。染色结果表明,TGF-β1刺激剂组相较于空白组出现了明显的细长微丝分布,血府逐瘀汤用药组则有所改善。正常组细胞呈铺路鹅卵石样,规则排列,细胞间的连接紧密。而TGF-β1刺激后细胞形态转变为细长梭形,可见类似于平滑肌样的细胞并有丝状伪足伸出,细胞间的连接明显松散。血府逐瘀汤能够显著抑制这一转变趋势,用药后细胞形态可不同程度的接近正常组。
2.4 血府逐瘀汤对TGF-β1诱导的PMVECs细胞TGF-β1/Smad信号通路的影响TGF-β1/Smad信号通路是诱导EndMT的常见信号传导通路,Snail是Smad下游参与EndMT形成的重要转录因子。为了探究血府逐瘀汤抑制EndMT的具体机制,采用Western blot检测了TGF-β1诱导的PMVEC中p-Smad2、p-Smad1/5和Snail蛋白的表达。实验结果显示,与空白组相比,TGF-β1提升了模型组中PMVEC细胞Smad2的磷酸化水平,降低了Smad1/5的磷酸化水平。与模型组比较,血府逐瘀汤能够降低p-Smad2,提高p-Smad1/5的蛋白表达,高浓度组的干预效果尤为显著。模型组中Snail蛋白的表达明显高于空白组,而血府逐瘀汤和SB 431542用药组Snail的蛋白表达则显著弱于模型组。综上所述,血府逐瘀汤能够调控TGF-β1/Smad信号通路,还能显著降低EndMT重要转录因子Snail蛋白的表达。血府逐瘀汤对EndMT的改善作用,可能与它对TGF-β1/Smad信号通路的调控密切相关。
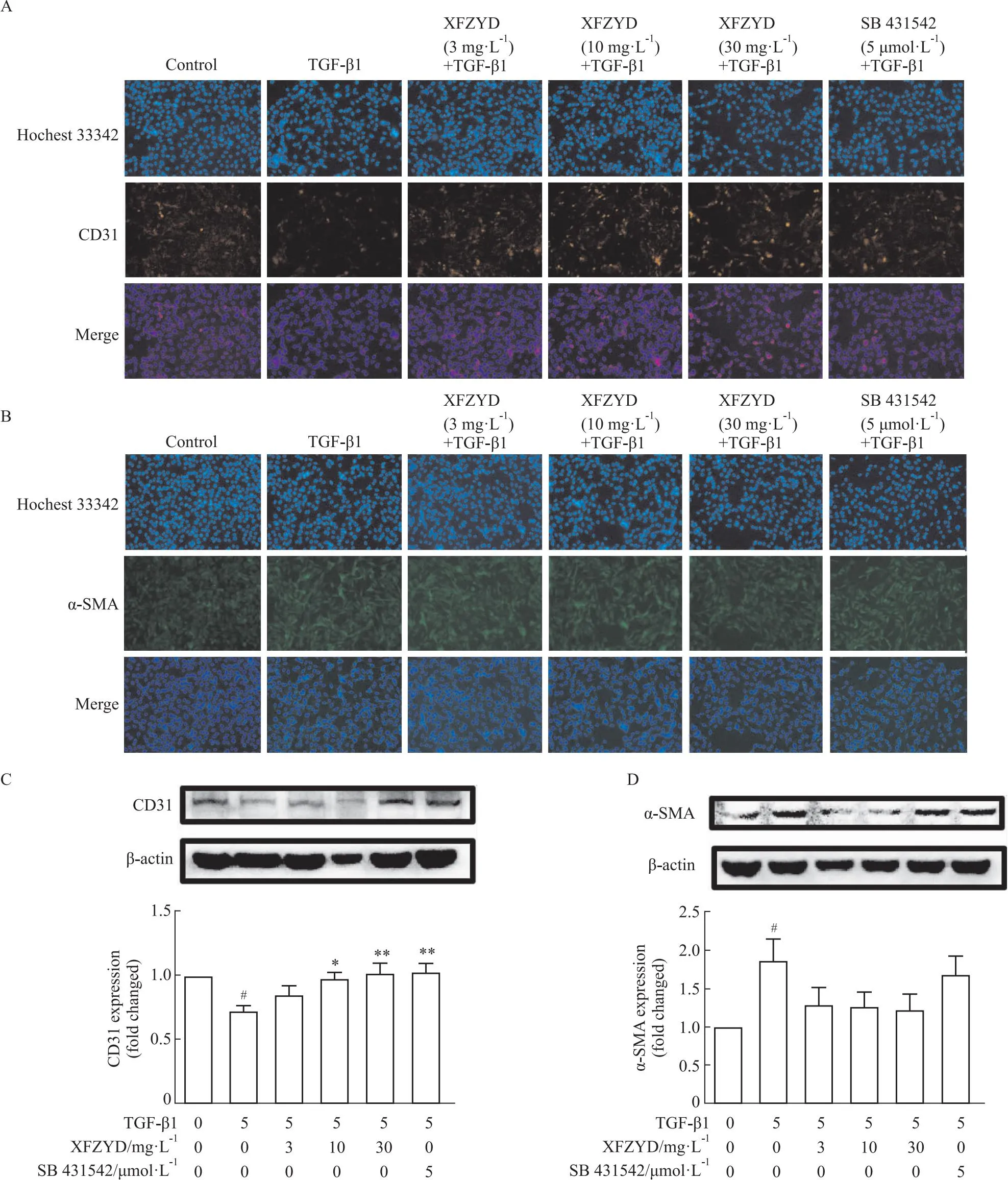
Fig 2 Xuefu Zhuyu decoction inhibited EndMT of TGF-β1 induced PMVECs (n=3~4)
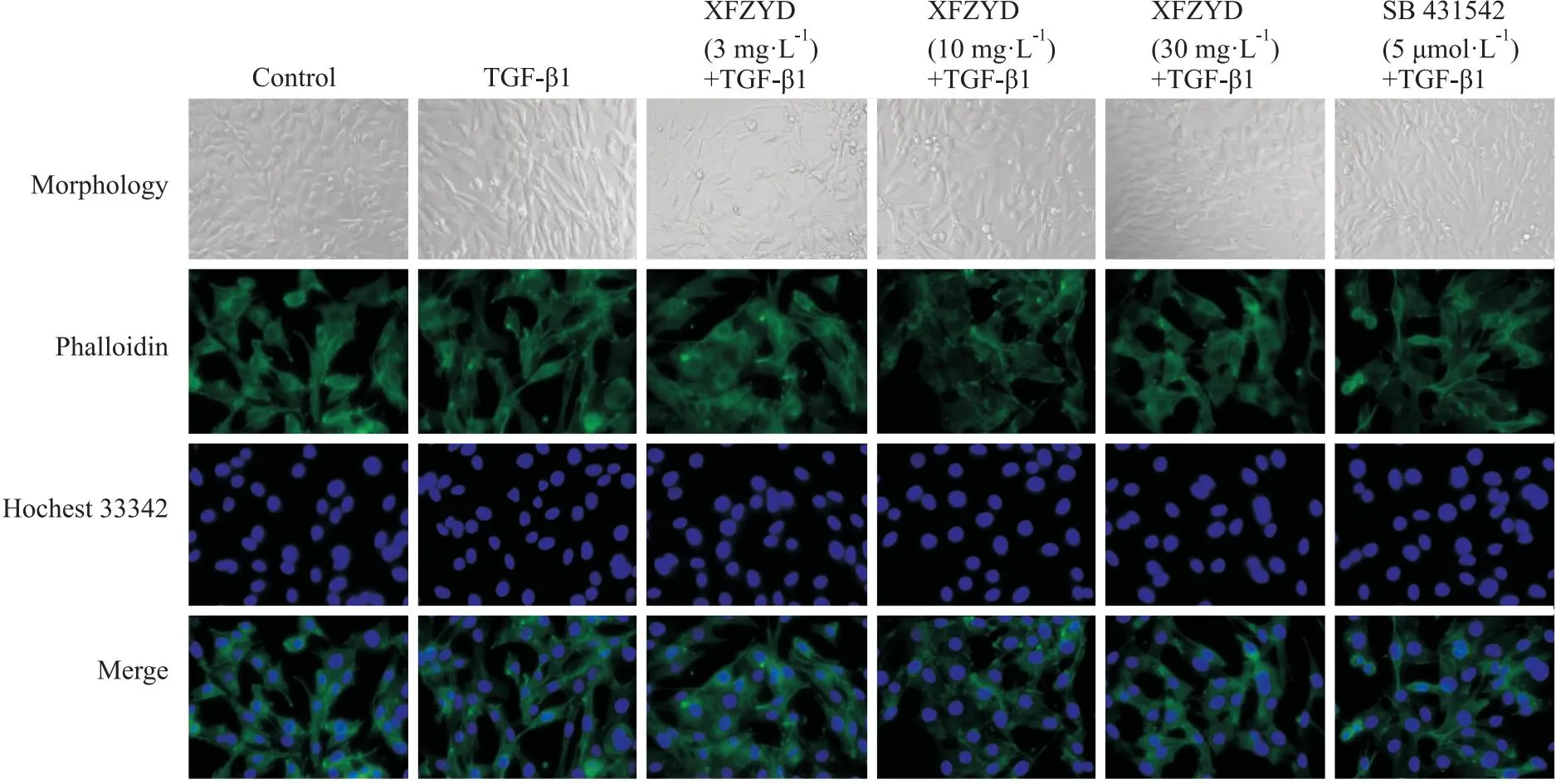
Fig 3 Xuefu Zhuyu decoction inhibited cell morphological changes of TGF-β1-induced endothelial mesenchymal transformation of PMVECs
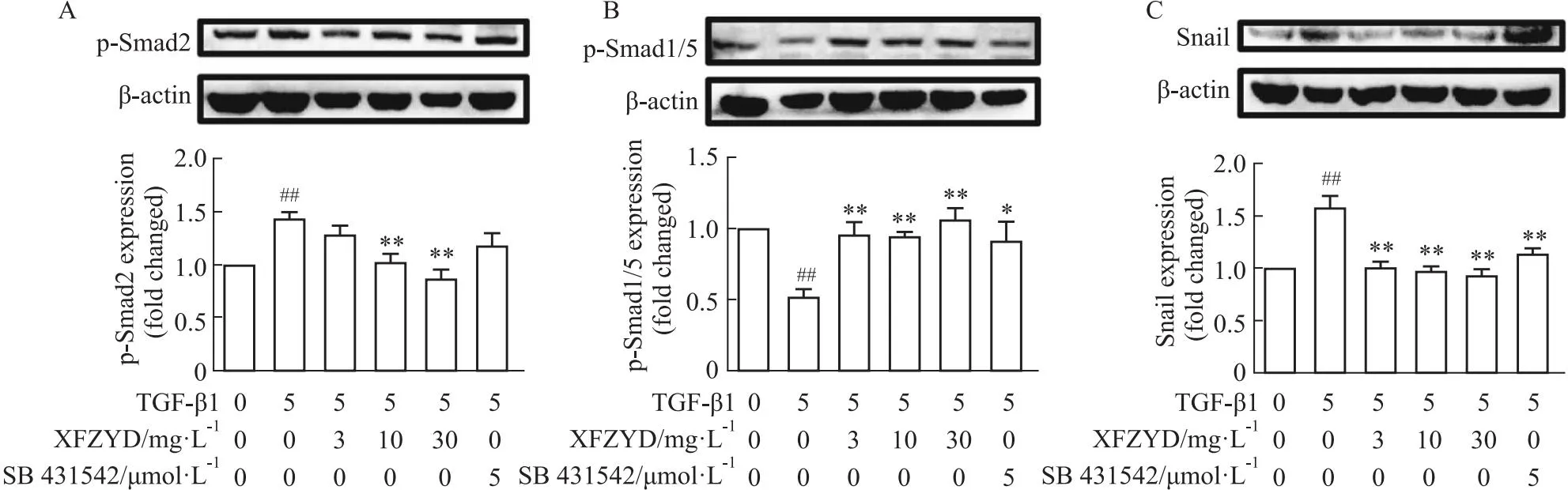
Fig 4 Effect of Xuefu Zhuyu decoction on expression of TGF-β1 signaling pathway related proteins in TGF-β1-induced PMVECs (n=3~4)
3 讨论
PH被称为心血管系统的“癌症”,在发病过程中伴随着肺血管细胞不可逆的损伤。常见缺氧、炎症、机械力等刺激可引起肺血管内皮细胞损伤,导致内皮细胞功能障碍,血管收缩[10]。除此之外,内皮细胞还通过向间充质细胞转化,参与肺血管重构[11]。EndMT是内皮细胞在多种因素的作用下失去其特征表型而向间充质细胞表型转变的生物学过程。在这一过程中,内皮细胞间的紧密连接丧失,内皮细胞标志蛋白减少,如CD31、血管内皮粘连蛋白,转而获得间充质细胞标志蛋白和纤维细胞特异性蛋白,如α-SMA、波形蛋白和纤连蛋白[4]。除此之外,其结构也从铺路鹅卵石样转变为了细长的梭形。EndMT可以被多种信号通路调控,其中TGF-β1和TGF-β1/Smad信号通路是诱导EndMT最重要的分子和信号通路之一[12]。因此,本研究采用了TGF-β1诱导PMVEC向间充质细胞转变来建立EndMT细胞模型。实验结果显示,经TGF-β1诱导48 h后,PMVEC细胞骨架改变,其结构从原来的鹅卵石样转变为梭形。免疫荧光法和Western blot实验结果提示经TGF-β1刺激后PMVECs的CD31表达下调,α-SMA表达上调。以上结果说明EndMT细胞模型建立成功。在血府逐瘀汤药物干预后,上述结果均发生改变,血府逐瘀汤低、中、高浓度组细胞形态不同程度接近于正常组,呈鹅卵石铺路样排列,其中以高浓度组转变最为明显。除此之外,CD31的蛋白表达和荧光强度明显提高,α-SMA的荧光强度则相应减弱。由此可见,血府逐瘀汤可改善TGF-β1诱导的肺动脉内皮细胞EndMT。
TGF-β1诱导EndMT的具体分子机制与Snail转录因子相关,而TGF-β1使Snail表达上调依赖于Smad蛋白的激活[13]。TGF-β1与膜受体结合并使受体相关的Smad2和Smad3磷酸化。被激活的Smad2/3与通用型Smad(Co-Smad)相互作用,形成异源二聚体Smad-复合物后进入细胞核,启动Smad介导的转录事件[14]。在Smad靶基因中,Snail转录因子与EndMT相关。简而言之,TGF-β1可以通过激活Smad2/3上调Snail的表达,诱导EndMT[15]。Smad1/5参与调节骨形成蛋白信号通路,在EndMT过程中其磷酸化水平被抑制。本研究结果显示,经TGF-β1刺激后,PMVECs细胞p-Smad2和Snail蛋白表达上调,p-Smad1/5的蛋白水平下调,证实了在TGF-β1刺激剂的作用下TGF-β1/Smad信号通路被激活,并诱导了PMVECs细胞EndMT。而血府逐瘀汤则逆转了这些蛋白的表达。因此可以表明血府逐瘀汤可以调节TGF-β1/Smad信号通路,并能通过此通路来影响肺动脉内皮细胞EndMT。
在本研究中,我们将TGF-β的受体抑制剂SB 431542作为阳性对照药物,以期它可以通过TGF-β1信号通路抑制EndMT这一病理过程。从实验结果中可以看出,SB 431542可以显著上调内皮细胞标志物CD31的表达,以及内皮间质转化抑制因素Smad1/5的磷酸化,对间质细胞标志物α-SMA和TGF-β下游Smad2磷酸化有一定降低趋势,但没有表现出统计学差异。EndMT是一个复杂的生物学过程,TGF-β1是其中经典的影响通路之一,包括TGF-β1/Smad及TGF-β1/non-Smad,除此之外其他通路如Wnt/β-catenin,Notch信号通路也参与EndMT的发生[4]。基于此,我们推测在SB 431542单一因素的作用下,Smad2磷酸化过程发生的同时,会受到部分相关信号分子的影响,产生表达水平的变化。PH在发病初期即有肺血管损害,其病变部位主要在脉,以血瘀为主要病理因素,活血化瘀法应该贯穿于PH各阶段、各证型的治疗之中。血府逐瘀汤是《医林改错》中的经典名方,它可以起到活血化瘀,行气止痛的作用,主要治疗胸中血瘀,血行不畅引起的多种病症。该方由桃红四物汤(桃仁、红花、川芎、当归、生地、赤芍)结合四逆散(柴胡、枳壳、甘草、芍药),再加上桔梗和牛膝组合而成。方中用桃仁、红花、川芎、牛膝活血化瘀,治疗血分瘀滞。血液运行通畅,除了有赖于心气推动以外,还需要肺气宣降和肝气疏调,故配伍桔梗开宣肺气,柴胡、枳壳疏肝调气,治疗气分郁结。用当归、地黄补血滋阴,以求活血不耗血,理气不伤阴。同时配伍芍药、甘草,柔和经脉,缓急止痛。诸药合用,活血药行脉内瘀血,行气药疏脉外气滞,柔肝缓急药解脉络痉挛,体现了脉内脉外与脉管同治之法[16]。现代药理研究表明,血府逐瘀汤的主要化学成分包括甾体皂苷、黄酮类、有机酸以及萜类,不管是其中的单味药还是复方,均显示出了一定的抗PH作用[17]。
本研究表明,血府逐瘀汤可以减轻TGF-β1诱导的PMVECs细胞形态学改变,并且能上调内皮细胞标志物CD31,下调间质细胞标志物α-SMA的表达,说明血府逐瘀汤可以改善PMVECs向间充质细胞转化。除此之外,血府逐瘀汤还可以降低PMVEC的p-Smad2和Snail的蛋白表达,上调p-Smad1/5的蛋白表达,说明血府逐瘀汤可以调控TGF-β1/Smad信号通路。血府逐瘀汤改善肺血管内皮细胞EndMT,其作用机制可能与影响TGF-β1/Smad信号通路密切相关。
