外源性硫化氢对肾小球系膜细胞缺氧/复氧损伤的影响及其机制
2024-01-22林真亭李鸿珠
林真亭,田 华,李鸿珠
(1. 厦门医学院基础医学部,福建 厦门 361023;2. 厦门大学医学院基础部,福建 厦门 361102)
肾小球系膜细胞是肾脏重要的固有细胞之一[1],位于肾小球毛细血管袢之间,邻接内皮细胞或基底膜,形态不规则,细胞突起可深至内皮细胞和基底膜之间,具有维持系膜基质稳态和肾小球结构、支撑毛细血管、调节滤过表面积,分泌肾素、吞噬坏死和凋亡细胞等重要作用[1-2]。因此,肾小球系膜细胞损伤对机体的危害非常大。
硫化氢(hydrogen sulfide,H2S)是继一氧化碳和一氧化氮之后发现的第三种气体信号分子。生理浓度范围的H2S在机体各个组织器官发挥重要的生物学作用,其发挥作用的靶点是调节细胞增殖、凋亡和分化、信号转导、离子转运、能量代谢、蛋白质修饰等[3-5]。据报道,外源性H2S通过抑制氧化应激和细胞凋亡减轻肾脏[6]损伤;同时,外源性H2S可抑制高糖诱导的肾小球系膜细胞增殖与迁移[7],也可减轻同型半胱氨酸诱导的系膜细胞凋亡和基质重塑[8],但其与肾小球系膜细胞缺氧/复氧(hypoxia/reoxygenation,H/R)损伤的关系尚未见报道。本研究的目的是证实H2S可直接作用于肾小球系膜细胞,通过抑制氧化应激,降低细胞凋亡,增加细胞存活率,从而增强肾小球系膜细胞拮抗H/R损伤的能力。
1 材料与方法
1.1 药品与试剂小鼠肾小球系膜细胞系 SV40MES13 购自中国科学院上海细胞库,硫氢化钠(sodium hydrosulfide,NaHS)、PD98059(mitogen-activated protein kinase 1,ERK1/2 抑制剂)和7-azido-4-methylcoumarin购自美国Sigma公司,CCK8试剂盒和活性氧(reactive oxygen species,ROS)试剂盒、Western blotting相关试剂购自碧云天生物技术研究所,超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)生化试剂盒购自南京建成生物工程研究所。CSE、 cleaved-caspase-3、Cytc、Bcl-2和β-acin抗体购自武汉三鹰生物技术有限公司,ERK1/2抗体购自美国 Cell Signaling 公司,DMEM 培养基和胎牛血清购自美国 Gibco 公司,其他试剂为国产分析纯。
1.2 SV40MES13细胞培养、处理与分组SV40MES13细胞在含5% 胎牛血清的DMEM 培养基中孵育,待其细胞密度达到60%~70% 时,将SV40MES13细胞放入自制的缺氧罐内,通入混合气体(2% O2,5% CO2, 93% N2)2 h,再将细胞取出,放入培养箱复氧24 h,复制H/R模型[9],记为缺氧/复氧(H/R)组。将正常培养的SV40MES13细胞记为对照(Control)组。在复氧过程中加入 100 μmol· L-1NaHS记为H/R+NaHS组。
1.3 CCK8试剂盒检测细胞活力SV40MES13细胞以1×103个/孔均匀接种于96孔板,各组分别处理后,用无菌的PBS漂洗2次;每孔加入10 μL CCK-8工作液,在37 ℃ 恒温箱中避光继续培养2 h;将96孔板置于酶标仪读取570 nm波长的A值,计算并分析细胞活力。
1.4 Hoechst 33342染色检测细胞凋亡率细胞在发生凋亡时,其细胞膜的通透性会增强,且凋亡细胞的染色体 DNA 结构产生改变,使凋亡细胞内染料相比正常的细胞染料多,更有效地与 DNA 结合,使蓝色荧光明显增强。具体操作是:各孔板中细胞分别处理后,用PBS 漂洗细胞3次,加入5 g· L-1的 Hoechst 33342 染液,37 ℃ 避光孵育 30 min;随后在暗室中弃去染液,再用 PBS 漂洗3 次,并在每孔中加入500 μL PBS。在荧光显微镜下观察并拍照,每组选取10个视野统计凋亡细胞的比率。
1.5 细胞内ROS水平测定以1×106个/孔接种在12孔板中,并分别处理;PBS 洗涤3次,加入终浓度10 μmol· L-1的DCFH-DA溶液,37 ℃ 恒温箱中避光孵育20 min;用不含血清 DMEM 的培养基清洗细胞3次,充分去除DCFH-DA染料;488 nm激发波长,525 nm发射波长的荧光显微镜进行拍照。细胞内ROS将非荧光DCFH氧化成荧光DCF,荧光强度反映ROS水平。
1.6 细胞匀浆中SOD 活性和MDA含量测定将各组SV40MES13细胞用匀浆器研磨并制成 10% 的细胞匀浆液,用3 000 r·min-1离心 10 min 之后,取上清液,分别检测SOD 活性和 MDA 含量。SOD测定采用羟胺法;MDA 测定采用 TBA法;步骤严格按照说明书要求进行。在紫外分光光度计上读出吸光度值,按公式分别计算 SOD 活性和 MDA 含量。
1.7 探针7-azido-4-methylcoumarin(C-7Az)测量细胞H2S含量SV40MES13细胞接种于3.5 cm小型培养皿中,各组细胞分别用PBS缓冲液清洗2次,每次1 min左右。将细胞与含有50 μmol· L-1C-7Az的PBS于暗处常温孵育30 min,孵育完成用PBS洗涤细胞3次,每次1 min。使用荧光显微镜观察细胞中C-7Az对H2S的荧光响应。
1.8 Western blot 检测相关蛋白表达首先细胞中加入适量的RIPA裂解液,提取总蛋白,用BCA方法对提取的总蛋白进行定量。然后蛋白经SDS-PAGE电泳、转膜,封闭后,加入一抗4 ℃ 过夜孵育。加入二抗室温孵育1 h,滴加ECL试剂在PVDF膜上,使用ImageJ分析蛋白条带灰度值,以β-actin作为内参。
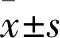
2 结果
2.1 SV40MES13细胞内源性CSE/H2S系统变化与Control比较,H/R明显降低CSE的蛋白表达和H2S产率(P<0.01);与H/R比较,H/R+NaHS显著增加CSE的蛋白表达和H2S产率(P<0.01)(Fig 1)。这说明SV40MES13细胞H/R 损伤与内源性CSE/H2S系统下调有关,外源性H2S可上调CSE/H2S系统。
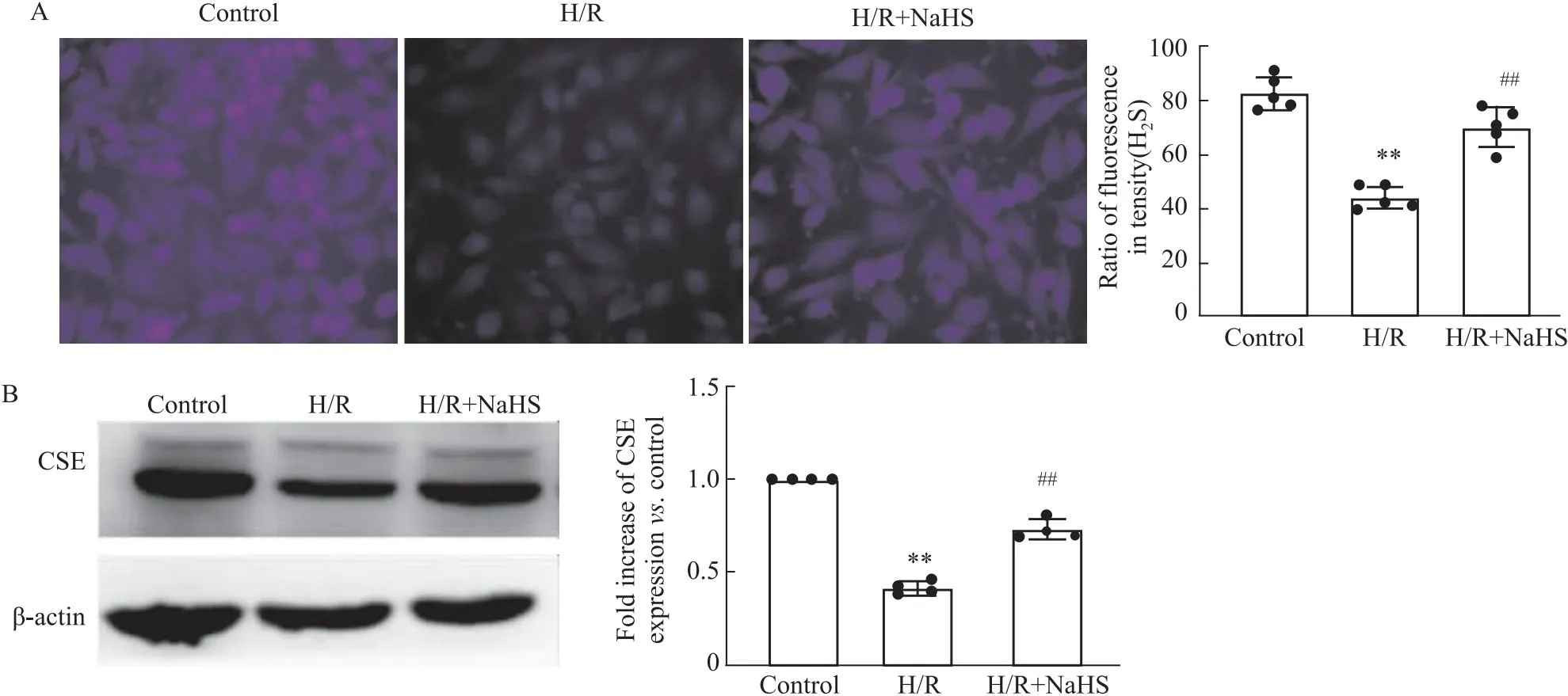
Fig 1 Change of H2S production and CSE protein expression in different groups (n=4)
2.2 SV40MES13细胞活力变化与Control组比较,H/R组细胞活力降低(P<0.01);与H/R组比较,H/R+NaHS组细胞活力显著升高(P<0.01)(Fig 2)。这说明外源性H2S可逆转H/R诱导的SV40MES13细胞活力下降。

Fig 2 Change of cell activity in different groups (n=8)
2.3 SV40MES13细胞氧化应激变化与Control比较,H/R明显升高ROS和MDA含量,降低SOD活性(P<0.01);与H/R比较,H/R+NaHS显著逆转了H/R对上述指标的影响(P<0.01)(Fig 3)。这说明外源性H2S通过减少氧化应激抑制SV40MES13细胞H/R损伤。
2.4 SV40MES13细胞凋亡相关指标改变与Control组比较,H/R组细胞凋亡率促凋亡蛋白细胞色素 C(cytochrome c,Cyt c)和Cleaved caspase-3表达显著增加(P<0.01),抑凋亡蛋白Bcl-2表达明显减少(P<0.01)。与H/R组比较,H/R+NaHS组细胞凋亡率和促凋亡蛋白表达明显减少(P<0.01),抑凋亡蛋白表达显著增加(P<0.01)(Fig 4和5)。这说明外源性H2S通过减少细胞凋亡抑制SV40MES13细胞H/R损伤。
2.5 SV40MES13细胞ERK1/2通路变化与Control比较,H/R明显降低磷酸化ERK1/2(p-ERK1/2)活性(P<0.01);与H/R比较,H/R+NaHS显著增加p-ERK1/2活性,且PD98059 取消了NaHS的作用(P<0.01)。各组总ERK1/2(t-ERK1/2)活性保持不变(Fig 6)。这说明外源性H2S通过激活ERK1/2通路减少细胞凋亡和氧化应激,从而抑制SV40MES13细胞H/R损伤。
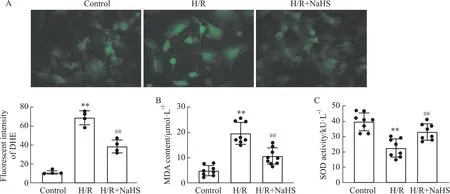
Fig 3 Change of oxidative stress related indexes in different groups (n=5)
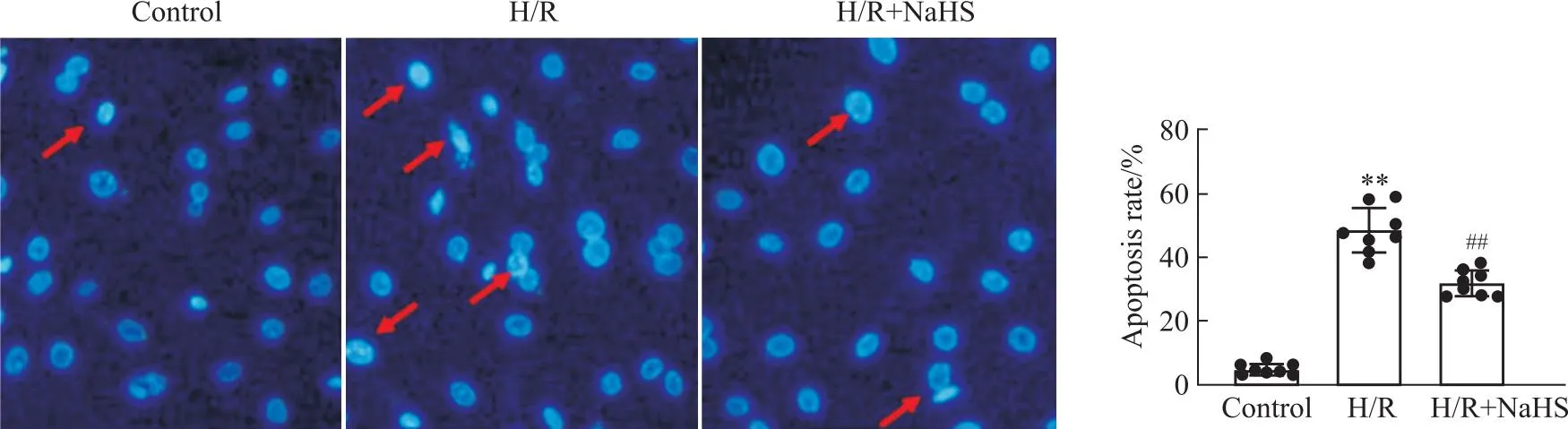
Fig 4 Change of apoptosis rate in different groups (n=8)
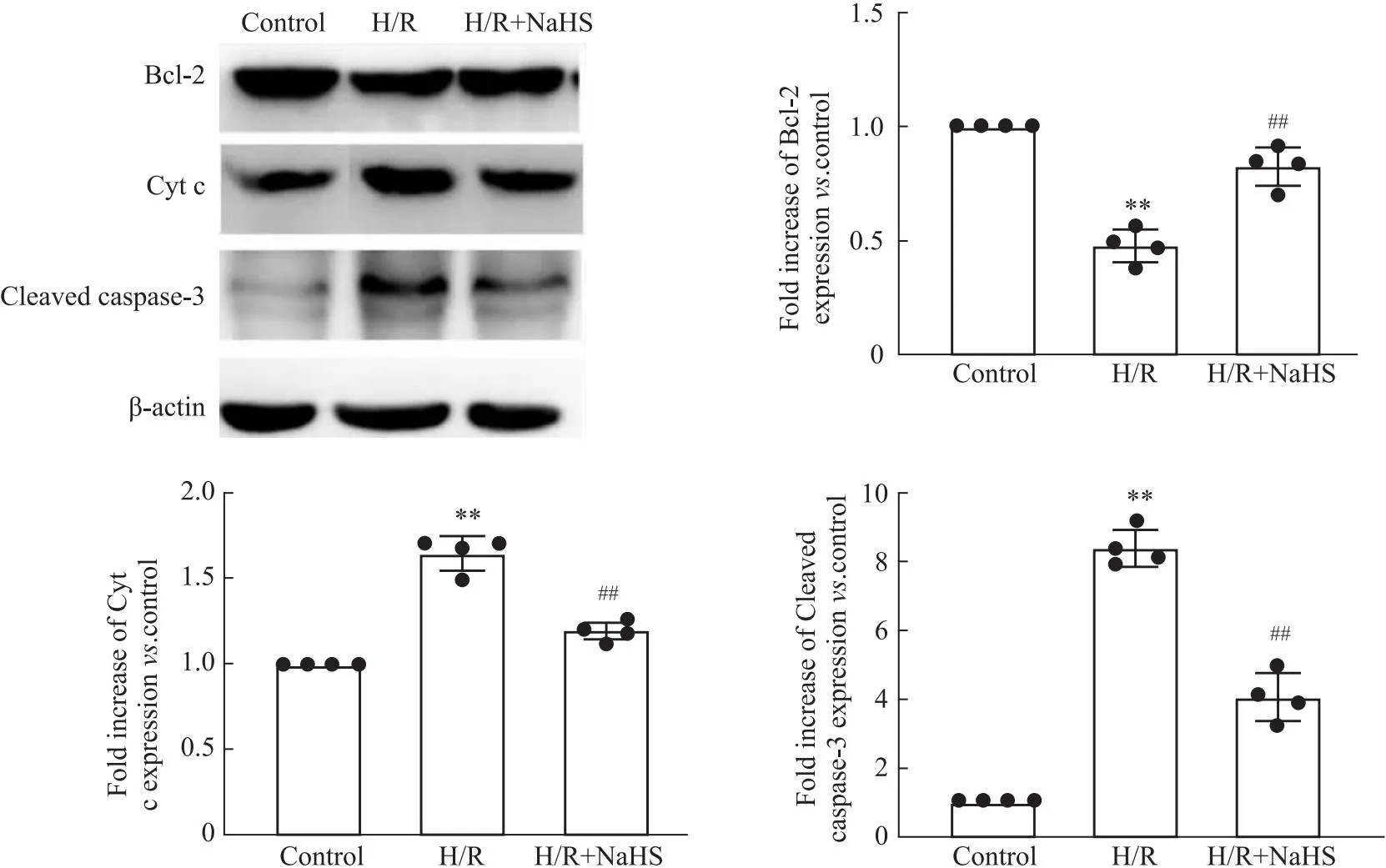
Fig 5 Changes of apoptosis-related protein expression in different groups (n=4)
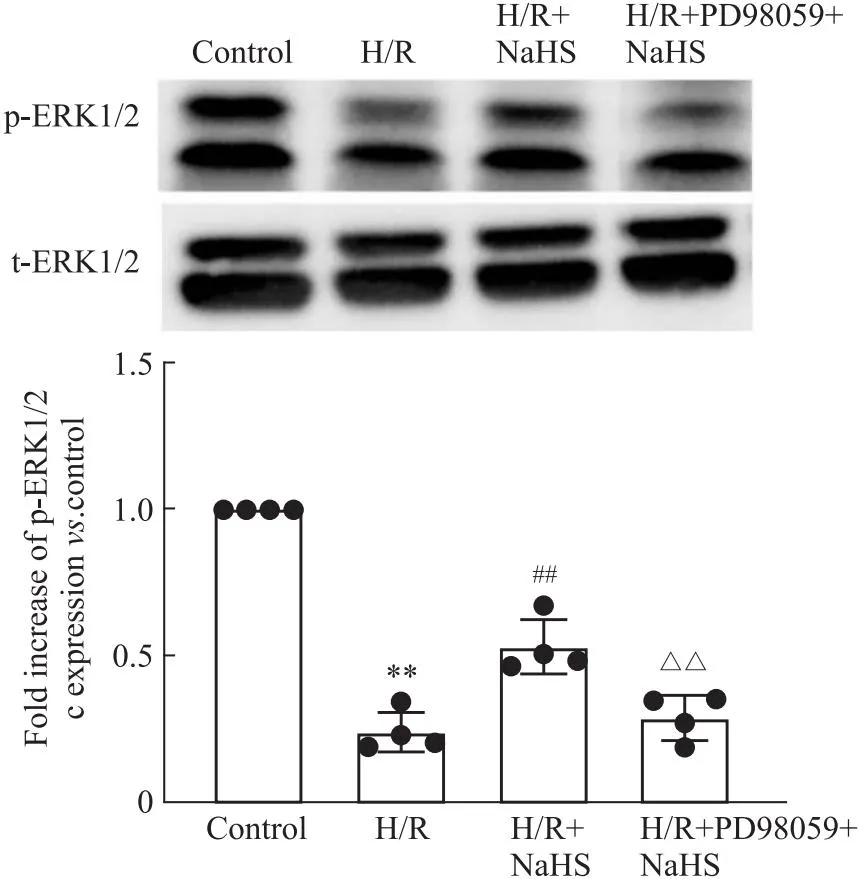
Fig 6 Changes of ERK1/2 pathway in different groups of cells (n=4)
3 讨论
缺血/再灌注过程中产生大量氧自由基、炎性细胞、钙超载,进而促使细胞凋亡,H/R诱导的细胞损伤模型已被用于缺血/再灌注损伤的体外模型[10]。本实验结果显示,与Control组比较,H/R组细胞活力、SOD活性和抑凋亡蛋白(Bcl-2)表达明显降低,而ROS和MDA含量、细胞凋亡率、促凋亡蛋白(Cyt c和Cleaved caspase-3)表达显著增加。这说明H/R促进SV40MES13细胞发生氧化应激和细胞凋亡,提示我们成功建立了肾小球系膜细胞H/R损伤模型。
长期以来,H2S被认为是一种污染环境的有毒气体,但近年来研究发现,生理浓度范围内的H2S通过抑制细胞增殖、炎症反应、细胞焦亡,调控凋亡、氧化应激、mPTP 开放、离子通道及细胞信号转导通路等在心血管、神经、消化、呼吸等系统中发挥重要的调节功能[3-5,11-13]。据报道,外源性H2S可抑制心肌细胞H/R损伤,但其与肾小球系膜细胞H/R损伤的关系尚不清楚。
本实验研究结果显示,与Control比较,H/R明显降低CSE蛋白表达和H2S产率;与H/R比较,H/R+NaHS显著增加CSE蛋白表达和H2S产率。这说明肾小球系膜细胞H/R 损伤与内源性CSE/H2S系统下调有关,外源性H2S可上调CSE/H2S系统。
众所周知,H/R诱导自由基的产生,使ROS生成增加。低浓度ROS对机体起到保护作用,过量的ROS促进脂质过氧化物产物的生成,如丙二醛(MDA)[14]。MDA能够损伤组织和细胞,并且MDA水平反映了ROS的损伤程度。体内抗氧化剂可清除过量产生的ROS[14],如,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-PX),它们作为自由基清除剂,主要清除过氧化氢(H2O2)和羟基自由基(OH·),从而减轻氧化应激对细胞损伤[14-15]。
H/R可诱导细胞凋亡。当H/R引起细胞损伤时,Cyt c从受损的线粒体中释放出来。Cyt c 通过形成含有细胞色素c/Apaf-1/ caspase-9 的复杂凋亡体,触发胞质caspase-3活化,进而导致细胞凋亡。Bcl-2是一种有效的细胞凋亡抑制因子,可以抑制线粒体的破坏进而减少 Cyt c的漏出和抑制caspase的活化,最终抑制细胞凋亡[15]。
结果显示,与Control组比较,H/R组细胞活力、SOD活性和抑凋亡蛋白(Bcl-2)表达明显降低,而ROS和MDA含量、细胞凋亡率、促凋亡蛋白(Cyt c和cleaved-caspase-3)表达显著增加。与H/R比较,H/R+NaHS逆转了H/R对上述指标的影响。这说明外源性H2S通过减少氧化应激和细胞凋亡,从而抑制肾小球系膜细胞H/R损伤。
ERK1/2信号通路是丝裂原活化蛋白激酶的成员之一,是调控细胞生长、增殖、凋亡、炎症、应激等环节的重要通路[10]。当ERK1/2 发生磷酸化活化时,磷酸化的 ERK1/2 一方面能够使多种caspase 的表达受到抑制,进而阻碍细胞凋亡的发生,另一方面能够使核因子表达受到抑制进而阻碍炎症细胞因子的分泌及炎症反应的发生[16]。
本实验结果显示,与Control比较,H/R明显降低p-ERK1/2活性;与H/R比较,H/R+NaHS显著增加p-ERK1/2活性,且 ERK1/2抑制剂PD98059取消了NaHS的作用。各组t-ERK1/2活性保持不变。这说明外源性H2S通过激活ERK1/2通路减少氧化应激和细胞凋亡,进而抑制肾小球系膜细胞H/R损伤。
综上所述,本研究揭示了(1)肾小球系膜细胞H/R 损伤与内源性CSE/H2S系统下调有关;(2)外源性H2S通过上调ERK1/2通路减少氧化应激和细胞凋亡,进而抑制肾小球系膜细胞H/R损伤(Fig 7)。这为缺血性肾脏疾病的防治提供了新思路和新靶点。
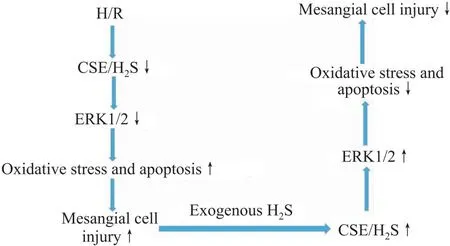
Fig 7 Mechanism of exogenous H2S inhibiting H/R injury in glomerular mesangial cells
