异硫氰酸苄酯通过激活p53和AMPK-FOXO1a信号通路诱导宫颈癌细胞周期阻滞和凋亡
2024-01-22塔玛莎库尔曼江王小静李欣奕解国轩陈雲杰程夕露努尔阿米乃麦麦提李金玉
塔玛莎·库尔曼江,王小静,李欣奕,王 昊,解国轩,陈雲杰,温 婷,程夕露,努尔阿米乃·麦麦提,李金玉
(新疆特殊环境物种保护与调控生物学实验室,新疆特殊环境物种多样性应用与调控重点实验室,新疆师范大学生命科学学院,新疆 乌鲁木齐 830054)
宫颈癌是全球女性癌症相关发病率和死亡率的主要原因之一。2020年全球宫颈癌新发病例60.4万,发病率15.6/100 000;死亡病例34.2万,死亡率8.8/100 000[1]。尽管通过人乳头瘤病毒 (human papilloma virus,HPV) 疫苗接种和筛查可高度预防宫颈癌。对已经感染HPV的中晚期宫颈癌患者,仍迫切需要寻找新的高效、低毒抗宫颈癌药物。
通过饮食蔬菜和水果是有效预防癌症的手段。异硫氰酸酯(isothiocyanates,ITCs)是广泛存在拟南芥、油菜、旱金莲、水芹、卷心菜、甘蓝、萝卜等十字花科蔬菜中的一种天然抗癌活性分子,是由前体硫苷在体内黑芥子酶作用下水解而来[2]。到目前为止,已经报道了几十种天然的或半合成的异硫氰酸盐,以莱菔硫烷(sulforaphane,SFN)、苯乙基异硫氰酸酯(phenethyl isothiocyanate,PEITC)和异硫氰酸苄酯(benzyl isothiocyanate,BITC)报道较多。BITC在结构上带有一个芳香环侧链和一个高度亲电的碳原子中心,水解时会产生活性氧(reactive oxygen species,ROS),因此造成脱氧核糖核酸氧化损伤[3]。研究证实,BITC是一种有效的化学保护剂,它可以防止啮齿类动物的化学致癌作用,同时也具有抗癌作用。在不同的体内外实验中发现,BITC能够诱导多种肿瘤细胞凋亡、细胞周期阻滞、抑制细胞迁移和侵袭、抑制血管生成和诱导细胞自噬。其中,乳腺癌、胰腺癌、肺癌是报道较多的肿瘤[4-5]。此外,研究证明,BITC对正常组织无毒性,是一种安全的有潜力的抗癌活性物质[6]。然而,BITC对宫颈癌的作用及其机制未有详尽报道。本研究初步评估了BITC对小鼠宫颈癌细胞U14的细胞毒性,通过RNA-seq分析、qRT-PCR及Western blot方法探讨了BITC抑制U14细胞增殖的作用机制,为开发和利用BITC用于宫颈癌治疗提供理论依据。
1 材料与方法
1.1 实验药物BITC(98%,C7H2F3NS)购于上海源叶公司,使用前溶于DMSO中,配置成200 mmol·L-1的母液,过滤除菌后,4 ℃冰箱储存,使用时用DMEM培养液对其进行稀释。
1.2 细胞培养将U14细胞(新疆医科大学生物实验室)接种在含DMEM培养皿(含10% FBS和1%双抗)中,37 ℃、5% CO2培养箱中培养。
1.3 试剂MTT(3(- 4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)、二甲基亚砜(DMSO)购自美国Sigma公司;顺铂(Cisplatin)购自上海源叶生物有限公司;DMEM培养基、胰蛋白酶、双抗(青霉素10 kU·mL-1和链霉素10 g·L-1混合液),胎牛血清(FBS)购自BI公司;BCA蛋白定量试剂盒,ECL显色剂,β-actin、Bcl-2、CytC、Bax、p21、MDM2、Cyclin D3、CDK2、Cyclin E、AMPK、Foxo1α二抗山羊抗兔IgG购自上海碧云天生物技术有限公司;caspase 3/7/9、cleaved caspase-3/7/9购自Cell Signaling Technology公司。
1.4 仪器DYCZ-24DN型电泳槽(北京六一),DYCZ-40D型转膜槽(北京六一),DYY-10C型电泳仪(北京六一),Illumina 测序平台(上海美吉生物公司),Cytoflex流式细胞仪(美国Beckman公司)
1.5 方法
1.5.1MTT法检测U14细胞增殖活性 将对数生长期的细胞按照2×103/孔接种于96孔板中培养,每孔100 μL,37 ℃过夜培养24 h后,弃上清,用BITC(0、20、40、60 μmol·L-1)和0.1% DMSO(相当于60 μmol·L-1BITC工作液中DMSO的浓度)分别处理U14细胞24、48、72 h,以不加配合物为空白对照,Cisplatin为阳性对照。每个组别设置6个平行孔。将上清吸出,在避光的环境下,每孔内添加无血清培养基配置的MTT 100 μL,细胞培养4 h后,吸出上清,再加入200 μL DMSO,振荡孵育10 min,使其充分溶解结晶紫。酶标仪490 nm处读取每孔吸光度值,按照如下公式计算细胞的相对活性:
细胞的相对活性=实验组平均A值/对照组平均A值×100%
1.5.2Hoechst staining 33258染色法检测细胞核形变化 将对数生长期的U14细胞按照1×105/孔接种于24孔板中于37 ℃细胞培养箱中培养过夜,加入不同终浓度的BITC(0、20、40、60 μmol·L-1)处理细胞24 h后,每孔添加预冷的4%多聚甲醛500 μL,4 ℃冰箱固定10 min,固定后,每组细胞用PBS洗涤,滴加用PBS溶液稀释的Hoechst 33258染色溶液以1 ∶100,孵育5 min,用PBS洗涤3次(5 min/次),然后直接使用荧光显微镜观察染色。
1.5.3流式细胞术检测细胞凋亡和周期 对数生长期的U14细胞按照8×105/皿接种到60 mm的细胞培养皿中,用不同终浓度的BITC(0、20、40、60 μmol·L-1)处理12 h后,1 200 r·min-1离心5 min收集细胞,收集的细胞沉淀用30 μL PBS重悬后,每个样品分别加入膜联蛋白V-FITC染液5 μL和PI染液5 μL,冰上避光孵育30 min;对于细胞周期,细胞沉淀先用70%乙醇固定过夜,去除乙醇后,用30 μL PBS重悬细胞,然后每个样品加入PI染液5 μL冰上避光染色30 min,充分混匀后上流式细胞仪检测细胞凋亡率和细胞周期分布。
1.5.4转录组样品和数据处理 将对数生长期的细胞按照5×106/皿接种于100 mm细胞培养皿中培养24 h后,用不同终浓度的BITC(0、20 μmol·L-1)分别处理U14细胞6 h 和18 h 后取样。每个处理做3个生物学平行组。以不加BITC作为空白对照,培养6 h的3个空白对照组分别标记为K6-1、K6-2、K6-3。BITC处理6 h的3个实验组分别标记为B6-1、B6-2、B6-3,培养18 h的空白对照组分别标记为K18-1、K18-2、K18-3。 BITC处理18 h的实验组分别标记为B18-1、B18-2、B18-3。共计12个样品用锡箔纸包裹后立即置于液氮中速冻。
采用TRIzol试剂盒提取样品RNA,利用琼脂糖凝胶电泳和微量紫外分光光度计检测RNA的浓度和纯度,质量合格后,进一步富集纯化mRNA,片段化逆转录得到双链cDNA。然后依次末端修复,拼接,PCR扩增构建cDNA文库。使用Illumina Novaseq 6000进行转录组测序得原始数据(raw data),采用Fastp分析软件对raw data进行过滤,去除接头和低质量的reads后得到Clean data。使用Hisat软件,将Clean data和参考基因组进行比对,获得后续分析的有效数据(mapped reads)。
1.5.5表达量分析及差异基因筛选 利用RSEM软件对基因的表达水平进行定量分析,使用转录组条目(TPM)为表达量指标,进行样本间基因差异的表达分析。使用DESeq2软件并以P<0.05、Fold Change(FC)≥2和FC≤0.5为筛选条件获得比较组间差异表达基因(differentially expressed genes,DEGs)。
1.5.6GO功能和KEGG富集分析 利用Blast2GO软件将DEGs在GO(Gene Ontology)数据库进行比对获得GO功能注释,利用Goatools软件对DEGs进行GO富集分析;将DEGs在KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库进行比对获得KEGG通路注释信息。采用Fisher精确检验,以P<0.05时表示GO功能和KEGG通路出现了显著富集。
1.5.7实时荧光定量PCR(qRT-PCR)分析 BITC(0、20 μmol·L-1处理细胞6 h后采用TRIzol试剂盒提取样品总RNA,利用Primer Premier 5.0设计qRT-PCR引物 (Tab 1),引物由生工生物工程(上海)股份有限公司合成。按SuperReal荧光定量预混试剂盒说明书,以β-actin为内参基因,采用相对比较2-ΔΔCt法对部分差异基因的表达水平进行定量检测,应用GraphPad Prism 9软件作图分析。

Tab 1 Ire1a,Aft4,β- actin and other gene primers design
1.5.8Western blot检测凋亡相关蛋白表达 将对数生长期的细胞按照5×106/皿接种于100 mm细胞培养皿中,于37 ℃细胞培养箱中培养 24 h后,加入不同浓度的BITC(0、20、40、60 μmol·L-1)处理12 h,离心收集细胞,加入RIPA裂解液冰上裂解20 min,离心保留上清,使用BCA法对细胞上清中的总蛋白含量进行定量。总蛋白采用12% SDS-PAGE电泳分离后,转至硝酸纤维素(PVDF)膜。使用5%脱脂奶粉于室温封闭2 h后,TBST洗涤3次,15 min/次,加入一抗(β-actin、Bcl-2、Bax、CytC、caspase-3/7/9、cleaved caspase-3/7/9)37 ℃ 孵育2 h,TBST洗涤3次,然后加入二抗(HRP 标记的山羊抗兔 IgG )37 ℃ 孵育1 h,TBST 洗涤3次,按1 ∶1比例加入发光A液和B液,暗室显色,用凝胶成像仪观察显影蛋白条带。
1.5.9 统计学分析所有数据用Graphpad prism 9软件进行统计分析,数据均显示为mean±SD,n=3。采用单因素方差分析。与Control相比,P<0.05具有差异显著性。
2 结果
2.1 BITC对U14细胞活力的影响用不同浓度的BITC(0、20、40、60 μmol·L-1)处理细胞 24、48、72 h后,BITC显著抑制了U14细胞的增殖作用 (P<0.001) (Fig 1A),72 h的抑制率分别为62.63%、92.56%、95.42% (Fig 1B),3个时间段的IC50值分别是22.54 μmol·L-1、15.39 μmol·L-1、12.43 μmol·L-1。与Control组相比,随着BITC处理浓度的增加,细胞形态逐渐变圆,贴壁能力减弱,细胞数量显著下降(Fig 1C)。
2.2 BITC诱导了U14细胞核DNA凝聚不同浓度的BITC (0、20、40、60 μmol·L-1)作用HeLa细胞24 h后,采用Hoechst 33258染色,倒置荧光显微镜观察,如Fig 2所示,Control组可见细胞形态完整,细胞染色均匀,但BITC组染色质浓缩,蓝白荧光强,且随着浓度增加,细胞荧光比例增加,核碎片现象加重,表明BITC 作用于细胞DNA,可能诱导U14细胞凋亡。
2.3 BITC诱导U14细胞阻滞如Fig 3所示,BITC 处理U14细胞12 h后,显著增加了G0/G1期细胞比例(P<0.05),降低了S期细胞分布(P<0.01)。同时,也观察到G2/M期细胞随着浓度增加先上升后降低。揭示BITC主要诱导细胞周期阻滞在G0/G1期。
2.4 BITC诱导U14细胞凋亡诱导肿瘤细胞凋亡是治疗癌症的手段之一。细胞凋亡途径主要有外源性死亡受体途径、内源性内质网途径、内源性线粒体途径[7]。为了进一步确认BITC是否诱导了U14 细胞凋亡,不同浓度的BITC(0、20、40、60 μmol·L-1)作用U14细胞12 h 后,通过Annexin V-PI双染,流式细胞仪检测分析显示,与Control相比,随着 BITC浓度的增加,BITC剂量依赖性地诱导了细胞凋亡(P<0.05,P<0.01),细胞凋亡率从最初的7.81%上升到86.4%(Fig 4A)。Western blot进一步分析显示(Fig 4B),与Control相比,促凋亡蛋白Bax、CytC、cleaved caspase-3/9表达显著增加(P<0.05和P<0.01),抑制凋亡蛋白Bcl-2、caspase-3/7/9、cleaved caspase-7蛋白表达显著下降(P<0.01)。这些结果表明,BITC可通过线粒体途径诱导U14细胞凋亡。
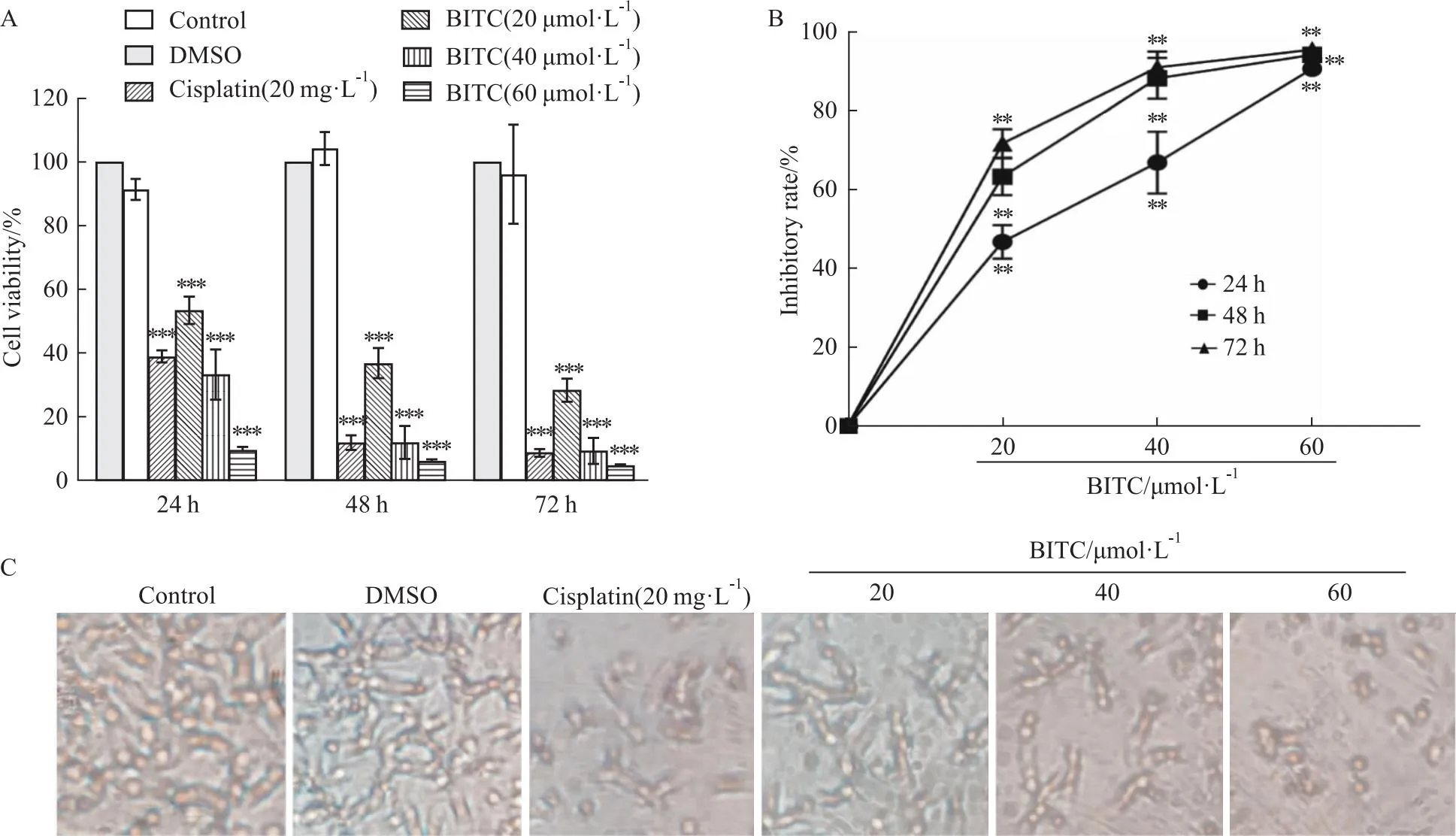
Fig 1 Effect of BITC on proliferation of U14
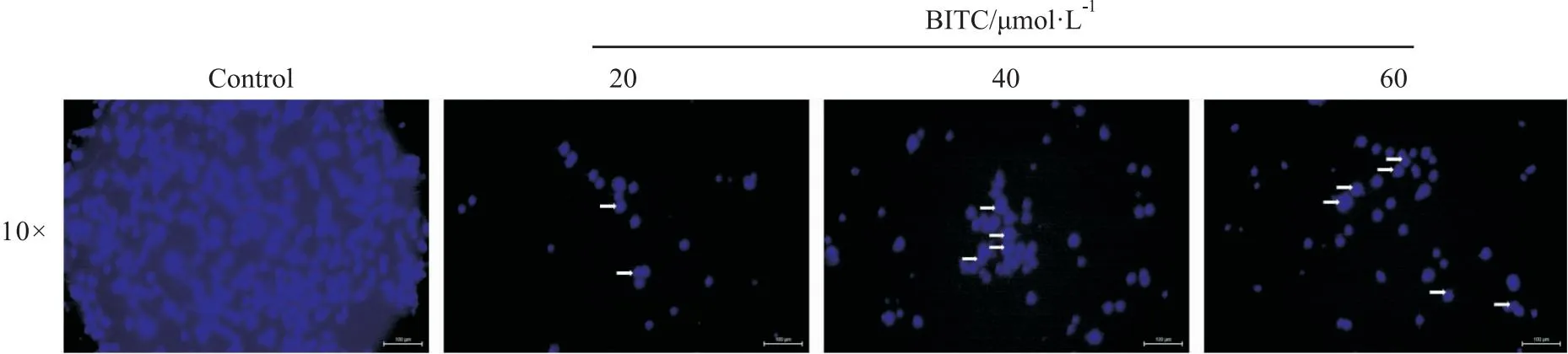
Fig 2 The morphological changes of U14 cells after BITC treatment detected by Hochest 33258 stainingThe arrows indicate the chromosomal condensation.
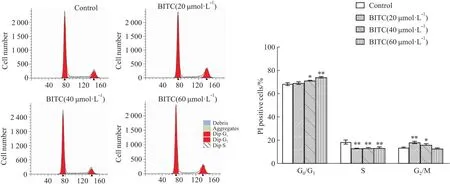
Fig 3 Cell cycle distrubution in U14 cells upon BITC *P<0.05,**P<0.01 vs Control group.
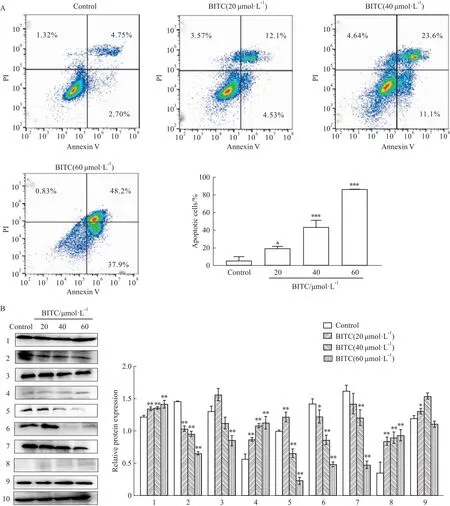
Fig 4 Effect of BITC on apoptosis of U14
2.5 差异基因筛选采用RSEM软件和DESeq2软件进行差异筛选分析,如图Fig 5所示,经BITC 6 h处理后,以空白组作为对照,在BITC处理组细胞中共获得2 447个DEGs,其中下调基因1 308个,上调基因1 139个。经BITC 18 h 处理后,共获得1 824个DEGs,其中下调DEGs有883个,上调DEGs有941个。由于BITC作用6 h的差异基因较多,以下通路富集分析主要呈现6 h转录组数据。
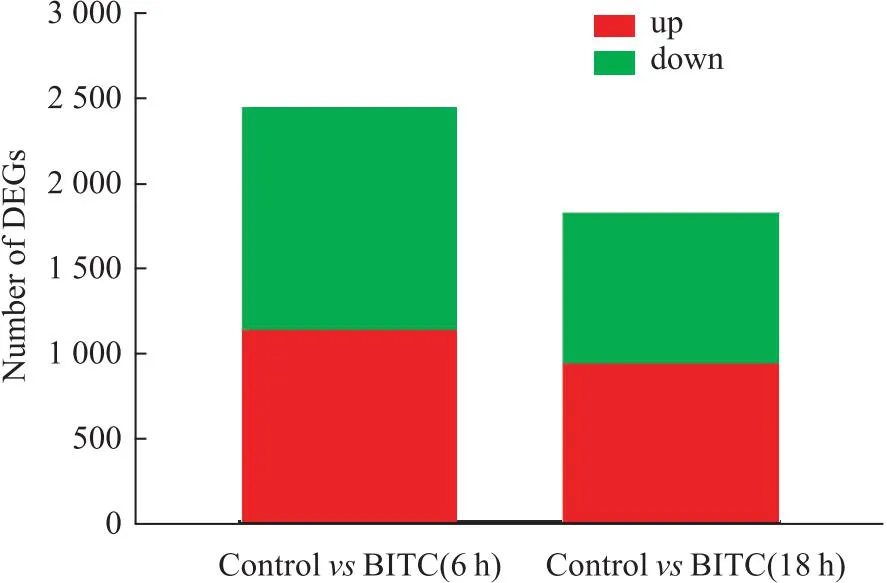
Fig 5 Number of DEGs in U14 cells after treatment of BITC for 6 h or 18 h in comparison to control
2.6 GO功能注释和分类分析对DEGs进行功能分类,主要包括三个类别:生物过程(biological process,BP)、 细胞组分(cellular composition,CC)和分子功能(molecular function,MF)。经 BITC处理U14细胞6 h后,统计富集DEGs数量排名前20的功能分类(Fig 6)。DEGs富集于BP的主要有:细胞进程(cellular process)(1 475个基因)、生物调节(biological regulation)(1 253个基因);富集于CC的有:细胞成分(cell part)(1 766个基因),细胞器(organelle)(1 233个基因),细胞器成分(organelle part)(1 027个基因);富集于MF的主要有:结合(binding)(1 569个基因)。
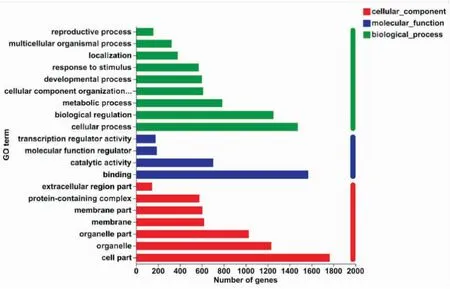
Fig 6 TOP 20 GO function annotation and classification
2.7 KEGG通路富集分析对DEGs进行KEGG通路富集统计,柱状图(Fig 7)展现前20个显著的富集途径。如Fig 7显示,BITC作用U14 6 h后,DEGs主要富集在细胞周期(Cell cycle)、MicroRNAs in cancer、 FOXO信号通路、Fanconi anemia patlravay 信号通路、MAPK信号通路、p53信号通路和细胞凋亡等途径(P<0.05)。

Fig 7 TOP 20 KEGG enrichment of DEGs in U14
2.8 细胞通路分析及验证
2.8.1BITC通过p53信号通路诱导U14细胞周期阻滞 p53参与各种生物反应的激活,主要包括调控细胞周期停滞、DNA修复和细胞凋亡。KEGG pathway分析表明,在BITC处理U14 6 h 后,参与p53信号通路的差异基因有18个(Fig 8),其中有9个基因表达上调,如鼠双微体(murine double minute 2,Mdm2)基因,细胞周期依赖性蛋白激酶抑制因子1A(cyclin-dependent kinase inhibitor 1A,P21)基因;下调基因9个,如细胞周期基因CyclinD3、CyclinE,细胞周期蛋白依赖性激酶2基因(cyclin-dependent kinase2,CDK2)。
根据流式细胞周期与转录组数据分析结果,为了验证 BITC是否通过调控p53细胞通路将U14细胞阻滞在G0/G1期,我们采用qRT-PCR和Western blot验证上述基因及相关蛋白,如Fig 9A、9B所示,P21基因,MDM2基因及蛋白均表达上调,G0/G1期相关调控基因CyclinD3基因,CyclinE基因,Cdk2基因及蛋白均下调。p53基因虽在转录水平无明显变化(与转录组数据一致),但在蛋白水平显著上升,这可能与转录后调控有关。综上所述,BITC可通过调控p53信号通路将细胞阻滞在G0/G1期。
2.8.2BITC也可通过内源性凋亡途径诱导U14细胞凋亡 对BITC作用U14细胞6 h富集在细胞凋亡途径中的DEGs分析发现(Fig 10),尽管没有看到caspase的变化,但下游信号的切割作用底物,如促进细胞皱缩和膜泡发生的Actin基因表达上调,而与有丝分裂相关的微管蛋白α-tubulin以及与DNA周期,复制,分化,凋亡相关的核纤层蛋白Lamin基因下调,表明BITC引发了凋亡。此外,转录组数据分析发现内质网应激凋亡途径中内质网应激激活肌醇酶1a (inositol-requiring transmembrane kinase/endonuclease-1,Ire1a)基因,转录激活因子4(activating transcription factor 4,Atf4)基因,C/EBP转录因子(C/EBP homologous protein,CHOP)基因表达上调。我们又进一步通过qRT-PCR和Western blot验证了BITC是否通过另一内源性途径诱导细胞凋亡。如Fig 11所示,内质网应激Ire1a基因、Atf 4基因、CHOP基因及蛋白表达均显著升高(P<0.05),表明BITC也可通过内源性内质网应激途径( endoplasmic reticulum stress,ERS)诱导U14细胞凋亡。
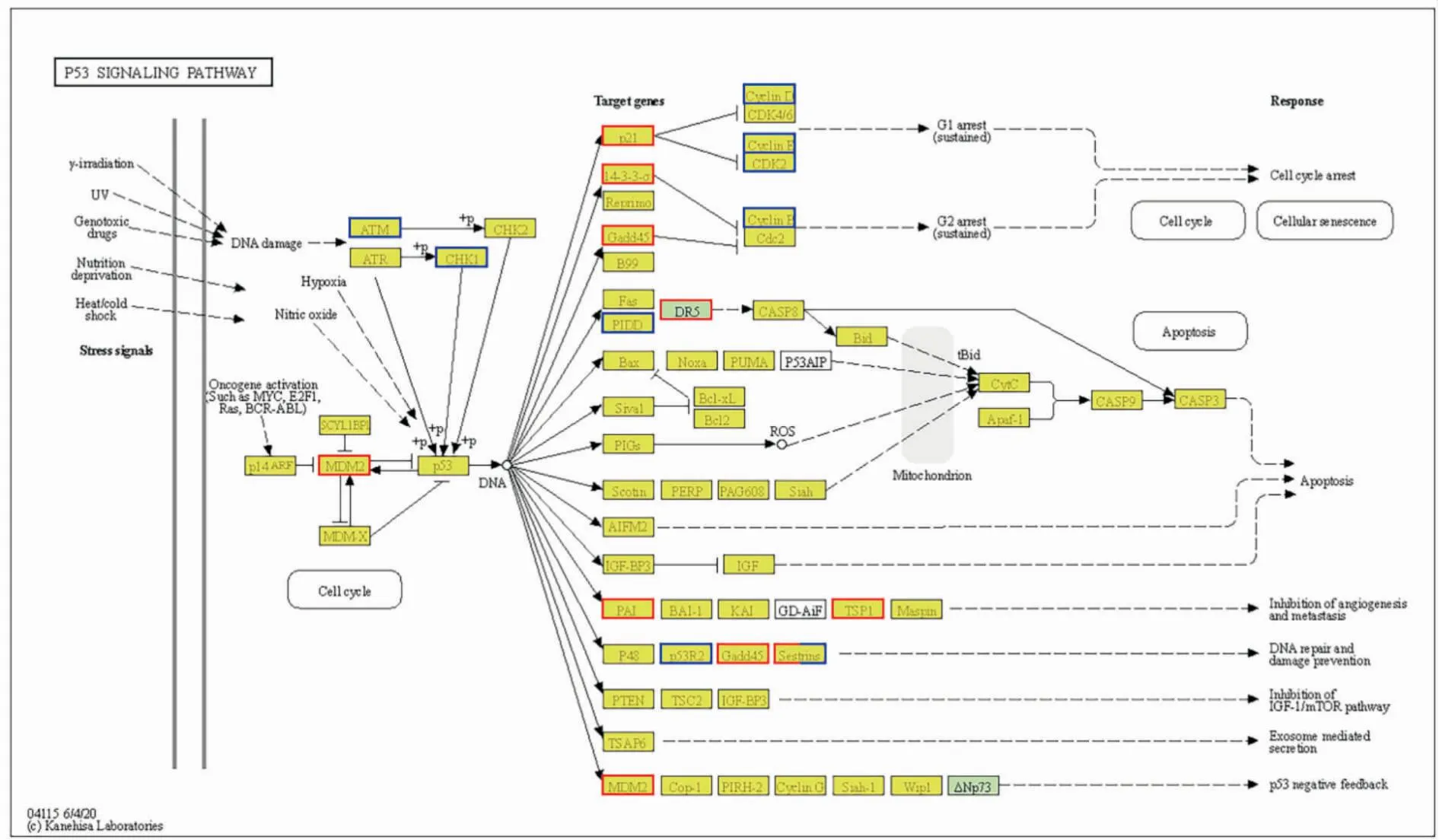
Fig 8 p53 signaling pathway diagram of BITC on U14 cells
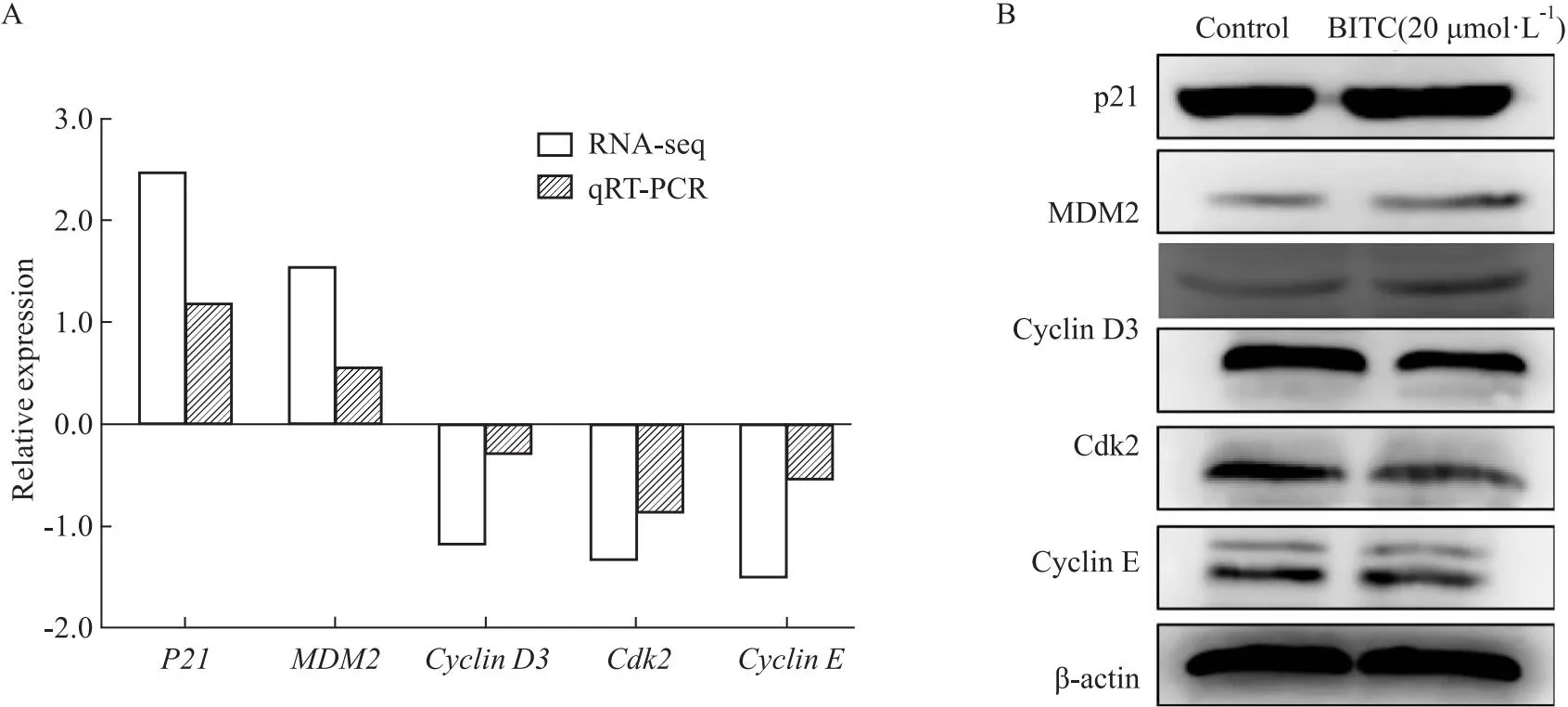
Fig 9 Effect of BITC on expression of p53 and cell cycle related molecules
2.8.3腺苷酸活化蛋白激酶(adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK)-叉头转录因子O亚家族S(forkhead box O,FOXO)通路在BITC诱导的细胞周期阻滞和细胞凋亡中发挥重要作用 AMPK是细胞发育重要的调控因子。FOXO作为AMPK调控的下游转录因子,通过调控靶基因参与细胞死亡、存活以及多种信号转导途径,这些途径对细胞增殖、凋亡、周期阻滞、分化等功能至关重要[8]。KEGG pathway分析表明,在BITC处理6 h 后,U14细胞参与FOXO通路的差异基因有31个(Fig 12),其中有20个基因表达上调,如AMPK基因,生长阻滞与DNA损伤基因(growth arrest and DNA damage inducible alpha,Gaadd45a),生长阻滞和DNA损伤诱导蛋白45 g(growth arrest and DNA damage inducible protein 45g,Gadd45g)基因。11个基因表达下调,如细胞信号转导分子Smad3、p38,细胞周期蛋白B (Cyclin B)基因、细胞周期蛋白依赖性激酶2(cyclin dependent kinase2,CDK2)基因。
我们进一步通过Western blot法检测了FOXO通路相关基因的表达,发现AMPK,FOXO1a蛋白表达上调(Fig 13),推测AMPK-FOXO通路可能参与BITC诱导的细胞周期阻滞和细胞凋亡。
3 讨论
ITCs是十字花科主要的次生代谢产物,定位于细胞质中,是由前体硫苷在体内黑芥子酶作用下水解而来,在植物受损时释放,可阻止多环芳香烃、偶氮染料、亚硝胺等多种致癌物在啮齿类动物中诱发的肿瘤生成。BITC不仅已证实是具有化学预防癌症活性的ITC,且是一种在多种细胞模型中能够降低细胞活性并诱导癌细胞凋亡的药物[9]。然而,尽管该化合物的抗癌活性已在许多癌症中验证,但在宫颈癌中的作用及机制尚未阐明。
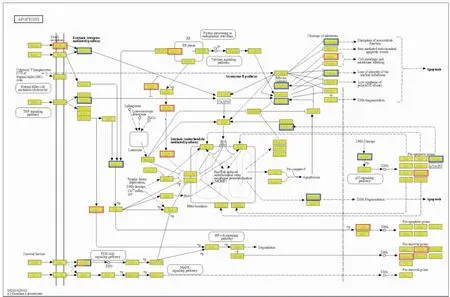
Fig 10 Apoptosis pathway of U14 cells induced by BITC
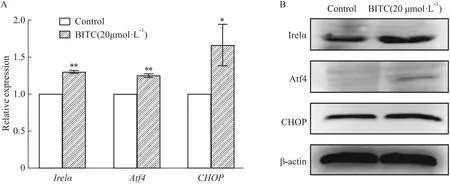
Fig 11 Effect of BITC on expression of endoplasmic reticulum stress related molecules

Fig 12 FOXO1a pathway of BITC on U14 cells

Fig 13 Western blot analysis of expression
**P<0.01vsControl group
本研究发现,BITC呈浓度和时间依赖性地抑制了小鼠宫颈癌U14细胞的增殖,其72 h作用的半致死剂量IC50已达到12.43 μmol·L-1。倒置显微镜观察,随着BITC药物浓度的增加,U14细胞形态发生明显变化,细胞数量急剧下降,表明BITC体外对U14具有较强的细胞毒性。
癌症一大特征是癌细胞失控性增殖,其分子机制往往是细胞周期的紊乱引起癌细胞过度增殖[10]。当DNA发生损伤后,细胞周期会停滞在两个关键的检查点(G1/S和G2/M期),抑癌基因p53主要在G1期检查点起作用。p53可以作为转录因子,诱导下游蛋白(p21、GADD45、Bax)产生,从而调控细胞周期或细胞凋亡[11],这取决于DNA损伤的程度以及细胞类型[12]。Xie等[13]发现,BITC能够增加乳腺癌细胞中的p53磷酸化,而另一研究中相反,p53已被证明是人结肠细胞CCD-18Co中BITC抑制细胞增殖的负调节因子[14]。本研究中,采用PI单染流式分析发现BITC主要将U14细胞阻滞在G0/G1期;转录组数据及qRT-PCR和Western blot分析共同揭示p53信号通路参与细胞周期调控。
诱导癌细胞凋亡是许多抗癌药物抑制癌细胞的主要机制[15]。细胞凋亡时细胞形态皱缩,细胞核染色质发生凝聚,晚凋时细胞核还会发生碎片化,并形成凋亡小体。Hochest 33258染色结果表明,BITC可诱导U14细胞核DNA凝聚,与BITC对卵巢癌OVCAR-3细胞相同的是[16],它们都能观察到细胞核可见的颗粒状荧光,初步推测其为凋亡小体。进一步通过流式细胞术检测细胞凋亡率,分析发现BITC剂量依赖性地增加了细胞凋亡率,表明BITC诱导了细胞凋亡。这与转录组KEGG分析的结果相一致。
外源性死亡受体途径和内源性途径(包含线粒体途径和内质网途径)是细胞发生凋亡的主要途径,这两条途径汇聚最终激活下游凋亡蛋白酶caspase从而引发凋亡。线粒体途径主要受控于Bcl-2家族蛋白,通过促凋亡蛋白(Bax、Bak等)和抗凋亡蛋白(Bcl-2、Bcl-XL等)的相互作用,从而对线粒体膜的通透性产生影响,继而触发凋亡释放因子的释放,由此激活上游凋亡起始子caspase-9,造成下游效应分子caspase-3、7被激活,通过切割相应的底物(lamin、actin、α-tublin、PARP等),最后引发细胞凋亡[17]。Western blot结果分析发现,BITC使促凋亡蛋白 Bax上调,而下调了抗凋亡蛋白Bcl-2表达的水平,引起了线粒体促凋亡信号CytC的释放,将caspase-9激活之后,继而激活了下游效应分子caspase-3。研究发现caspase-3和-7在细胞凋亡中具有重叠但不同的作用,二者具有细胞类型和刺激依赖性[15]。本研究中,BITC没有激活caspase-7,表明caspase-3是BITC主要的线粒体凋亡依赖途径。这一研究结果与另一异硫氰酸酯SFN在抗宫颈癌的作用机制类似[18]。此外,本研究中未检测到经典凋亡通路下游切割底物cleave-PARP的表达,这可能与转录后翻译、调控有关。
细胞在应对内质网错误折叠蛋白和钙离子平衡紊乱时,会通过Ire1、PERK、ATF6通路启动另一内源性凋亡途径[19]。许多中草药及其有效成分通过ERS通路发挥抗宫颈癌作用[20-22]。本研究中,对细胞凋亡通路富集的DEGs分析发现:内质网应激途径Ire1α、ATF4、CHOP基因表达升高。进一步通过qRT-PCR和western blot验证这些分子的表达,与预期结果相一致,提示ERS在BITC诱导的宫颈癌细胞凋亡中扮演者重要的角色。有趣的是SFN预处理经H2O2诱导的软骨细胞,下调了GRP78、CHOP、Bax 和capase-3、Bcl-2水平,减少了ERS依赖性细胞凋亡[23]。BITC是否也在非癌细胞具有相同的保护作用,值得进一步研究。
AMPK是细胞全身能量稳态的中枢能量传感器和调节器[24],一旦激活,AMPK可以促进分解代谢产生ATP,从而帮助细胞逃避死亡并导致耐药性和转移。然而,AMPK也与p53和LKB1等肿瘤抑制基因呈正相关[25],最新的研究证明AMPK的药理激活能够抑制各种癌细胞生长[26-27],但AMPK在癌症中的双重作用机制仍未阐明。FOXO1蛋白家族是一大类转录因子,参与或协同其他转录因子对靶基因进行转录调控,在哺乳动物中主要有四个亚型,其中FOXO1a转录因子被认为是一种肿瘤抑制因子,在抑制癌细胞增殖和诱导细胞凋亡方面发挥作用[28]。有研究表明,二甲双胍通过激活AMPK-FOXO1a信号通路抑制雌激素依赖性的子宫内膜癌细胞生长[29]。用AICAR(5-氨基咪唑-4-甲酰胺1-β-D-呋喃核糖苷)和氨甲蝶呤联合处理乳腺癌MCF-7细胞,发现二者通过激活AMPK和FOXO1a而阻滞MCF-7细胞周期并逆转其Warburg代谢[30]。本研究中,KEGG分析发现FOXO1a通路是DEGs主要富集的通路,进一步通过Western blot 法检测到AMPK及FOXO1a蛋白表达显著增高,表明BITC可能通过调控AMPK-FOXO1a通路来诱导细胞凋亡或阻滞细胞周期,下一步尚需通过细胞模型和动物模型实验验证。
综上,体外和转录组数据分析表明,BITC诱导了U14细胞周期阻滞,通过线粒体途径和内质网途径诱导细胞凋亡,这与p53信号通路、AMPK-FOXO1a通路密切相关。这些研究为BITC预防或治疗宫颈癌提供了新的靶点。
