基于高灰度值注意力机制的脑白质高信号分割
2024-01-21张伯泉麦海鹏陈嘉敏逄锦聚
张伯泉,麦海鹏,陈嘉敏,逄锦聚
(1.广东工业大学计算机学院,广东 广州 510006;2.青岛西海岸新区教育和体育局,山东 青岛 266427)
0 引 言
脑小血管病(Cerebral Small Vessel Disease,CSVD)是老年人常见的一种脑血管疾病,通常由脑内小动脉、毛细血管以及小静脉血管壁等损伤引起。其临床表现包括急性缺血性卒中症状、轻度认知功能障碍及痴呆、步态异常、情绪或行为异常和运动障碍等[1]。脑小血管病的致残率高,康复难,因其发病隐匿,易被病人及医师忽略,严重危害中老年人的健康,为家庭、社会带来沉重负担。
脑白质高信号(White Matter Hyperintensity,WMH),亦称为脑白质疏松(Leukoaraiosis,LA),由加拿大神经病学专家Hachinski 等人[2]于1987 年提出,是脑小血管病的常见影像标记物之一[3]。脑白质高信号在核磁共振成像T2 加权像(T2 Weighted Image,T2WI)或者液体衰减反转恢复序列图像中通常表现为脑白质部位的高信号影。根据病变部位,脑白质高信号分为侧脑室旁白质高信号(Periventricular White Matter Hyperintensity,PWMH)和深部白质高信号(Deep White Matter Hyperintensity,DWMH)这2 大类[4]。侧脑室旁白质高信号紧贴在脑室周围,信号分布均匀,具体形态包括“帽状征”“线缘征”“浓晕征”以及“淡晕征”等4 种。深部白质高信号常以斑点状分布在侧脑室四周,不与侧脑室直接接触[5]。
多项研究表明,WMH 体积变化能够反映脑小血管病患者早期认知功能的变化[6-8]。WMH 体积越大,全脑功能或特定区域认知功能越低[9-11]。因此,WMH体积可以作为临床脑小血管疾病诊断及治疗的重要指标。而精准分割脑白质高信号病灶是脑小血管病诊断的基础工作,在主治医师于脑小血管病患者临床诊断的过程中起到重要作用。目前,脑白质高信号病灶往往由极具临床经验的医师进行手工分割,非常耗费时间与精力,也常常存在人为误差。因此,研究高效、精准、自动化的脑白质高信号分割方法成为了临床医学上的迫切需求,具有重要的理论研究意义以及临床应用价值。
现今脑白质高信号分割算法的研究成果可分为机器学习以及深度学习2大类。
在机器学习方法中,Samaille等人[12]提出了一种新的脑白质高信号自动分割算法(White Matter Hyperintensity Automated Segmentation Algorithm,WHASA),该方法增加FLAIR 和T1图像中脑白质高信号区域与周围组织之间的对比度,交替使用非线性扩散滤波模型以及分水岭分割模型,根据受试者自动计算出的阈值和解剖信息分割出脑白质高信号。Dadar 等人[13]的实验表明,随机森林方法相比于大多数线性分类器和非线性分类器,在缺乏FLAIR 扫描信息的情况下,依然可以有效地检测出脑白质高信号病灶区域。Griffanti 等人[14]提出了基于K-近邻算法的脑强度异常分类算法(Brain Intensity Abnormality Classification Algorithm,BIANCA)。该方法相比于其它基于K-近邻算法的分割方法,提供了不同的空间信息加权选项、局部空间强度平均选项、训练点数量以及位置,有效地分割出脑白质高信号病灶区域。针对用于图像分割的马尔可夫随机场(Markov Random Field,MRF)算法的时间和空间复杂性随着表示相邻像素之间的统计依赖关系边的数量增加而急剧增加的问题,Schwarz 等人[15]在不显著影响脑白质高信号病灶区域分割性能的前提下,从完整的MRF 中去除边缘,在纵向序列中对大脑的核磁共振影像(Magnetic Resonance Imaging,MRI)进行建模,有效地降低MRF的参数量以及推理的计算复杂度。
在深度学习方法中,Moeskops 等人[16]的实验表明,基于卷积神经网络的分割方法能够在MRI中将脑组织区域以及脑白质高信号病灶区域进行分离。Li等人[17]提出了一项利用深度全卷积网络和集成模型,利用FLAIR 图像以及T1 核磁共振扫描图像来进行脑白质高信号分割实验,该算法在MICCAI 2017的WMH 分割挑战赛中,Dice 相似系数(Dice Similarity Coefficient,DSC)达到了0.80,获得比赛的第一名。Gong 等人[18]提出了由UNet 分割模型和UNet 分类模型组成的级联UNet 模型(Cascade UNet),并使用组合损失函数对网络进行训练,实现在二维FLAIR图像的室周脑白质高信号和深部脑白质高信号的分割以及区分。Huang 等人[19]提出了一种半监督模型V-Net,提出并使用一种半监督损失函数水平集损失(LSLoss)进行模型训练,用于FLAIR 图像上的脑白质高信号分割。该网络模型在训练过程中不需要手动标记的WMH 标签,DSC 指标达到了0.78。Wang 等人[20]提出了一种两阶段多尺寸FCNs 网络,用于MRI中的脑白质高信号分割,通过集成网络将不同的分割结果融合,提高了脑白质高信号的分割精度。Sundaresan 等人[21]提出了一种集成大脑MRI 图像3 个方向切片的神经网络模型(Triplanar Ensemble UNet),通过结合大脑MRI 的3 个不同方向切片以提高脑白质高信号病灶分割的精准度。赵欣等人[22]提出了一种融合残差、金字塔池化和注意力机制的3D 全卷积深度神经网络模型。该模型采用残差连接避免深层网络的梯度消失;采用金字塔池化聚合更多的上下文信息;采用注意力机制定位感兴趣的目标。Liu等人[23]针对现行存在的脑白质高信号分割算法不能准确区分脑白质高信号病灶区域以及缺血性卒中的病灶区域的问题,提出了一种深度卷积神经网络(Multichannel2DConvolutional Neural Network,M2DCNN),可以准确地分割脑白质高信号病灶区域并将其与缺血性卒中病变区分开。Zhu 等人[24]提出使用较轻量化的2D VB-Net 用于脑白质高信号病灶区域分割,在常规临床诊断上收集的数据集以及公开数据集上均表现出良好的分割效果。Chen等人[25]提出了TransUNet 网络模型,通过将Transformer 结构融入UNet 模型中,在各医学图像分割任务上均取得较好的效果。
目前,现有的脑白质高信号病灶分割研究重心在于让分割网络模型更加精细、高效地分割脑白质高信号病灶区域,更加贴切于临床应用。不少研究为了提高分割精准度,使用更加深层次的网络或提出级联网络模型同时对FLAIR 影像以及T1 加权像进行检测,因网络层数的增加或级联多个UNet 网络,往往会带来极高的模型参数量。且在临床应用上,常通过FLAIR 影像来判断患病程度。为更贴近临床实际应用,本文直接使用FLAIR影像来进行实验。
本文依据脑白质高信号病灶区域在FLAIR 影像中灰度值较高的这一影像学特点,通过将传统阈值分割技术与深度学习中的注意力机制模块结合,提出高灰度值注意力模块(模块1)并将其应用到UNet 网络模型中,通过对灰度值较低的区域进行减弱或过滤,有效提高对图像中高灰度值区域的关注。引入残差混合注意力模块(模块2),其中,在空间维度、通道维度上生成相应的注意力,提高网络模型的特征提取能力;引入残差短路连接结构,解决由网络模型层数加深而造成的梯度消失、模型退化问题。在实验部分中,通过进行仅UNet、UNet+模块1、UNet+模块2 的消融实验,分别验证2 个模块均能提高UNet 神经网络模型对脑白质高信号病灶区域的提取能力。通过与几种常用的医学图像分割网络模型以及Li 等人[17]、Zhu等人[24]所提出的模型进行对比,本文提出的基于高灰度值注意力机制的脑白质高信号分割算法达到了更高的分割精准度,实现了更好的分割效果。
1 本文方法
基于UNet 网络结构,根据脑白质高信号在FLAIR 影像中的特征,提出高灰度值注意力模块,构建一种脑白质高信号分割模型,网络结构如图1 所示。FLAIR 图像进入阈值分割模块,经过最大类间阈值算法(Otsu)和三角阈值分割算法自动计算出合适的分割阈值,生成用于构建高灰度值注意力模块的高灰度值区域掩码。高灰度值注意力模块可以减弱或过滤灰度值较低的区域,使模型更加关注图像特征中灰度值较高的区域。为提升网络的特征提取能力,在UNet的“编码器”中添加残差混合注意力模块。经过对比实验验证,残差混合注意力模块以及高灰度值注意力模块均能提升网络对脑白质高信号分割的准确率。

图1 高灰度值注意力UNet
1.1 UNet网络结构
本文以Ronneberger 等人[26]提出的UNet 模型作为主干网络,在保留UNet整体结构的基础上,添加高灰度值注意力模块、残差混合注意力模块对网络结构进行改进。UNet 具备典型的“编码器—译码器”左右对称结构。编码器由卷积层、最大池化层、ReLU激活函数层构成,对图像进行下采样操作,进行特征提取。译码器由卷积层、反卷积层、ReLU 激活函数层构成,对特征图进行上采样操作,进行特征信息复原。UNet 的每次下采样操作会使得特征的尺寸缩小、通道数翻倍;相反,上采样操作则会使得尺寸增大、通道数减少。UNet 使用了跳跃连接(Skip Connection)将下采样和上采样过程产生的特征图进行融合,即将编码器和译码器的路径相连接,跳跃连接能够帮助网络在解码阶段中更好地恢复图像的细节特征。UNet 网络结构如图2所示。

图2 UNet
1.2 阈值分割
本文首先对图像进行阈值分割操作,通过自动计算合适的阈值来得到图像高灰度值区域掩码。首先,针对样本中存在大量的背景像素点的问题,采用最大类间方差法[27]将背景与脑部组织进行分离。在剔除背景像素点后,选取脑部组织直方图的波峰所对应的灰度级值Tpeak以及图像中灰度级最大值Tmax,通过三角阈值分割法[28-29]找到较大一侧的波谷灰度级值T。取波谷所对应的灰度级值T对图像进行二值阈值分割得到高灰度值区域掩码,如图3所示。
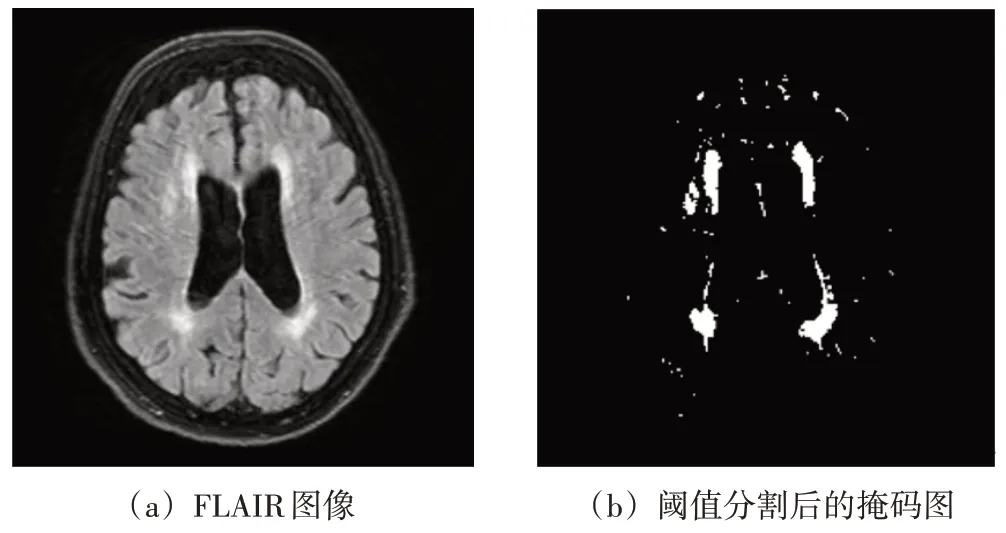
图3 阈值分割
1.2.1 Otsu阈值分割法
设灰度图像尺寸为M×N,图像像素点灰度级范围为[0,L-1],ni为不同灰度级对应的像素点个数,灰度级i出现的概率为Pi=ni/(M×N)。设图像中灰度级T∈[0,t]的像素点为C0类,灰度级T∈[t+1,L-1]的为C1类。
设C0类像素点出现的概率为P0(t),C0类平均灰度级为u0(t);C1类像素点出现的概率为P1(t),C1类平均灰度级为u1(t)。则有:
图像的平均灰度级u可表示为:
设图像的两类间方差为δ2b(t),则有:
当类间方差δ2b(t)为最大时,可获得最佳灰度级值TOtsu:
根据TOtsu对图像进行分割,剔除图像背景后,图像的直方图如图4(b)所示。

图4 直方图及三角阈值分割法示意图
1.2.2 三角阈值分割法
在经过Otsu 算法分离背景后,使用三角阈值分割法寻找倾向高灰度级一侧的波谷灰度级。选取直方图中的波峰灰度级值Tpeak所在的点,对应坐标为(Tpeak,Npeak);图像中灰度级最大值Tmax所在的点,对应坐标为(Tmax,Nmax)。Tpeak、Tmax对应的2 点可构成形式为Ax+By+C=0 的直线l,其中A=Tpeak-Tmax,B=Nmax-Npeak,C=NpeakTmax-NmaxTpeak。
计算脑部组织直方图上每个点到直线l上的距离d。当距离d达到最大时,取对应的灰度级值作为分割阈值T,对图像进行阈值分割得到高灰度值区域掩码M。
1.3 高灰度值注意力机制
在FLAIR影像中,脑白质高信号的灰度值明显高于脑脊液信号等的灰度值,故使用传统阈值分割技术对脑白质高信号区域进行分割具有可行性。但使用传统阈值分割技术存在阈值选取问题。若阈值选取过高会将部分脑白质高信号区域过滤掉,若阈值选取过低会有一部分无关区域信息残留。目前,在脑白质高信号分割应用上,常使用深度学习技术来对脑白质高信号病灶区域进行分割,尚未有实验提出将传统阈值分割方法与深度学习技术结合并应用在脑白质高信号分割上。
鉴于使用传统阈值分割技术能在一定程度上将脑白质高信号分离,本文提出高灰度值注意力机制模块,将传统阈值分割技术与深度学习技术结合。高灰度值注意力机制模块能够对灰度值较低的区域进行减弱或过滤,使网络更加关注图像中灰度值较高的区域,进一步提高分割精准度。高灰度值注意力机制如图5所示。
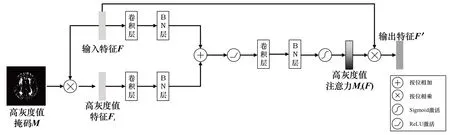
图5 高灰度值注意力机制
图像在经过阈值分割模块后得到高灰度值区域掩码M,将该掩码M与输入特征F进行点乘操作得到高灰度值特征Ft。输入特征F与高灰度值特征Ft同时经过一个卷积层进行特征提取,通过批归一化层以缓解梯度弥散问题并加快模型的收敛速度,两者逐元素相加以融合相同尺度的特征信息,使用ReLU 激活函数进行非线性函数映射以提升模型的非线性表达,增强网络的拟合能力。再次通过卷积层和批归一化层进行降维,使用Sigmoid 激活函数将数据映射到(0,1)区间上,得到高灰度值注意力Mt(F) ∈RH×W×1。最后高灰度值注意力Mt(F)与输入特征F相乘得到输出特征F′∈RH×W×C。
式中,W0、W1、W2代表卷积层—BN层的参数权重。
1.4 残差混合注意力机制
为提高模型特征提取的能力以及解决由于网络层数加深而导致的模型退化问题,在网络模型中添加具有残差混合注意力机制模块。其主要由通道注意力机制模块、空间注意力机制模块以及残差短路连接结构组成。
1.4.1 通道注意力机制
如图6 所示,在通道注意力模块[30](Channel Attention Module,CAM)中,输入特征图F∈RH×W×C首先分别通过最大值池化层(Max Pooling)和平均值池化层(Average Pooling),在通道维度上压缩特征,得到2 个不同的通道描述Fmax,c∈R1×1×C和Favg,c∈R1×1×C。随后将2 个通道描述输入由多层感知机(Multilayer Perceptron,MLP)构成的共享网络来进行降维和升维操作,然后对从共享多层感知机输出的2 个通道描述进行逐元素相加操作,并通过Sigmoid 激活函数处理,得到通道注意力特征图Mc(F) ∈R1×1×C,最后将通道注意力特征图Mc(F)与输入特征F相乘生成通道注意力模块的输出特征F′c。
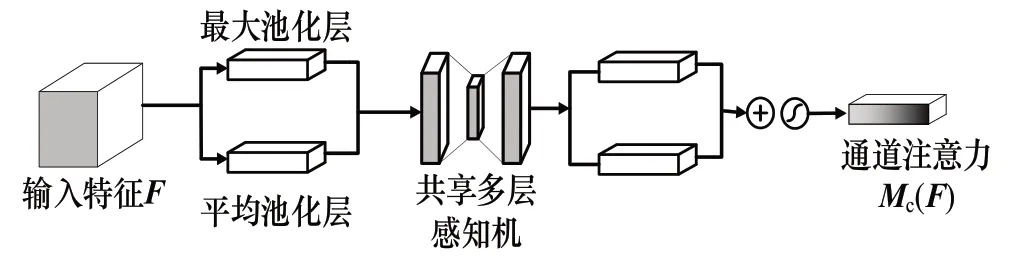
图6 通道注意力
1.4.2 空间注意力机制
如图7 所示,在空间注意力模块[31](Spatial Attention Module,SAM)中,输入特征图F∈RH×W×C分别通过最大值池化层和平均值池化层,在空间维度上压缩特征,得到2 个不同的空间描述Favg,s∈RH×W×1和Fmax,s∈RH×W×1,并对这2 个空间描述进行空间拼接操作。随后对一个7×7的卷积核降维到尺寸H×W×1 为的特征图,并经过Sigmoid 激活函数处理得到空间注意力特征图Ms(F) ∈RH×W×1。最后将空间注意力特征图Ms(F)与输入特征F相乘生成输出特征F′s。
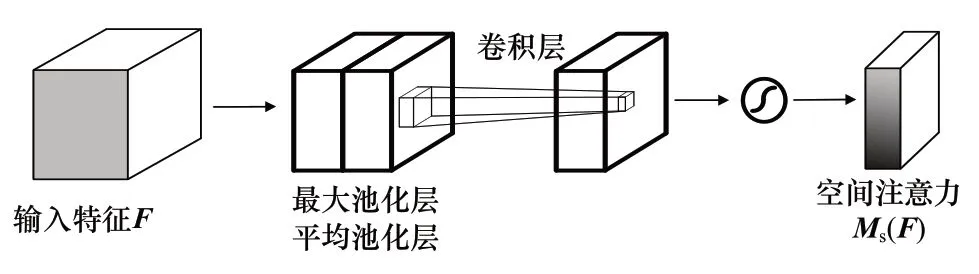
图7 空间注意力
1.4.3 残差短路连接结构
在早期深度学习技术的发展历程中,不少学者通过堆叠神经元或加深神经网络层数的方法来提高网络模型的性能效果。但网络层数增加到一定程度的时候,会发生模型退化、梯度消失或梯度爆炸等现象,模型的性能不仅没有得到提升,反而急剧下降。
He 等人[32]针对这一网络模型退化问题,提出了残差学习网络,通过在网络模型中引入恒等映射,很好地解决了深层次网络由于网络层数增加,在训练中出现的梯度消失或者梯度爆炸等造成的网络退化问题,使得网络模型的深度可以加深至更高层。残差学习网络结构广泛应用于深度学习中的各种神经网络模型。
1.4.4 残差混合注意力模块
如图8 所示,残差混合注意力模块包含残差短路连接结构,以及通道注意力与空间注意力2 个子模块。输入特征F先依次通过通道注意力模块以及空间注意力模块,获取相应的输出特征F′,输入特征F再直接与经过混合注意力模块处理的输出特征F′进行相加处理,生成输出特征F″。在训练过程中低层误差可以通过捷径快速地向上一层进行传递,保证了反向传播过程中参数的更新,充分利用图像上下文信息,提高网络模型的对关键特征的提取能力,避免了由网络加深而造成的梯度消失、模型退化等问题,通过在网络模型结构中添加残差混合注意力模块,有效且充分地利用图像上下文信息,提高网络模型的对关键特征的提取能力,同时也解决了由网络加深而造成的模型退化、梯度消失等问题。

图8 残差混合注意力
2 实 验
2.1 数据集介绍
本文采用医学影像处理和计算机辅助介入会议(International Conference on Medical Image Computing and Computer Assisted Intervention,MICCAI)的脑白质高信号公开数据集进行实验[33]。该数据集来源于3家不同医院的不同扫描仪器,共包含60例患者的头颅MRI 影像。每个病例样本中均包括FLAIR 模态图像、T1WI模态图像、脑白质高信号病灶的金标准分割图。由于数据集由3 台不同仪器采集所得,所以在规格参数上有一定的差异性。数据集详细特征如表1所示。

表1 数据集详细情况
2.2 数据预处理
2.2.1 数据读取及尺寸调整
首先,利用nibabel 库对FLAIR 影像数据进行读取并将格式转换为常用的图像格式,获得患者脑部轴向切片的图像数据。
其次,由于数据集来源于3 台不同的扫描设备,脑部组织区域在图像中的比例有所差异,存在一部分的无关背景像素点。根据不同的比例对来自不同扫描设备的图片数据进行裁剪,以剔除部分无关背景像素点。
最后,因经过裁剪后的图像尺寸不一,需要对图像进行缩放操作,将各切片的图像尺寸大小统一调整为224×224。
2.2.2 数据增强
由于原始数据集的规模较小,不足以训练出很好的网络模型。为提高模型的泛化能力以及更好的分割效果,本文采用翻转、旋转以及弹性形变映射3 种方式进行数据增强。如图9所示。
图9 数据增强
1)翻转:通过镜像翻转图像以增大数据量规模。
2)旋转:通过将图像随机旋转5°到10°以增大数据量规模。
3)弹性形变:调用Albumentations 库中的Elastic Transform 函数来对图像进行弹性形变操作,以增大数据量规模。
2.3 实验细节
本文实验使用Python3.8 进行开发,使用Pytorch框架来进行网络结构搭建,使用NVIDIA GeForce RTX 3070 显卡进行模型训练。具体实验参数:批量大小设置为16,初始学习率为0.001,优化器使用Adam,动量衰减参数为3×10-4,总共训练300 轮。使用交叉验证法验证本文提出的算法。
2.4 评价标准
采用以下5 种训练指标,设G为金标准分割图,P为预测分割图。
2.4.1 DSC相似系数
DSC相似系数是一种集合相似度度量函数,通常用于计算2个样本的相似度,取值范围为[0,1]。
2.4.2 平均容积差AVD
平均容积差(Average Volume Difference,AVD)是指分割结果与金标准间的绝对体积差,即像素点个数的差别。其中,VG为真实标签的像素点总数,VP为预测分割图中像素点总数。
2.4.3 豪斯多夫距离
95% 豪斯多夫距离(95th-percentile of Hausdorff Distance,HD95)用于测量2个对象之间的相似程度,其中距离值越低代表匹配程度越好,即象征着分割效果越好。
同时,为保持整体数值稳定性,剔除一些由离群点造成的不合理距离,选择从小到大排名前95%的距离作为实际豪斯多夫距离。
2.4.4 召回率
召回率(Recall)亦称为敏感度,定义为分割的病灶像素点总数除以真实病灶像素点总数,即正确预测为正样本像素点总数占实际正样本像素点总数的比例。公式中,NG为标签中病灶的像素点总数,NP为预测正确的病灶像素点总数。
2.4.5 F1-score
F1-score 是统计学中用来衡量二分类模型精确度的一种指标,它同时兼顾了分类模型的精确率和召回率。F1-score 可以看作是模型精确率和召回率的一种加权平均。公式中,NP为预测正确的病灶像素点总数,NF为预测错误的病灶像素点总数。
2.5 损失函数
针对本文实验数据集存在的数据不平衡情况,即病变体素数量远低于非病变体素数量,实验使用Tversky Loss[34]作为网络训练过程中的损失函数。在Tversky Loss 公式中,N是总像素点数量;P1i为第i个像素点被预测为阳性样本的概率值;P0i为第i个像素点被预测为阴性样本的概率值;g1i为第i个像素点真实标签为阳性样本的概率值,若第i个像素点真实标签为阳性样本,g1i为1,否则为0;g0i为第i个像素点真实标签为阴性样本的概率值,若第i个像素点真实标签为阴性样本,g0i为1,否则为0。通过调整超参数α和β,控制假阳性和假阴性之间的权衡。在本文实验中,设置超参数α=0.3,β=0.7。
2.6 神经网络模型参数量测试
神经网络模型的参数量主要取决于网络模型的架构、层数等。在卷积层中,参数量主要取决于输入特征通道数量、输出特征通道数量、卷积核的大小等。
为客观对几种基于UNet网络模型进行改造的神经网络模型进行模型参数量测试,在神经网络模型中的4 次下采样阶段中,输入特征数量及输出特征数量分别为[32,64]、[64,128]、[128,256]、[256,512]。
结果如表2 所示,本文提出的算法模型的参数量为8.76M,与UNet 模型的参数量8.63M 对比,仅增加了0.13M。本文提出的算法在不显著增加网络模型参数量的前提下,提高了网络对脑白质高信号病灶区域的分割性能。

表2 模型参数量对比表
2.7 消融实验
本文为验证高灰度值注意力模块1 以及残差混合注意力模块2 均能有效提高网络模型对脑白质高信号病灶区域的分割能力,对神经网络模型进行消融实验。消融实验模型组如下:
1)UNet网络。
2)在UNet 网络模型的基础上,添加高灰度值注意力模块1。
3)在UNet 网络模型的基础上,添加残差混合注意力模块2。
4)在UNet 网络模型的基础上,同时添加高灰度值注意力模块1以及残差混合注意力模块2。
实验结果如表3 所示。由表3 可知,本文提出的模型在各项指标上均优于UNet 网络模型。其中,消融实验模型1 的DSC 指标为0.8023,消融实验模型2和消融实验模型3 的DSC 指标分别达到0.8213、0.8263,而消融实验模型4(本文算法)的DSC 指标为0.8330。这验证了2个模块均能有效提高网络模型对脑白质高信号病灶区域的分割能力。

表3 性能评价指标结果
2.8 实验结果分析与效果展示
表3 为各网络模型在脑白质高信号病灶区域分割任务上的性能评价指标结果。其中,Li 等人[17]使用UNet 网络模型对脑白质高信号区域进行提取,该方法在MICCAI 2017 的WMH 分割挑战赛中获得了第一名,DSC 指标达到了80.23%;Zhu 等人[24]提出的2DVBNet 网络模型,在减少参数量模型的情况下,其AVD 指标达到了18.28%;基于Transformer 结构的TransUNet 模型在HD95 指标上达到了5.47 mm。此外,使用如UNet++[35]、AttentionUNet[36]等几种常用的医学图像分割网络模型进行实验,UNet++的DSC 指标为81.63%、AttentionUNet 的DSC 指标为81.21%、UNet+CBAM 的DSC 指标为81.57%。本文提出的算法在DSC 指标、F1-score 指标以及Recall 指标上均达到了最优值,分别为83.30%、87.40%、88.70%,比Li等人[17]所使用的方法在DSC 指标上提高了3.07 个百分点,体现出本文提出的算法可以更好地识别出脑白质高信号病灶区域,具备更优的分割性能。
图10 为各种算法的分割结果图,从实验结果中可以看出,相较于其他的网络模型,本文提出的算法在脑白质高信号病灶分割任务上表现出更好的分割性能。在图像整体中,本文提出的算法通过高灰度值注意力机制能够更好地关注图像中的高灰度值区域,基本可以识别出全部明显的脑白质高信号病灶区域。此外,在图像细节中,本文提出的算法在病灶边缘上能够处理得较好,比其他网络模型的效果更加精细。因病灶区与非病灶区之间的灰度值相差较大,相比于传统卷积神经网络模型,高灰度值注意力机制为图像中病灶区分配更高的权重,为非病灶区分配极低的权重,通过将病灶区与非病灶区的差异放大,促进网络模型能够更好地区分病灶区与非病灶区的像素点,在细节上更加贴切真实标签,获得更好的分割效果。

图10 不同算法的分割效果图
3 结束语
根据临床诊断采用的FLAIR影像特征,本文提出了一种基于高灰度值注意力机制的脑白质高信号病灶分割方法。首先采用Otsu 阈值分割法以及三角阈值分割法对FLAIR影像进行计算,得出最优的分割阈值,根据最优的分割阈值生成高灰度值区域掩码,构建高灰度值注意力机制模块,使网络模型更加关注图像中灰度值较高的区域,提高网络模型对脑白质高信号病灶区域的分割精度。将残差短路连接结构与双通道注意力机制模块相融合构成残差混合注意力模块,将其引入UNet网络结构中,提高网络模型对关键特征的提取能力。经过消融实验分别验证了2 个模块的有效性,均能提高网络模型对脑白质高信号病灶区域的分割效果。实验结果表明,本文构建的网络模型(High Gray Value Attention UNet,HGVAUNet)优于文献[17]的竞赛中第一名所使用的神经网络模型的效果,DSC 指标达到了83.30%,提高了3.07 个百分点。这说明本文提出的算法具有更好的分割效果,验证了模型的有效性。
由于本文直接采用临床诊断上所用的FLAIR 图像,研究成果可以很好地应用在临床诊断上。另外,本文将传统阈值分割技术引入深度学习的网络模型中,验证了传统图像处理技术能够很好地与深度学习技术结合,针对特定的生物医学图像分割任务具有较好的效果。
下一步将面向临床应用,根据Fazekas 量表对脑白质高信号患者进行分级评价,搭建完整的脑白质高信号诊断软件系统,为医师在临床诊断上提供便利。
