Davinci机器人前入路原位右半肝切除术一例
2024-01-21李骞涂志坚李传富李江涛戴小明陈国栋
李骞,涂志坚,李传富,李江涛,戴小明,陈国栋
南华大学附属第一医院 肝胆胰外科,湖南 衡阳 421001
原发性肝癌作为我国第四位常见的恶性肿瘤,其中以肝细胞癌最为常见。由于早期缺乏特异性症状,大多数患者确诊后已失去根治性手术机会,因此肝癌的总体预后较差[1]。当前提倡以手术为主的肝癌综合治疗方案,近年来转化治疗以及机器人手术系统的快速发展为肝癌的治疗带来新希望。本文回顾性分析南华大学附属第一医院1 例肝右叶原发性肝癌患者的诊疗经过,并对转化治疗、肝切除手术路径选择以及机器人手术系统的应用进行探讨,现报道如下。
病例
患者女性,67岁,身体质量指数(BMI)19.1 kg/m2,因“右上腹疼痛3 d”于2021年8月2日入院。既往有乙肝病史。入院实验室检查:RBC 3.33×1012,Hb 100.00 g/L,AST 109.40 U/L,AFP>2 000.00 ng/L。增强CT示:肝右叶巨大占位,考虑恶性肿瘤性病变可能性大:原发性肝癌伴部分坏死,门静脉右支受累及(图1)。入院诊断为“肝右叶原发性肝癌(Ⅲa期)”。
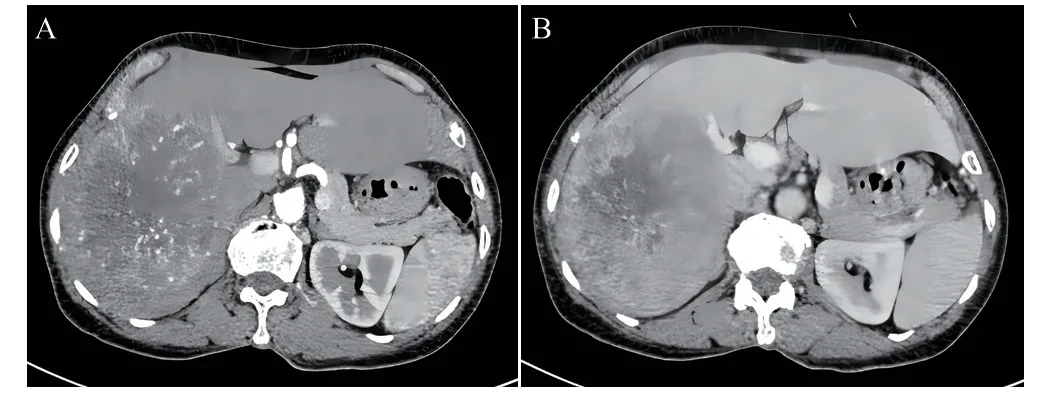
图1 患者入院CT检查
第一次MDT讨论:患者肝右叶肝癌合并门静脉右支受累,相关检查符合肝细胞癌表现,左半肝残余肝体积仅为33%,结合患者情况制定肝动脉化疗栓塞(TACE)联合靶向治疗方案。于2021年8月9日在局部麻醉下以顺铂、表柔比星、碘化油行TACE治疗,术后2 周复查肝功能基本正常后,开始规律口服仑伐替尼靶向治疗,治疗期间无不良反应。2个月后复查RBC 2.71×1012/L,Hb 89.00 g/L,AFP>1 210.00 ng/L。CT示肝右叶占位TACE治疗后改变,肿块较前缩小,肿块边缘强化灶,提示仍然存在活性(图2)。3D-CT测定左半肝残余肝体积为46.2%(图3),吲哚菁绿清除实验ICG 15 min滞留率(ICG R15)6.2%。
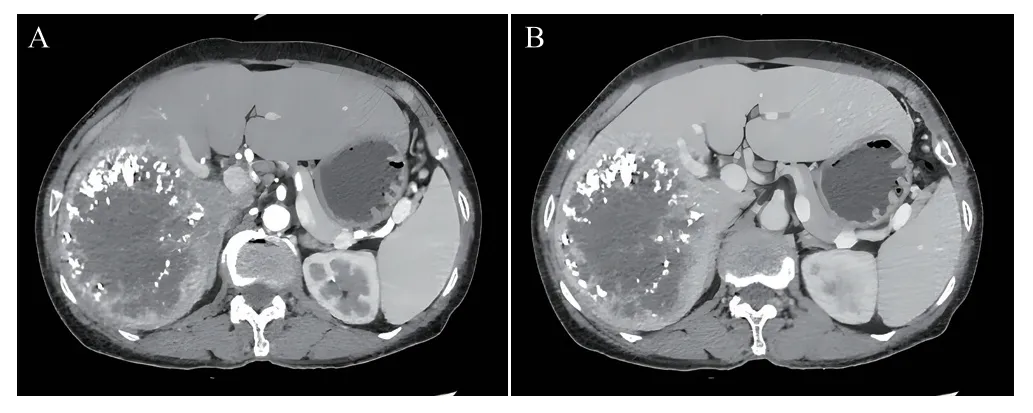
图2 患者TACE治疗后2个月复查CT

图3 患者术后3 d复查CT
第二次MDT讨论:(1)患者经TACE联合仑伐替尼靶向治疗后,肿瘤较前缩小,与门静脉右支存在间隙,肿瘤边缘仍存在活性;(2)AFP水平较前下降,但仍处于高水平,不排除肿瘤继续进展可能;(3)肝功能Child-Pugh A级,结合3D-CT(图4)及ICG R15实验,残余肝脏足以代偿,决定行根治性手术切除。
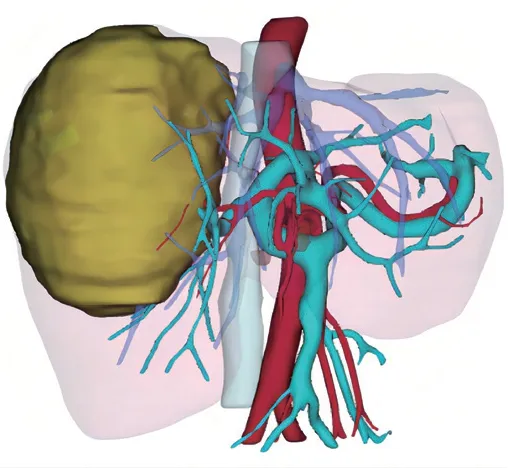
图4 术前CT三维重建(左半肝残余肝体积为46.2%)
遂于2021年10月27日在全麻下行Davinci机器人前入路原位右半肝切除术。Trocar布局如图5。离断肝圆韧带及镰状韧带后,解剖第二肝门,显露肝中静脉根部,切除胆囊,预置肝门阻断带,先鞘外解剖第一肝门并离断右肝肝蒂,根据肝脏表面缺血线标记预切线,用手套圈弹性悬吊肝圆韧带,向患者左侧牵拉肝脏,将预切线拉至视野正中。以超声刀小口破碎肝组织,显露出肝中静脉,以肝中静脉为引导逐步断肝直至下腔静脉前方,离断下腔静脉右侧肝短静脉,从足侧往头侧逐步推进至右肝静脉根部,闭合器离断右肝静脉,完成肝脏的离断。最后游离肝周韧带,原位完成右半肝切除(图6)。重建镰状韧带固定肝脏后放置引流管。离断肝脏过程中采用Pringle法阻断入肝血流(阻断15 min,开放5 min),共阻断4次。
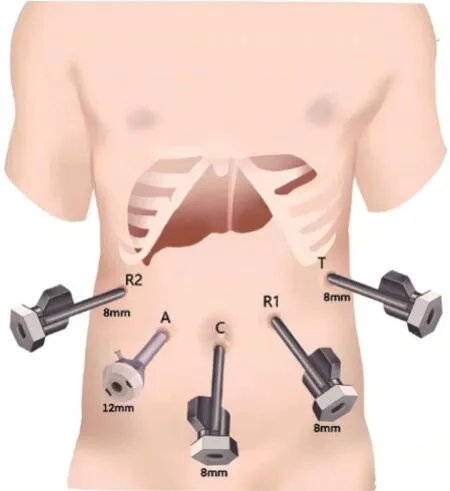
图5 术中Trocar布局示意图

图6 患者行根治性手术术中图示
手术时间230 min,术中出血约250 mL。手术标本及病理报告见图7:(右肝)低分化肝细胞癌(肿物11.1 cm×10.5 cm×9.2 cm),侵及被膜,微血管内见癌栓,伴出血坏死,肝切缘及距肿物1.0 cm无癌残留及浸润,胆囊无癌浸润。术后1个月复查AFP 390.80 ng/L,CEA 2.87 ng/L。CT示:肝右叶及胆囊切除术后改变,术区积液基本吸收(图8)。患者术后恢复顺利,术后1 d开始下床,术后2 d流质饮食,术后3 d排气,术后4 d排便,无并发症发生,并于术后1周出院。

图7 患者手术切除标本及病理检查
讨论
(1)转化治疗的发展现状与方案选择
尽管目前肝癌提倡以手术为主的综合治疗,但根治性手术切除仍是肝癌的唯一治愈手段。为提高肝癌的切除率,术前的转化治疗应运而生,即将外科学或生物学/肿瘤学上不可切除的肝癌,包括肿瘤较大、残余肝脏体积不足或肿瘤负荷较重等因素,转化为可切除的肝癌[2]。本例患者肿瘤体积较大,且压迫下腔静脉,引起整个肝脏血液回流受阻,同时侵犯门静脉右支可能。如直接行手术切除,可能无法保证R0切缘,且术中出血风险较高,术后因左半肝体积不足发生肝衰的可能性较大。TACE作为目前最为常见的局部治疗方案,其疗效确切,我院开展TACE多年,技术相对成熟,结合患者经济状况,经MDT讨论,最终采用TACE联合靶向治疗。仑伐替尼在疗效不劣于索拉非尼的前提下,其副作用较小,更易于被患者所接受,近期一项Ⅲ期LAUNCH研究显示,TACE联合仑伐替尼可改善患者预后,是晚期HCC患者的潜在一线治疗方案[3]。经治疗后复查可见肿瘤体积较前缩小,左半肝较前增大,肿瘤边缘与门静脉右支之间存在一定间隙,术前的转化治疗显著提升R0切除率、术中及术后的安全性。传统的转化治疗主要针对局部病灶,包括手术治疗、介入治疗、消融治疗及放疗。相对于传统的转化治疗,系统治疗创伤更小,从细胞及分子层面上抑制肝癌的进展,针对肝癌肿瘤细胞高度侵袭性及转移潜能的生物学特性进行打击,部分靶向药物和免疫药物已被《原发性肝癌诊疗指南(2022年版)》纳入为一二线治疗方案[4]。尽管转化治疗中可供选择的方案较多,但目前并无统一的标准方案,有研究表明相较于单一的转化治疗,局部治疗联合靶免治疗转化成功率更高[5-6]。因此,目前提倡结合患者情况及医疗水平,制定个体化的多联转化治疗方案。
(2)前入路肝切除术的优势与不足
肝癌术后的复发率35%~69%不等,因此手术切除并不是肝癌治疗的终点,如何降低术后复发率是目前肝癌治疗亟需解决的一大关键问题。但由于肝脏丰富的血运以及肝癌对血管的侵犯,肿瘤细胞通过分泌基质金属蛋白酶破坏基底膜,进入外周血循环,形成循环肿瘤细胞(circulating tumor cells,CTCs),CTCs在术后肿瘤复发过程中起到重要作用[7]。除了肿瘤细胞的自发脱落,不当的诊疗操作无疑也会增加CTCs形成的风险。为减少CTCs形成的可能性,肝切除术中应严格遵循“无瘤术”原则并减少搬动及挤压肝脏,基于此目的,1996 年香港学者首次报道并命名前入路肝切除术[8],该术式强调先离断肝实质,再游离肝脏周围韧带,不仅能降低术中肿瘤破裂的可能性,还能避免因第一肝门扭转压迫下腔静脉所造成的缺血再灌注损伤。国内外几项随机临床研究显示,相较于传统肝切除术,因原发性肝癌或结直肠癌肝转移行前入路肝切除术后,患者具有更好的围手术期结局,且原发性肝癌术后复发率显著降低[9-10]。与此同时,前入路肝切除对术者也提出了新的挑战,原位切除深部肝组织时,狭小的操作空间以及有限的视野暴露,在一定程度上增大了术中出血的风险与止血的难度,但得益于其在巨大肿瘤、尤其是右半肝肿瘤切除中的优势,该术式在各大中心得到广泛应用。
(3)机器人系统应用于前入路肝切除术的优势与展望
随着微创外科的发展,目前微创肝切除术已成为主流,它不仅疗效和传统手术相当,还能改善围手术期结局,减轻患者痛苦;但微创肝切除术同时也提升了对术者的要求。右半肝体积大且位置深,腹腔镜二维的视野、操作过程中轻微的抖动、有限的操作角度以及“筷子效应”等,使得腹腔镜前入路右半肝切除术显得更加困难,出血风险明显升高。机器人系统的出现为前入路肝切除术提供了新的选择,相较于腹腔镜,机器人3D放大的高清视野所带来的纵深感,更利于术者在离断深处血管时对距离的把控。稳定的手术视野、7个自由度的操作臂以及对细微抖动的滤过更适于有限空间内的精细操作,显著降低了手术难度。术者自行操作腹腔镜的模式也降低了术者与助手配合程度的要求,即使出现出血,术者也能根据个人习惯快速进行显露并完成缝合,大大缩短了操作时间,也减少了中转开腹的几率。与腹腔镜手术相比,机器人前入路肝切除术学习曲线更短[11],在遵循原位切除的原则上,不仅能获得微创手术所带来的围手术期收益,还降低了手术难度,更容易被患者及医师所接受,也更符合精细化与微创化的外科趋势。但与此同时,机器人系统高昂的运行费用也给患者带来沉重的经济负担,在很大程度上制约了机器人系统的全面推广;机器人系统同样未解决缺乏触觉反馈的缺陷,在牵拉肝脏及打结时术者仅能靠视觉来选择合适的力度[12],增加了操作的难度和出血的风险。但相信随着国产机器人的研发以及操作系统的迭代,这些缺点终将被克服。
综上,机器人前入路原位右半肝切除术安全有效,遵循精细化与微创化的外科理念,改善了患者预后,大大提升了该术式的应用价值。
