基于增强CT影像组学与机器学习算法预测肿块型肝内胆管癌微血管侵犯
2024-01-21吕昊阳洪重黄侠鸣俞富祥
吕昊阳,洪重,黄侠鸣,俞富祥
1.温州医科大学附属第一医院 肝胆胰外科,浙江 温州 325000;2.温州医科大学附属第二医院 肝胆胰外科,浙江 温州 325027
肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)作为一种较为常见的肝脏恶性肿瘤,约占肝脏恶性肿瘤的20%,占胃肠道恶性肿瘤的3%[1-2],其中肿块型的ICC是最主要的形态类型,占所有ICC病例的80%~90%[3-4]。据统计ICC患者5年总生存率低于10%[5],并且近年ICC的发病率与病死率普遍呈上升趋势[6-7]。微血管侵犯(microvascular invasion,MVI)是ICC患者的独立预后危险因素[8],对于MVI高风险的患者建议行宽切缘的肝切除术以改善预后[9],并且MVI会增加肝移植后的复发率,是行肝移植治疗的相对禁忌证[2,10]。
影像组学以及机器学习算法已经被证实在肿块型ICC的MVI预测中具有重要价值[11],但增强影像的时期选择以及多种机器学习间比较等关键问题仍不明确,影像组学特诊与临床特征的结合研究也尚欠缺。因此,我们提取并筛选了ICC患者术前增强CT的多时相影像组学特征,采用多种常见的机器学习算法来构建模型并进行比较,然后将最佳的影像组学机器学习预测方法与临床资料结合,建立一种基于机器学习的肿块型ICC术前MVI状态预测模型,并且以列线图的形式展示。
1 资料和方法
1.1 一般资料
回顾性收集2015 年1 月至2023 年2 月期间就诊于温州医科大学附属第一医院(75例)和温州医科大学附属第二医院(29例)的ICC患者的临床资料。根据《赫尔辛基宣言》的原则获得温州医科大学附属第一医院伦理委员会的批准,免于患者知情同意(批号:KY2023-R127),并在进行研究之前匿名处理数据。最终筛选出104例肿块型ICC患者作为研究对象,其中微血管侵犯阳性35例(MVI阳性组),微血管侵犯阴性69例(MVI阴性组)。
1.2 病例纳入与排除标准
纳入标准:(1)行肝切除术,术后病理学诊断为肿块型ICC,并且有描述微血管侵犯情况;(2)术前1 个月内做过上腹部增强CT 检查,CT 图像清晰,无伪影。排除标准:(1)术前行针对ICC治疗,包括肝切除术,经动脉化疗栓塞(transarterial chemoembolization,TACE),免疫治疗,放射治疗;(2)诊断ICC为肝内多发,或者伴发有其他恶性肿瘤;(3)临床资料不完整。
1.3 临床指标
临床指标包括:患者年龄,高血压史,糖尿病史,乙肝病史,肿瘤位置,肿瘤最大径,远端胆管是否扩张,增强CT有无瘤周强化,增强CT有无瘤内动脉,白细胞计数,中性粒细胞数绝对值,红细胞计数,部分活化凝血酶原时间,纤维蛋白原,直接胆红素,间接胆红素,总蛋白,白蛋白,丙氨酸氨基转移酶,天冬氨酸氨基转移酶,碱性磷酸酶,γ-谷氨酰基转移酶,甲胎蛋白(AFP),癌胚抗原(CEA),糖类抗原CA199。其中实验室检查选择术前10 d内的最后一次结果。所有临床资料根据正常值范围或临床分析重编码为二分类变量。
1.4 影像组学特征收集
本研究采用CT扫描仪包括GE BrightSpeed 16;东芝Aquilion ONE和飞利浦Brilliance 16,管电压100~120 kV,管电流200~500 mA,旋转时间0.5 s,图像矩阵为512×512,采用非离子型碘比剂经肘静脉留置针注入,剂量1.5 mL/kg,注射流率3 mL/h,注射后30 s与60 s分别进行动脉期与门脉期扫描。所有CT影像以DICOM格式导出并使用RIAS 0.2.1 软件进行预处理,包括重采样为0.7 mm×0.7 mm×5.0 mm,固定窗宽200,窗位50,以及图像Z值标准化。
由1 名具有相关资质的研究员在病理结果和临床资料均不知情的前提下,使用3D slicer5.2.2软件独立勾画每一层图像的ICC病灶区域,并自动生成三维容积感兴趣区,以nrrd格式导出。感兴趣区域勾画时尽可能沿肿瘤边缘进行,避开肿瘤坏死或钙化区域及周围大血管。然后使用Python的Pyradiomics3.0.1包进行特征提取[12],动脉期与门脉期各提取到原始与变换处理后图像的1 409个特征。为了评估感兴趣区域的一致性,在完成第1次勾画3周后,从数据中随机抽取15 例,再次进行勾画,使用组内相关系数(intra-class correlation coefficients)来评估特征提取的一致性,去除了其中相关系数低于0.8的特征。
1.5 影像组学特征筛选与模型比较
将提取到的影像组学特征使用MinMaxScaler法进行归一化,并用U检验去除差异不显著的特征。然后将动脉期,门脉期以及动脉-门脉期联合的3 组特征分别用最大相关最小冗余算法(maxrelevance and min-redundancy,mRMR)进行筛选,选择前10项特征用于建立模型。将3组影像组学特征分别使用极度梯度提升(XGBoost)、轻量级梯度提升(LightGBM)、随机森林(randomforest)、自适应增强(AdaBoost)、高斯朴素贝叶斯(GNB)、朴素贝叶斯(CNB)、神经网络(MLP)、支持向量机分类(SVM)及近邻分类(KNN)9种机器学习分类算法,建立共27 种机器学习预测模型。为了更好地比较这27种预测模型,增加可信性,本研究并未将患者分为训练组和验证组,而是选择采用五折交叉法进行验证。绘制了受试者操作特征(receive operating characteristic,ROC)曲线并计算工作曲线下面积(area under the curve,AUC)以进行比较,选择出其中预测能力最强的模型(图1)。

图1 影像组学机器学习预测模型的建立及比较流程
1.6 影像组学-临床预测模型的建立及检验
将所有104例患者按7∶3分为训练组(n=73)与验证组(n=31)。对训练组患者的影像组学特征,使用最佳机器学习算法建立预测模型,计算出所有患者的影像组学预测值。从临床特征中筛选出具有显著差异的特征,并使用最小绝对收缩和选择算法(least absolute shrinkage and selec-tion operator,LASSO)回归进一步筛选,用得到的临床特征与影像组学机器学习预测值使用逻辑回归建立预测模型,并绘制成列线图以直观展示。用验证组对预测模型进行验证,绘制ROC曲线并计算AUC。作为对比,使用临床特征建立临床预测模型,使用影像组学机器学习预测值建立影像组学预测模型(图2)。

图2 影像组学-临床预测模型的建立及检验流程
1.7 统计学分析
单因素分析使用Python的statsmodels0.11.1包,其中影像组学特征按P<0.05 标准行U检验,临床特征按P<0.1 行χ2检验。mRMR算法及机器学习预测模型使用了Python的xgboost1.2.1包,lightgbm3.2.1包和sklearn0.22.1 包。LASSO回归特征筛选和逻辑回归预测模型使用了R语言的glmnet4.1.2 包和logreg6.2.0包。P<0.05为差异具有统计学意义。
2 结果
2.1 影像组学预测模型比较
构建并交叉验证的27 个影像组学-机器学习预测模型中(图3),经DeLong检验,预测模型间的差异没有统计学意义,其中门脉期的CNB 算法五折交叉验证的平均AUC为0.818(表1),表现相对最佳。筛选出的门脉期特征包括了1 个一阶统计特征“logsigma30mm3D_firstorder_Maximum”和9 个灰度纹理特征“waveletHHH_ngtdm_Contrast”“waveletHHL_glszm_SmallAre aLowGrayLevelEmphasis”“waveletHHL_glszm_SmallAreaEmphasis”“waveletHLL_glszm_Size ZoneNonUniformity”“waveletHLL_glszm_Low GrayLevelZoneEmphasis”“waveletLHH_glszm_ZonePercentage”“waveletLHH_glszm_LowGray LevelZoneEmphasis”“waveletLHL_glszm_GrayL evelNonUniformity”“logsigma30mm3D_glszm_LowGrayLevelZoneEmphasis”。见图4。
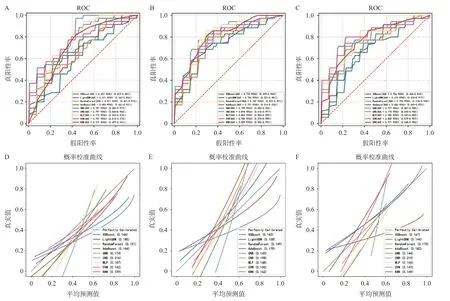
图3 影像组学-机器学习预测模型ROC曲线和校准曲线
2.2 影像组学-临床联合模型的建立及验证
MVI阳性组与阴性组间有8 项临床特征差异有统计学意义(表2),包括年龄>60岁,乙肝,瘤内动脉穿行,CEA>5 ng/mL,白蛋白<40 g/L,中性粒细胞>6.3×109/L,白细胞>9.5×109/L,经LASSO回归进一步筛选出CEA(OR=4.613)、瘤内动脉穿行(OR=3.553)2个特征(图4)。最终得到的影像组学-临床联合模型的训练组AUC为0.881,灵敏度为0.978,特异度为0.656,F1 分数为0.716;验证组AUC为0.891,灵敏度为0.909,特异度为0.700,F1分数为0.707,显示该模型具有良好的预测效果(表3)。临床模型的训练组AUC为0.783,验证组AUC为0.841,影像组学模型的训练组AUC为0.842,验证组AUC为0.823。影像组学-临床联合模型的预测能力优于临床模型和影像组学模型,而影像组学模型的预测能力与临床模型相近,联合模型与临床模型的训练组AUC稍低于验证组,我们考虑为研究样本量较少而产生的偏差。DCA决策曲线显示,预测模型在较大的阈值范围内可以获得净收益(0~0.6)(图5)。

表2 MVI阳性组与MVI阴性组患者临床特征比较[例(%)]

表3 影像组学-临床预测模型的准确性

图5 训练组、验证组三种模型(临床模型、影像组学模型、影像组学-临床模型)预测能力对比及影像组学-临床模型列线图
3 讨论
目前外科手术仍是唯一可能治愈ICC的方法,但手术后的5年生存率也仅有20%~30%[2,7,13]。而MVI状态在是否扩大手术切缘,肝移植指征,术后辅助化疗及预后方面有重要的临床意义[9,14-15],如果能在术前预测出MVI状态,将对ICC患者的诊疗提供重要指导。影像组学作为传统影像学的拓展,其重点关注于影像的微观特征,展现出了较高的临床价值。Xiang等[16]采用支持向量机算法构建CT影像组学特征,并结合临床数据开发了ICC的MVI预测模型,训练组和验证组AUC分别为0.886 和0.800。Zhou等[17]基于动态增强MRI图像开发了ICC的MVI影像组学预测模型,在训练组和验证组中AUC分别为0.873和0.850。本研究中,我们将增强CT影像组学机器学习的预测值与临床结合得到的预测模型训练组AUC为0.881,验证组AUC为0.891,显示出了较为优良的预测能力,临床医师在进行决策时可以参考该预测模型的预测结果,从而制定出更适合患者的治疗方案。
影像组学与机器学习算法的结合可以更好的发掘出影像中包含的信息,而且分类算法的选择是预测模型的重要影响因素之一[18],因此本研究采用了9 种常用的机器学习算法来处理影像组学特征,并且在比较后选择了CNB算法来计算影像组学机器学习的预测值。预测值和临床资料的联合模型则是采用了逻辑回归算法,从而保证了模型的临床解释性,并绘制出一个列线图来直观展示,让该模型可以在临床中便于使用。
在不同的影像组学研究中,对增强影像的时相选择也不尽相同[16,18-19],而在本研究中,门脉期模型的预测能力优于动脉期模型以及动脉期-静脉期联合模型。在筛选出的10个门脉期影像组学特征中,1个一阶统计特征(first order)表示最大灰度级强度,剩下9个灰度纹理特征中,1个灰度色调差异矩阵特征(ngtdm)表示体素及其邻域之间灰度变化的大小,8 个灰度大小区域矩阵特征(glszm)量化了图像中的灰度级区域,即具有相同灰度级强度的连接体素数量。这10个特征有9个来自于小波变换(Wavelet,binwindth=10),小波变换是空间(时间)频率的局部化分析,能充分突出某方面细节特征,可能与低水平放射组学特征临床检查无法发现的病理生理学、蛋白质组学和肿瘤形态学特点存在潜在关联[20]。既往有多项研究表明纹理特征和小波特征可以反映更多关于肿瘤异质性的信息,影像组学特征筛选的结果,也以纹理特征或小波纹理特征为主[16,21-22],这与本研究结果相一致。
本研究中,瘤内动脉穿行被定义为肉眼可见的动脉期瘤内血管增强,104例患者中有38例被评估为瘤内动脉穿行。经检验,瘤内动脉穿行是ICC患者发生MVI的独立危险因素(OR=3.553),被用于预测模型的建立,这也与既往的一些研究相吻合[23]。我们进一步分析发现,瘤内动脉穿行和肿瘤大小具有相关性(P<0.001),而肿瘤大小在大量研究中被证实与MVI有关[15,17,24],本研究中MVI阳性与阴性组间的肿瘤大小特征差异也具有统计学意义(P=0.012)。因此我们认为,瘤内动脉穿行与肿瘤大小是两个具有相关性的MVI危险因素,而瘤内动脉穿行或许具有更好的预测价值。CEA是一种具有人类胚胎抗原特性的酸性糖蛋白,和CA199 一起被推荐为ICC早期检测和诊断的标志物,并且与ICC的严重程度和疾病预后相关[3,25]。本研究中,我们发现CEA>5 ng/mL是MVI的独立危险因素(P<0.001),将其作为预测模型的一个特征。但在不同的研究中CEA升高的阈值并不一致[26],因此需要更大样本量的研究来确定适合用于MVI预测的阈值。
综上所述,增强CT的影像组学特征和临床特征结合可以在术前较好的预测ICC患者的MVI状态,我们建立的基于机器学习的预测模型也表现出良好的预测能力,可为ICC的临床诊治提供帮助。同时,受限于样本量不足,仍有些问题难以明确,期待能有进一步研究。
