m6A识别蛋白YTHDF1对杜氏肌营养不良症的改善作用及其机制
2024-01-21郑妍妍王燕李蓓
郑妍妍,王燕,李蓓
西安市儿童医院神经内科,陕西西安 710002
杜氏肌营养不良症(Duchenne muscular dystrophy,DMD)是一种X染色体连锁的隐性遗传病,由编码抗肌萎缩蛋白(dystrophin)的基因突变所致。分裂的成肌细胞是肌肉生长和维持所必需的,而成肌细胞的有限生长能力与DMD的进行性肌肉退化特征直接相关[1-2]。据统计显示,全球新生男婴DMD 患病率为1/3500[3],而目前临床尚无有效疗法。因此,研究DMD发生和发展的机制对实现该病的早期诊断、干预具有重要的临床意义。DMD基因位于染色体Xp21,编码含有3685个氨基酸的dystrophin(427 kD)。肌细胞膜表面存在抗肌萎缩-糖蛋白复合物(dystrophin-associated protein complex,DAPC),可维持细胞结构的完整性和细胞膜内外的传递运输功能,而dystrophin 是DAPC 的重要组成部分[4]。N6-甲基腺苷(m6A)修饰是真核生物RNA 中最广泛的内部修饰,参与多个生物学过程。不同的阅读蛋白(包括YTHDF、YTHDC 和IGFBP 等家族蛋白)可特异性识别m6A 修饰,并调节RNA 的稳定性[5]。研究发现,m6A 修饰在肌肉干细胞维持、肌细胞增殖和分化中发挥重要作用[6]。Yes1 相关转录调节因子(Yes1 associated transcriptional regulator,YAP1)是一种转录辅助因子,可促进细胞增殖以及调节器官发育和再生,最近研究发现,在DMD 心脏组织中YAP1 活性明显降低;而抑制YAP1 活性可明显降低DMD 多能干细胞衍生的心肌细胞增殖,诱导DMD心肌病的发生[7],但YAP1 是否通过调节m6A 修饰水平调控肌细胞增殖尚不明确。本研究通过检测DMD患者和健康人群肌肉组织中YTHDF1 和dystrophin 的表达水平,观察过表达或干扰YTHDF1 对人骨骼肌成肌细胞增殖的影响,探究YTHDF1对DMD中成肌细胞生物学行为的影响及其潜在作用机制。
1 材料与方法
1.1 主要试剂及仪器 胎牛血清(fetal bovine serum,FBS)、Ham's F-10 培养基购自美国Gibco 公司;Lipofectamine 3000 转染试剂、DMEM 培养基、青霉素、链霉素、庆大霉素购自美国Invitrogen 公司;人表皮生长因子(human epidermal growth factor,hEGF)、地塞米松、L-谷氨酰胺、胰蛋白酶-EDTA 溶液购自美国Sigma 公司;YTHDF1 过表达质粒AAV-YTHDF1及YTHDF1 小干扰RNA(si-YTHDF1) 购自美国Addgene 公司;PrimeScript RT-PCR 试剂盒购自日本TaKaRa 公司;BCA 蛋白含量测定试剂盒、EdU 试剂盒购自美国Thermo Scientific 公司;磷酸肌酸激酶(creative phospho kinase,CPK) ELISA试剂盒购自上海科顺生物科技有限公司;anti-YTHDF1 抗体、antidystrophin 抗体、anti-YAP1 抗体、anti-肌细胞生成素(myogenin,MyoG)抗体、anti-肌球蛋白重链(myosin heavy chain,MHC)抗体、anti-m6A 抗体购自英国Abcam公司;Magna RIP RNA 结合蛋白免疫沉淀试剂盒、Magna甲基化RNA免疫沉淀(MeRIP) m6A试剂盒购自美国Millipore 公司;放线菌素D 购自武汉艾美捷科技有限公司。实时荧光定量PCR 仪购自德国Eppendorf 公司;Thermo Varioskan™ LUX 多功能酶标仪、NanoDrop 2000 分光光度仪购自美国Thermo Fisher Scientific 公司;Western blotting 转膜仪购自北京凯元信瑞仪器有限公司;蛋白电泳仪及配套电泳槽购自美国Bio-Rad 公司;凝胶成像仪购自英国Uvitec Cambridge 公司;倒置普通光学显微镜购自日本Olympus公司。
1.2 标本收集 收集2016 年9 月-2017 年6 月于西安市儿童医院确诊并进行手术的38 例DMD 患者(设为DMD 组)和33 例接受骨科手术且与DMD 患者年龄匹配(2~3 岁)的患者(未患有其他干扰性疾病,设为对照组)的肌肉组织和血液样本(入院时采集,于-80 ℃超低温冰箱保存备用)。纳入标准:(1)经病理和(或)基因检测确诊为DMD;(2)年龄<18 岁。排除标准:(1)不能配合完成检查;(2)病理及影像资料不完整;(3)存在MRI检查禁忌证。本研究经西安市儿童医院伦理委员会批准(20160918-1F),所有受试者或监护人均签署知情同意书。
1.2.1 RT-qPCR 检 测YTHDF1mRNA 水 平 使 用Trizol 试剂提取肌肉组织总RNA,并用Prime Script RT 试剂盒反转录成cDNA。使用SYBR Premix Ex TaqⅡ在ABI 7500 实时PCR 系统中进行实时定量反转录PCR。PCR反应体系(20 μl):cDNA 2 μl、Taq聚合酶0.4 μl、上下游引物各0.8 μl、ddH2O 6 μl、2×SYBR绿色PCR 混合液10 μl。PCR 反应条件:95 ℃ 1 min;95 ℃ 20 s、56 ℃ 10 s、72 ℃ 15 s,35 个 循 环。以GAPDH为内参照,采用2-ΔΔCt法计算YTHDF1mRNA相对表达水平。引物序列如表1所示。
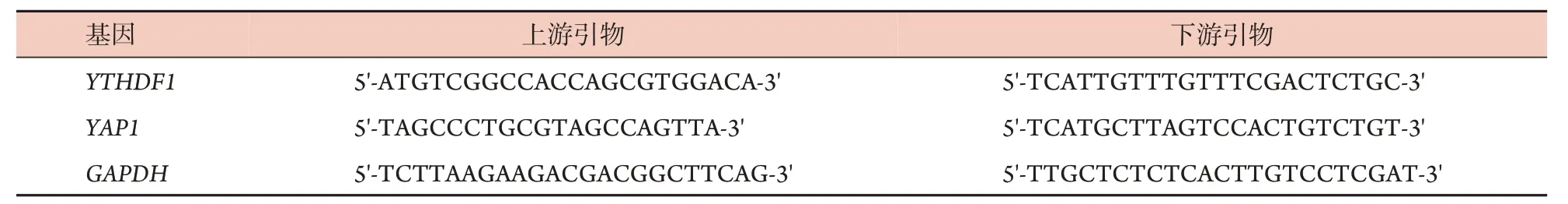
表1 RT-qPCR引物序列Tab.1 Primer sequences of RT-qPCR
1.2.2 Western blotting检测YTHDF1、dystrophin蛋白表达水平 提取肌肉组织总蛋白,使用BCA 蛋白含量测定试剂盒进行蛋白定量。上样行SDS-PAGE 电泳,并转移至PVDF 膜上;加入5%脱脂奶粉封闭1 h,TBST 清 洗;加 入YTHDF1、dystrophin 抗 体(1:1000)4 ℃孵育过夜;TBST清洗,加入辣根过氧化物酶标记的山羊抗鼠/兔IgG 抗体(1:500)室温孵育1 h。使用ECL Plus 化学发光试剂盒进行曝光,化学发光成像系统拍片,以GAPDH为内参照,ImageJ软件进行定量分析。
1.2.3 血清CPK 含量检测 取血液样本,1000×g离心10 min,收集上清,按照CPK ELISA试剂盒说明书步骤检测血清CPK含量。
1.2.4 YTHDF1 蛋白表达水平与血清CPK 含量的相关性分析 采用Pearson 相关性分析YTHDF1 蛋白表达水平与血清CPK含量的相关性。
1.3 细胞培养 人类骨骼肌细胞系(SkMC)由中科院上海生命科学研究院细胞中心提供,置于含hEGF、地塞米松、L-谷氨酰胺和庆大霉素的DMEM 培养基中,补充10% FBS,于37 °C、5% CO2条件下培养。
1.3.1 过表达载体构建及siRNA 合成 根据NCBI GenBank 数据库中YTHDF1 编码区(CDS)序列,设计上下游分别含有XhoI和BamHI酶切位点的PCR 引物扩增目的片段,双酶切、胶回收纯化后将其连接于进行相同双酶切处理的腺病毒表达载体,转化至大肠杆菌感受态细胞,过夜培养。第2 天挑取单克隆摇菌,提取质粒后经XhoI和BamHI双酶切鉴定及测序后,确认载体构建成功。参照腺病毒包装规程进行病毒包装,并进行滴度检测。YTHDF1siRNA及其阴性对照(NC siRNA)由广州锐博生物科技有限公司设计、合成。
1.3.2 细胞转染 取对数生长期SkMC 细胞,接种于6孔板中(接种密度105个/cm2)。设置空载体组(转染 对 照 空 载 体)、 AAV-YTHDF1 组( 转 染AAVYTHDF1 过表达载体)与Scrambled 组(转染NC siRNA)、si-YTHDF1 组(转染YTHDF1siRNA),待细胞融合至70%时,使用Lipofectamine 3000 转染试剂进行转染,转染后于37 ℃培养48 h,收集细胞。
1.3.2.1 Western blotting 检测YTHDF1过表达或敲低效率 提取各组SkMC 细胞总蛋白,采用Western blotting 检测YTHDF1 蛋白表达水平,一抗YTHDF1抗体稀释比例为1∶1000。操作步骤同1.2.2。
1.3.2.2 EdU 法检测细胞增殖情况 根据EdU 试剂盒说明书步骤,使用5-乙基-2-脱氧尿苷(EdU)掺入法检测各组细胞增殖情况。加入EdU 孵育细胞约2 h,4%多聚甲醛溶液固定30 min,0.5% Triton X-100 孵育15 min,染色反应液孵育30 min。细胞核用Hoechst染色。随机选取5个区域于显微镜下观察拍片。
1.3.2.3 Western blotting 检 测dystrophin、 YAP1、MyoG、MHC 蛋白表达水平 提取SkMC 细胞总蛋白,采用Western blotting 检测dystrophin、YAP1、MyoG、MHC 蛋白表达水平,操作步骤同1.2.2。一抗dystrophin 抗体、YAP1 抗体、MyoG 抗体和MHC抗体稀释比例为1∶1000。
1.3.2.4 RT-qPCR检测YTHDF1、YAP1mRNA表达水平 使用Trizol 试剂提取SkMC 细胞总RNA,采用RT-qPCR 检测YTHDF1、YAP1mRNA 表达水平,操作步骤同1.2.1。
1.3.3 SRAMP在线数据库预测 采用SRAMP在线数据库预测YAP1mRNA序列中的m6A修饰位点。
1.3.4 RNA免疫沉淀反应(RIP)检测YTHDF1与YAP1mRNA的结合情况 根据Magna RIP RNA结合蛋白免疫沉淀试剂盒说明书步骤进行RIP 测定。用补充有蛋白酶和RNase抑制剂的RNA裂解缓冲液裂解SkMC细胞,并在4 ℃下用涂有anti-YTHDF1 抗体、antim6A 抗体或IgG 的蛋白A/G 磁珠培养细胞裂解物过夜。洗涤后,纯化免疫沉淀RNA,然后采用RTqPCR进行定量分析。
1.3.5 mRNA 稳定性检测 转染YTHDF1siRNA 16 h后,使用转录抑制剂放线菌素D 干预,收取干预0、2、4、8及16 h的细胞,提取总RNA,用酶标仪检测RNA 浓度,反转录得到cDNA,通过RT-qPCR 检测YAP1mRNA表达水平,分析降解速率。
1.4 动物实验 30 只雄性SPF 清洁级Mdx 小鼠,4 周龄,体重10~18 g,购自西安交通大学实验动物中心[实验动物许可证号:SYXK(陕)2016-005],饲养于12 h 光照/12 h 黑暗交替、温度(22±3) ℃、湿度45%~60%环境下,自由摄食饮水。本动物实验经西安市儿童医院实验动物福利与伦理委员会批准(20160918-1F)。
1.4.1 DMD小鼠模型构建 将30只Mdx小鼠随机分为空载体组与AAV-YTHDF1组,每组15只。空载体组腹腔注射200 μl 空载体,AAV-YTHDF1 组腹腔注射200 μl AVV-YTHDF1。注射时间为第1 天、第1 次注射后48 h、第1次注射后15 d。每天监测小鼠的饮食、呼吸、精神状态和体重。距第1 次注射20 周处死小鼠,采集肌肉组织和器官,检测肌肉组织和器官湿重、纤维直径及纤维类型。
1.4.2 Western blotting检测YTHDF1、dystrophin蛋白表达水平 将肌肉组织制备为组织匀浆液,采用Western blotting检测YTHDF1、dystrophin蛋白表达水平,具体操作同1.2.2。
1.4.3 HE染色 小鼠处死后立即取后肢腓肠肌和股四头肌,组织块大小不超过0.5 cm3。用0.9%生理盐水漂洗血液与污渍,将组织放入包埋盒中,迅速浸泡于4%多聚甲醛溶液中固定,常规切片后行HE 染色,于显微镜下观察。
1.5 统计学处理 采用SPSS 22.0 软件进行统计分析。所有实验数据以xˉ±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 YTHDF1在DMD患者肌肉组织中的表达情况RT-qPCR和Western blotting检测结果显示,与对照组比较,DMD 组患者肌肉组织中YTHDF1mRNA 和蛋白表达水平均明显降低(P<0.01或P<0.001,图1A、B)。ELISA 检测结果显示,与对照组比较,DMD 组患者血清CPK含量明显增加(P<0.001,图1C)。Pearson相关分析结果显示,DMD患者YTHDF1蛋白表达水平与血清CPK 含量呈负相关(r2=0.8658,P<0.0001,图1D)。Western blotting 检测结果显示,与对照组比较,DMD 组患者肌肉组织中dystrophin 蛋白表达水平明显降低(P<0.01,图1E)。
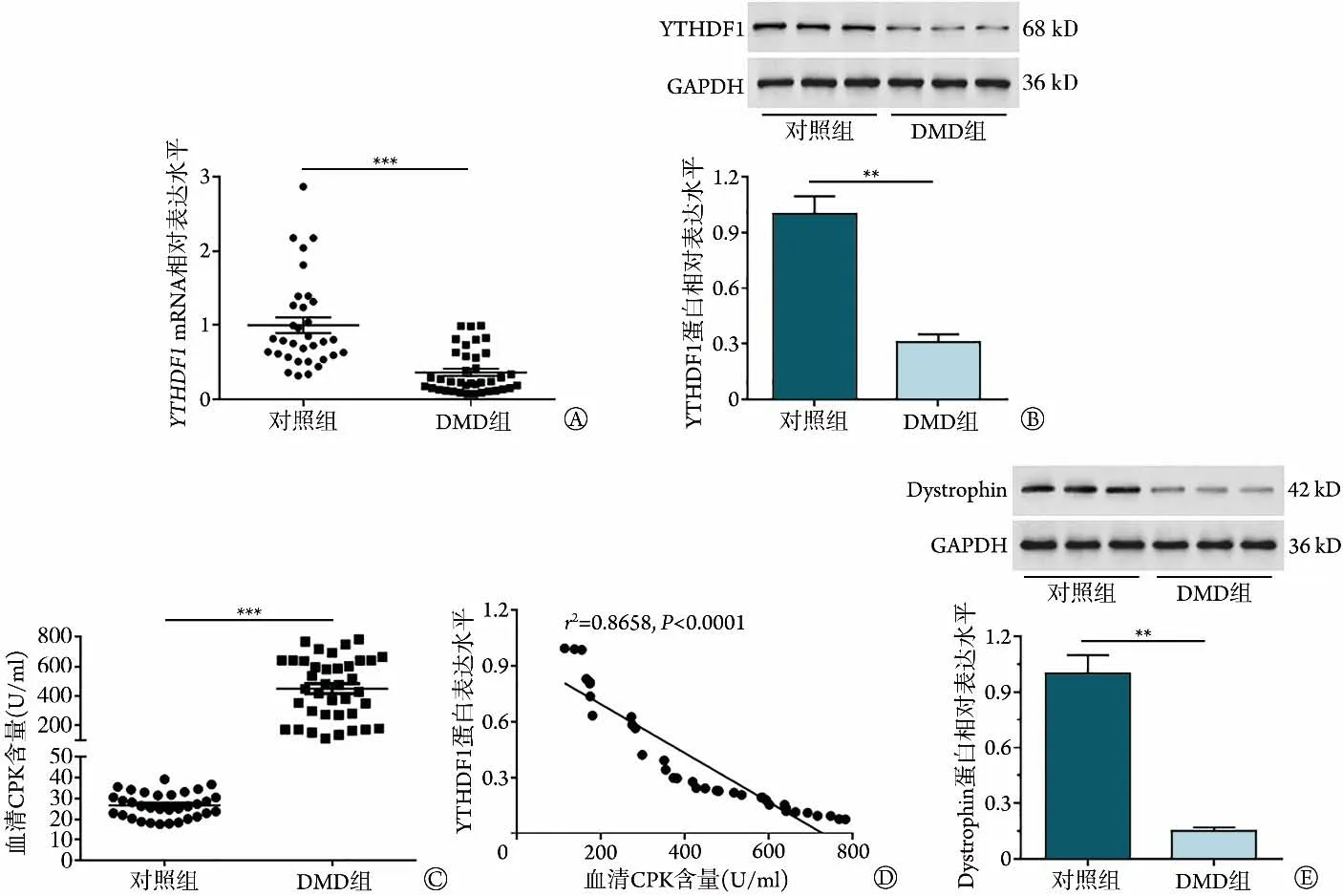
图1 两组患者肌肉组织中YTHDF1、dystrophin表达水平及血清CPK含量比较Fig.1 Comparison of YTHDF1 and dystrophin expression levels in muscle tissue and serum CPK content between DMD patients and control peoples
2.2 过表达YTHDF1对肌细胞增殖和dystrophin表达的影响 Western blotting检测结果显示,与空载体组比较,AAV-YTHDF1组SkMC细胞中YTHDF1蛋白表达水平明显升高(P<0.01,图2A),表明YTHDF1 过表达实验成功。与空载体组比较,AAV-YTHDF1 组SkMC 细胞中dystrophin、MyoG 和MHC 蛋白表达水平明显升高(P<0.01,图2B)。EdU检测结果显示,与空载体组比较,AAV-YTHDF1 组EdU 阳性细胞率明显增高(P<0.01,图2C)。
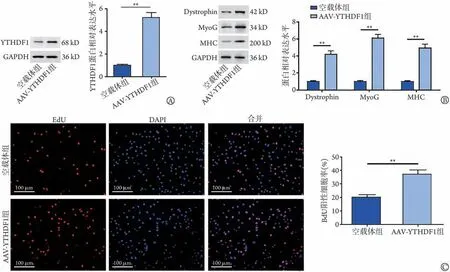
图2 过表达YTHDF1对肌细胞增殖及dystrophin、MyoG和MHC蛋白表达的影响Fig.2 Effects of overexpression of YTHDF1 on myocyte proliferation and expression levels of dystrophin, MyoG and MHC
2.3 敲低YTHDF1对肌细胞增殖和dystrophin表达的影响 Western blotting 检测结果显示,与Scrambled组比较,si-YTHDF1 组SkMC 细胞中YTHDF1蛋白表达水平明显降低(P<0.01,图3A),表明YTHDF1 敲低实验成功。与Scrambled 组比较,si-YTHDF1 组SkMC 细胞中dystrophin、MyoG 和MHC 蛋白表达水平明显降低(P<0.01,图3B)。EdU检测结果显示,与Scrambled 组 比 较,si-YTHDF1 组EdU 阳 性 细 胞 率 明显降低(P<0.05,图3C)。
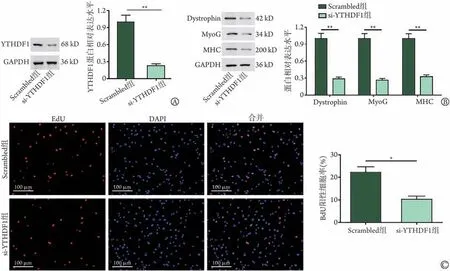
图3 敲低YTHDF1对肌细胞增殖和dystrophin、MyoG和MHC蛋白表达的影响Fig.3 Effects of YTHDF1 knockdown on myocyte proliferation and expression levels of dystrophin, MyoG and MHC
2.4 YTHDF1与YAP1mRNA的相互作用 SRAMP在线数据库预测结果显示,YAP1mRNA 上存在多个m6A 修饰位点(图4A);RIP 检测结果显示,Anti-YTHDF1 抗 体 组 中YAP1mRNA 富 集, 而Anti-YTHDF1抗体组与IgG抗体组中dystrophinmRNA含量无明显差异(图4B);anti-m6A 抗体组中YAP1mRNA富集(图4C),表明YTHDF1通过识别YAP1mRNA 的m6A修饰与YAP1mRNA相互作用。

图4 YTHDF1蛋白与YAP1 mRNA的相互作用Fig.4 The interaction between YTHDF1 protein and YAP1 mRNA
2.5 YTHDF1 对YAP1 表达和YAP1mRNA 稳定性的影响 Western blotting检测结果显示,与空载体组比较,AAV-YTHDF1 组YAP1 蛋白表达水平明显升高(P<0.01);与Scrambled 组比较,si-YTHDF1 组YAP1蛋白表达水平明显降低(P<0.01,图5A)。放线菌素D干预实验结果显示,与空载体组比较,AAV-YTHDF1组YAP1mRNA半衰期延长,同一时间点YAP1mRNA降解减少(P<0.001,图5B)。
2.6 YTHDF1对DMD小鼠肌肉生长和肌肉质量的影响 AAV-YTHDF1 组与空载体组小鼠初次注射时体重无明显差异(P>0.05),但20 周时,AAV-YTHDF1组小鼠体重较空载体组增加,差异有统计学意义(P<0.01,图6A)。Western blotting 检测结果显示,与空载体组比较,AAV-YTHDF1 组小鼠肌肉组织中YTHDF1 和dystrophin 蛋白表达水平均明显升高(P<0.01,图6B)。与空载体组比较,AAV-YTHDF1组小鼠腓肠肌、股四头肌、三头肌肌肉重量增加(P<0.05);但两组腹股沟、性腺或腹膜后脂肪垫重量无明显差异(P>0.05,图6C)。HE 染色结果显示,与空载体组比较,AAV-YTHDF1 组小鼠炎性细胞浸润减少,坏死面积缩小,组织病理学改变明显得到改善(P<0.05);此外,与空载体组比较,AAV-YTHDF1组小鼠腓肠肌和股四头肌纤维面积明显增大(P<0.05,图6D)。

图6 YTHDF1对DMD小鼠肌肉生长和肌肉质量的影响Fig.6 Effect of YTHDF1 on muscle growth and muscle mass in DMD mice
3 讨 论
DMD是最常见的遗传性神经性肌肉病,起病隐匿且预后差,大多数患者早期无明显临床症状,导致诊断困难和误诊。在美国,DMD从症状开始到确诊约有2.5年的延迟,而在全球其他地区,延迟时间则更长[8]。DMD 是一种主要影响男孩的疾病,其特征是进行性肌肉退行性变和萎缩,导致心肌病和呼吸衰竭,最终导致患儿过早死亡[9]。
DMD 的分子遗传学基础是dystrophin基因突变[10]。Dystrophin基因突变导致dystrophin 蛋白突变,而dystrophin位于肌细胞膜内侧面,是一种大型支架蛋白,可与相关糖蛋白组成DAPC[10-11]。DAPC 将细胞外基质锚定到细胞骨架上,使肌肉纤维抵抗损伤的能力明显增强,是肌肉收缩过程中维持肌膜结构完整性的关键蛋白[12]。虽然多数骨骼肌的初始形成在发育过程中不受阻碍,但由于与肌肉收缩相关的机械应力导致外周膜受损,肌肉纤维会随着个体的成熟而迅速退化[13]。随着疾病的加重,被称为卫星细胞的骨骼肌祖细胞无法充分增殖和分化以替代受损的肌肉纤维[14]。有报道显示,可以利用内源性机制促进肌细胞持续增殖来维持骨骼肌的再生能力,减轻DMD造成的损害[15]。
Dystroglycan 1 又称为dystrophin 相关糖蛋白,通常与dystrophin 形成蛋白复合物发挥作用。Dystroglycan 1 可直接与Hippo 通路的效应因子YAP1结合,抑制小鼠心肌细胞的增殖,当编码dystroglycan 1 的基因被敲除时,这种相互作用被破坏,而Hippo 诱导的YAP1 磷酸化增强了YAP1 与dystroglycan 1 的 相 互 作 用[12]。YAP1 作 为Hippo 信 号通路下游的关键效应因子,可调节细胞分化、增殖和凋亡,控制器官发育和再生,以及维持正常组织的稳态,在多种生理病理过程中发挥重要作用[16]。有研究发现,dystrophin 与Hippo 信号通路的关键激酶Wts 存在相互作用,并且dystrophin 能够通过结合Wts 调控果蝇的器官发育[17]。本研究发现,DMD 患者肌肉组织中dystrophin表达水平明显降低;过表达YTHDF1 可促进肌细胞增殖,使dystrophin 蛋白表达水平升高;敲低YTHDF1 可抑制肌细胞增殖,使dystrophin蛋白表达水平降低。
YAP1作为潜在的致癌基因[18],目前研究主要集中于YAP1 上下游分子的筛选[19];然而,关于YAP1表达水平调控的机制尚未完全清楚。m6A 修饰是真核细胞中最丰富的RNA 内部修饰,可被m6A 结合蛋白(reader)识别,包括YTHDF1-3、IGF2BP1-3 和YTHDC1-2[20]。本研究发现,与正常肌肉组织比较,m6A 识别蛋白YTHDF1 在DMD 肌肉组织中表达降低。既往研究发现,YTHDFs 可识别YAP1mRNA 的m6A 修饰,其可通过与m6A 修饰的mRNA 结合来提高稳定性,从而促进YAP1的表达[21-24]。本研究结果证实了这一现象,即过表达YTHDF1 通过延长YAP1mRNA的半衰期来稳定YAP1mRNA表达。
MyoG和MHC是成肌细胞分化过程中骨骼肌特异性表达的关键基因。MyoG是骨骼肌分化的决定因子,调控成肌细胞融合和肌纤维形成[25],MyoG敲除小鼠因无肌肉形成,在胚胎期死亡[26];MHC是构成骨骼肌纤维内粗肌丝的主要成分。肌纤维类型主要由肌纤维内表达的MHC 类型决定[27]。本研究发现,过表达YTHDF1 可促进MyoG 和MHC 蛋白的表达;敲低YTHDF1可抑制MyoG和MHC蛋白的表达。
综上所述,本研究结果表明,YTHDF1 通过识别YAP1mRNA 的m6A 修饰促进YAP1mRNA 的稳定性,进而促进YAP1/dystrophin 介导的肌细胞增殖,改善DMD 小鼠的肌肉萎缩。未来可进一步完善DMD 肌肉萎缩的分子调控网络,以为DMD 的诊断及治疗提供理论依据和新的视角。
