创伤弧菌经呼吸道感染小鼠早期靶器官损伤及炎性因子谱分析
2024-01-21张磊刘剑飞马慧周丽君
张磊,刘剑飞,马慧,周丽君*
1华南理工大学医学院,广东广州 510006;2解放军总医院第六医学中心中心实验室,北京 100048;3解放军总医院第六医学中心耳鼻咽喉头颈外科医学部研究所,北京 100048;4解放军总医院护理部,北京 100853
弧菌是革兰阴性菌,常被发现于河口、湖泊和海洋等水域中,可通过污染海产品对人类健康造成威胁,是食源性疾病的重要病原体之一[1-3]。在已知的12 种致病弧菌中,创伤弧菌(Vibrio vulnificus,V.vulnificus)致病性较强,易感人群感染后3 d 不处理,病死率可达100%[4]。随着气候转暖、海洋水产养殖业发展和人类海上活动增加,V.vulnificus感染人类的报道病例数连年增加,2006 年被Emerging Infectious Diseases杂志纳入最危险的细菌之列[5-6]。除食源性途径外,研究显示V.vulnificus还可通过开放性伤口和外耳道等多种途径入侵人体,引发原发性败血症,进而诱发耳炎、肺炎等继发感染[7-8]。随着航海作业增多,频发的海水淹溺事件成为海上作业减员的重要因素[9]。发生海上淹溺事件时,V.vulnificus可随海水经呼吸道入侵人体。在此过程中,研究V.vulnificus经呼吸道侵袭是否造成感染,判断其感染程度和感染进展时间,进行受累靶组织致病分析等,对其经呼吸道感染的防治具有重要意义。目前对V.vulnificus经呼吸道感染宿主的报道鲜见。本研究通过滴鼻途径建立V.vulnificus呼吸道感染小鼠模型,观察感染早期阶段(0~12 h)小鼠的生存状态和炎性因子谱变化,并进行靶组织病理学分析,旨在评估V.vulnificus经呼吸道感染对小鼠靶器官的致伤特点,为相关防治工作提供参考。
1 材料与方法
1.1 材料
1.1.1 主要试剂和仪器 无水乙醇、二甲苯、正丁醇购自国药集团;4%多聚甲醛固定液、脱蜡透明液、柠檬酸抗原修复液(pH 6.0)、EDTA 抗原修复液(pH 9.0、pH 8.0)、PBS缓冲液、BSA、兔血清、苏木精染液、伊红染液和免疫组化试剂盒购自武汉赛维尔公司;2216E 琼脂和2216E 肉汤购自青岛海博公司;LEGENDplexTM多因子检测试剂盒购自美国BioLegend 公司。脱水机购自意大利DIAPATH 公司;包埋机、冻台购自武汉俊杰公司;病理切片机购自德国Leica Biosystems 公司;显微镜成像系统购自日本Nikon公司;流式细胞仪购自美国Cytek公司。
1.1.2 弧菌V.vulnificus模式菌株1H00066购自中国海洋微生物菌种保藏管理中心(Marine Culture Collection of China,MCCC),保存于含30%甘油的2216E培养基,-80℃超低温冰箱冻存备用。
1.1.3 实验动物与分组 8~10 周龄SPF 级雌性BALB/c小鼠24只,购自北京维通利华实验动物技术有限公司[实验动物生产许可证号:SCXK(京)2021-0006],体重17~18 g。随机分为对照组、低浓度感染组、中浓度感染组和高浓度感染组,每组6 只。小鼠于SPF 条件下饲养于北京易科攀搏生物科技有限公司,实验周期(60 h 适应性饲养+12 h 实验)内均自由饮食。本研究动物实验方案经康泰医学检验服务河北有限公司实验动物伦理委员会批准,所有流程均符合国际实验动物科学理事会(the International Council for Laboratory Animal Science,ICLAS)的相关指南,并遵守国家有关实验动物的管理和使用规定。
1.2 方法
1.2.1 创伤弧菌呼吸道感染小鼠模型的制备V.vulnificus1H00066 复壮后,接种至2216E 肉汤,35 ℃、180 r/min 震荡培养12 h,12 000 r/min 室温离心2 min。弃上清,菌体沉淀使用无菌1×PBS 洗涤3 次,并使用无菌1×PBS 分别稀释至OD600nm=0.1(低浓度感染组)、OD600nm=0.2(中浓度感染组)、OD600nm=0.3(高浓度感染组)。各感染组分别取1 ml新鲜菌液,3000 r/min 室温离心5 min;1×PBS 重悬至100 μl,充分涡旋混匀,4 ℃保存备用;同时制备100 μl 1×PBS缓冲液作为对照组。各组小鼠均通过滴鼻给药法逐滴缓慢滴入鼻腔,经呼吸道给药至体内,构建创伤弧菌经呼吸道感染小鼠模型。
1.2.2 实验动物的处理及取材 在感染早期(0~12 h)每间隔1 h监测一次各组小鼠的生存状态,包括存活率、呼吸道与消化道有无异常症状、体表毛发情况及精神状况。至12 h 监测终点后麻醉小鼠并进行眼球取血,静置分离血清备用。脱颈处死小鼠后,获取心脏、肺、肝、脾、肾、胃(1×PBS去内容物)、回肠段(部分)等重要内脏器官,使用无菌1×PBS 冲洗,置于4%多聚甲醛固定液中固定,24 h 后更换固定液,直至完全固定,留存备用。
1.2.3 小鼠内脏器官组织病理学分析 将完全固定的小鼠脏器组织进行石蜡包埋并切片,苏木精-伊红(hematoxylin-eosin,HE)染色,200×光镜下观察小鼠心脏、肺、肝、脾、肾、胃、回肠等内脏器官的组织病理学变化。
1.2.4 免疫组化检测小鼠回肠、肺、肝和脾组织中白细胞介素-6(interleukin-6,IL-6)、IL-10、γ 干扰素(interferon-γ,IFN-γ)、肿瘤坏死因子(tumor necrosis factor,TNF)-α表达情况 将完全固定的小鼠脏器组织进行石蜡包埋并切片。经脱蜡水化后,置于柠檬酸抗原修复缓冲液(pH 6.0)中进行修复,随后置于3% H2O2室温避光孵育25 min,1×PBS 冲洗后加入血清封闭30 min。1×PBS冲洗后分别加入抗IL-6、IL-10、IFN-γ 和TNF-α 抗体,4 ℃孵育过夜,1×PBS 冲洗后加入二抗室温孵育5 min。加入DAB显色液,苏木精复染3 min,脱水、封片。切片置于显微镜下观察,结果标记为蓝色(细胞核)、棕黄色(阳性表达的相应细胞因子)。采用Aipathwell 软件分析IL-6、IL-10、IFN-γ 和TNF-α 的阳性表达率。阳性表达率(%)=阳性面积/组织面积×100%。
1.2.5 小鼠血清1 3种炎性细胞因子表达水平检测采集小鼠血液,3000 r/min 室温离心5 min,取上层血清储存于-80 ℃冰箱备用。每个样本吸取25 μl 血清,按照LEGENDplexTM多因子检测试剂盒说明书方法,同时检测各组小鼠血清中IL-1β、IL-1α、IL-6、IL-10、 IL-23、 IL-12p70、 IL-17A、 IL-27、 IFN- γ、IFN-β、TNF-α、单核细胞趋化蛋白(MCP)-1 和粒细胞-巨噬细胞集落刺激因子(GM-CSF)等13 种炎性细胞因子的表达水平。实验流程如下:混合包被荧光微球与25 μl 血清孵育2 h,加入25 μl 检测抗体孵育60 min,加入25 μl 藻红蛋白标记的链霉亲和素(SA-PE)孵育30 min;采用流式细胞术检测13种细胞因子的荧光强度,利用LEGENDplex软件进行数据处理,对其表达量进行统计分析。
1.3 统计学处理 采用SPSS 26.0 软件进行统计分析。计量资料符合正态发布,以xˉ±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结 果
2.1V.vulnificus呼吸道感染早期小鼠外观生理学变化 感染后0~12 h,不同浓度感染组小鼠均先后出现较明显的外观生理学改变,包括弓背、安静、精神萎靡、立毛、毛发粗糙、呼吸异常和腹泻等症状;各组差异主要体现为不同症状的时间进程。随感染程度加重,外观生理学改变发生时间前移,异常表现的小鼠数量增加。高浓度感染组小鼠于感染后12 h 死亡1 例,低、中浓度感染组无死亡病例。此外,各组小鼠均未见昏迷、晕厥、呕吐、寒战或局部表层皮肤坏死等经消化道感染或开放伤口感染后的常见症状。
2.2V.vulnificus呼吸道感染早期小鼠靶器官及相关组织病理学检查结果 HE染色结果显示,与对照组比较,低、中、高浓度感染组小鼠的肾、心脏、胃均未见异常病理变化,而肝、肺、回肠、脾等器官出现不同程度的病理损伤,且高浓度感染组损伤程度更重(图1)。
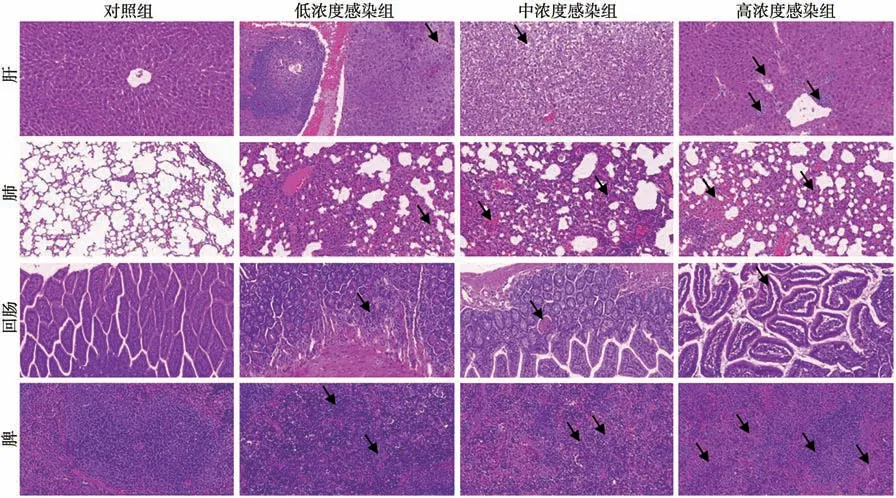
图1 V.vulnificus呼吸道感染早期小鼠主要脏器病理改变(HE ×200)Fig.1 Pathological changes of major organs in mice with V. vulnificus early infection via respiratory tract (HE ×200)
(1)肝。对照组小鼠肝细胞排列整齐,形态正常,着色均匀,结构清晰,无明显病理变化。低浓度感染组小鼠肝组织边缘可见少量肝细胞水样变性,细胞肿胀,胞质疏松淡染;中浓度感染组小鼠肝组织中可见较多肝细胞气球样变性,细胞肿胀,核居中,胞质空泡化;高浓度感染组小鼠肝组织中可见较多肝细胞水样变性,细胞肿胀,胞质疏松淡染,多见淋巴细胞与点状的巨噬细胞就浸润,少见肝细胞点状坏死,核溶解。(2)肺。对照组小鼠肺组织无异常病理表现。低浓度感染组可见肺泡壁增厚,伴有弥散的淋巴细胞与中性粒细胞浸润;中浓度感染组可见较大范围的肺泡壁增厚,伴有弥散的淋巴细胞与中性粒细胞浸润,局部可见出血;高浓度感染组可见较大范围的肺泡壁增厚,伴有弥散的淋巴细胞、中性粒细胞与巨噬细胞浸润,可见较多出血。(3)回肠。对照组小鼠回肠形态结构正常,未见明显的炎症表现。低浓度感染组小鼠回肠组织局部固有层底部可见少量淋巴细胞浸润;中浓度感染组小鼠回肠组织黏膜层局部可见肠腺扩张,腺腔内可见坏死细胞碎片;高浓度感染组小鼠回肠组织黏膜层可见多处水肿,肠上皮与固有层之间可见空隙。(4)脾。对照组脾组织结构正常。低浓度感染组可见多处脾小结生发中心扩张,红髓有大面积髓外造血灶,伴有多核巨细胞数量明显增多;中浓度感染组脾小结数量明显减少,红髓有大面积髓外造血灶,伴有多核巨细胞数量增多;高浓度感染组小鼠局部脾小结中可见生发中心扩张,红髓有大面积髓外造血灶,伴有多核巨细胞数量明显增多,少见中性粒细胞浸润。
2.3V.vulnificus呼吸道感染早期小鼠靶器官中炎性因子表达变化 采用免疫组织化学法检测V.vulnificus呼吸道感染早期小鼠靶器官(回肠、肺、肝和脾)中炎性因子IL-6、IL-10、IFN-γ 和TNF-α 的阳性表达率,结果见图2-5。

图2 V.vulnificus呼吸道感染早期小鼠回肠组织IL-6、IL-10、IFN-γ和TNF-α的表达变化Fig.2 Expression of IL-6, IL-10, IFN-γ, and TNF-α in intestinal of mice with early infection of V. vulnificus via respiratory tract
2.3.1 回肠 与对照组比较,低、中、高浓度感染组小鼠回肠组织中IL-6、IL-10、IFN-γ和TNF-α的阳性表达率均明显增高(P<0.05)。中、高浓度感染组小鼠回肠组织中IL-6、IL-10、IFN-γ和TNF-α的阳性表达率均明显高于低浓度感染组(P<0.05)(图2)。
2.3.2 肺 与对照组比较,低、中、高浓度感染组小鼠肺组织中IL-6、IL-10、IFN-γ和TNF-α的阳性表达率均明显增高(P<0.05)。中、高浓度感染组小鼠肺组织中IL-6、IL-10、IFN-γ和TNF-α的阳性表达率均明显高于低浓度感染组(P<0.05)(图3)。

图3 V.vulnificus呼吸道感染早期小鼠肺组织IL-6、IL-10、IFN-γ和TNF-α的表达变化Fig.3 Expression of IL-6, IL-10, IFN-γ, and TNF-α in lung of mice with early infection of V. vulnificus via respiratory tract
2.3.3 肝 与对照组比较,低、中、高浓度感染组小鼠肝组织中IL-6、IL-10、IFN-γ和TNF-α的阳性表达率均明显增高(P<0.05)。中、高浓度感染组小鼠肝组织中IL-6、IL-10 和IFN-γ 的阳性表达率均明显高于低浓度感染组(P<0.05)(图4)。
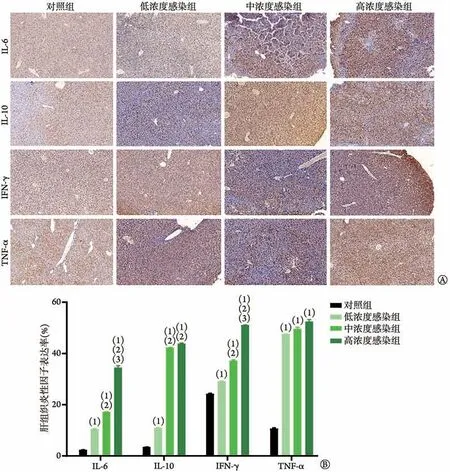
图4 V.vulnificus呼吸道感染早期小鼠肝组织IL-6、IL-10、IFN-γ和TNF-α的表达变化Fig.4 Expression of IL-6, IL-10, IFN-γ, and TNF-α in liver of mice with early infection of V. vulnificus via respiratory tract
2.3.4 脾 与对照组比较,低浓度感染组小鼠脾组织IL-10、IFN-γ 和TNF-α 的阳性表达率均明显增高(P<0.05),IL-6 的阳性表达率差异无统计学意义(P>0.05)。中、高浓度感染组小鼠脾组织IL-6、IL-10、IFN-γ和TNF-α的阳性表达率均明显高于低浓度感染组和对照组(P<0.05)(图5)。
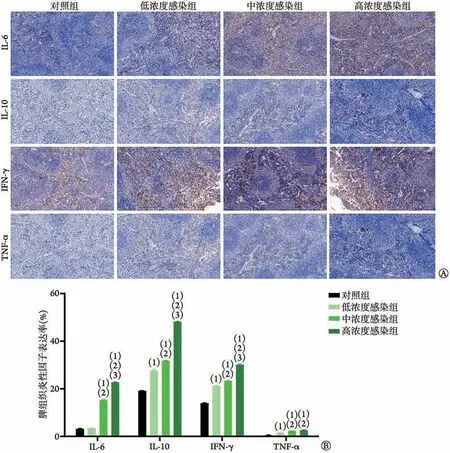
图5 V.vulnificus呼吸道感染早期小鼠脾组织IL-6、IL-10、IFN-γ和TNF-α的表达变化Fig.5 Expression of IL-6, IL-10, IFN-γ, and TNF-α in spleen of mice with early infection of V. vulnificus via respiratory tract
2.4V.vulnificus呼吸道感染早期小鼠血清促炎-抑炎因子谱变化 采用高通量多因子检测结合流式细胞术结果显示,与对照组比较,低、中、高浓度感染组小鼠血清TNF-α、MCP-1 表达水平明显增高(P<0.05),IL-27表达水平明显降低(P<0.05),IL-10和IFN-β 表达水平无明显差异(P>0.05),而中、高浓度感染组小鼠血清IL-1β、IL-6、IL-17A、GM-CSF表达水平明显增高(P<0.05),高浓度感染组小鼠血清IL-1α、IL-23、IL-12p70、IFN-γ表达水平均明显增高(P<0.05,表1)。
表1 V. vulnificus呼吸道感染早期小鼠血清13种炎性因子表达水平(pg/ml, ±s, n=6)Tab.1 Expression levels of 13 inflammatory factors in serum of mice with V. vulnificus early infection via respiratory tract (pg/ml, ±s, n=6)
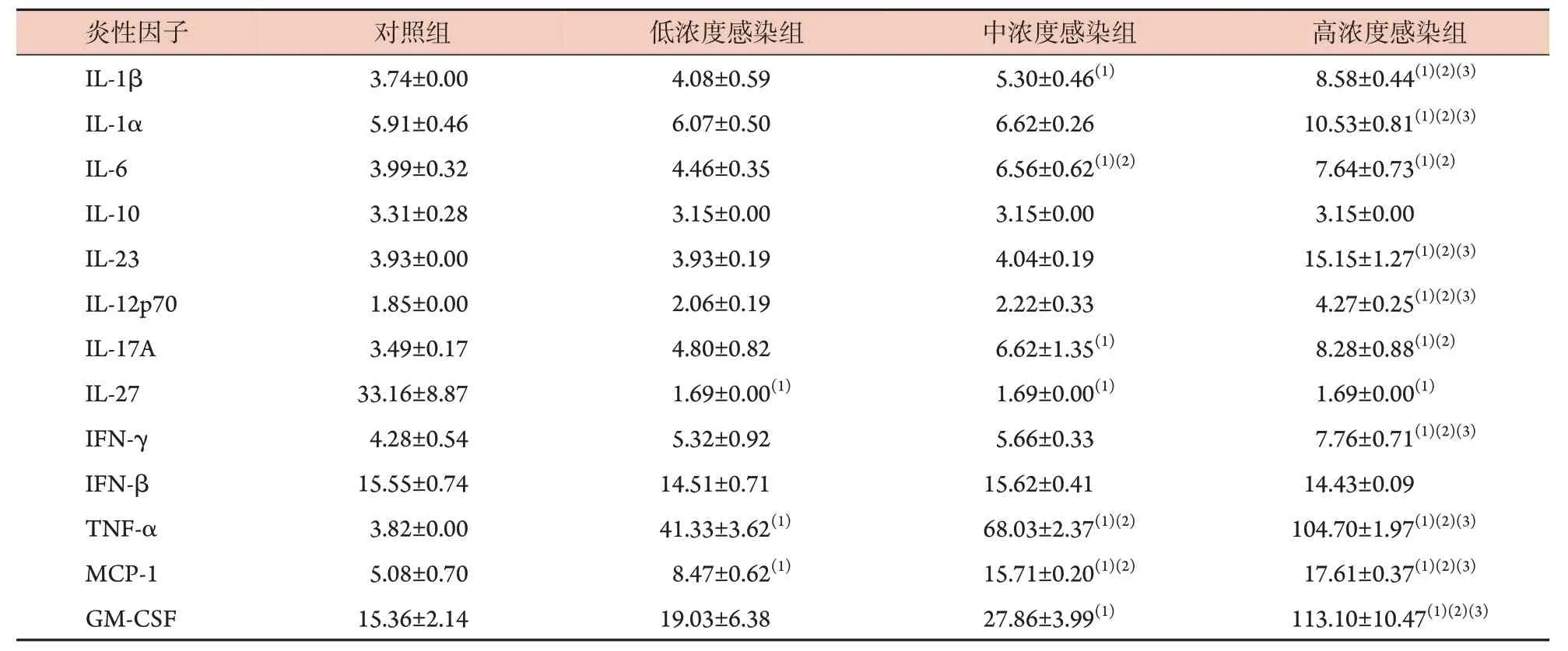
表1 V. vulnificus呼吸道感染早期小鼠血清13种炎性因子表达水平(pg/ml, ±s, n=6)Tab.1 Expression levels of 13 inflammatory factors in serum of mice with V. vulnificus early infection via respiratory tract (pg/ml, ±s, n=6)
IL.白细胞介素;IFN.干扰素;TNF-α.肿瘤坏死因子-α;MCP-1.单核细胞趋化蛋白-1;GM-CSF.粒细胞-巨噬细胞集落刺激因子;与对照组比较,(1)P<0.05;与低浓度感染组比较,(2)P<0.05;与中浓度感染组比较,(3)P<0.05
高浓度感染组8.58±0.44(1)(2)(3)10.53±0.81(1)(2)(3)7.64±0.73(1)(2)3.15±0.00 15.15±1.27(1)(2)(3)4.27±0.25(1)(2)(3)8.28±0.88(1)(2)1.69±0.00(1)7.76±0.71(1)(2)(3)14.43±0.09 104.70±1.97(1)(2)(3)17.61±0.37(1)(2)(3)113.10±10.47(1)(2)(3)炎性因子IL-1β IL-1α IL-6 IL-10 IL-23 IL-12p70 IL-17A IL-27 IFN-γ IFN-β TNF-α MCP-1 GM-CSF对照组3.74±0.00 5.91±0.46 3.99±0.32 3.31±0.28 3.93±0.00 1.85±0.00 3.49±0.17 33.16±8.87 4.28±0.54 15.55±0.74 3.82±0.00 5.08±0.70 15.36±2.14低浓度感染组4.08±0.59 6.07±0.50 4.46±0.35 3.15±0.00 3.93±0.19 2.06±0.19 4.80±0.82 1.69±0.00(1)5.32±0.92 14.51±0.71 41.33±3.62(1)8.47±0.62(1)19.03±6.38中浓度感染组5.30±0.46(1)6.62±0.26 6.56±0.62(1)(2)3.15±0.00 4.04±0.19 2.22±0.33 6.62±1.35(1)1.69±0.00(1)5.66±0.33 15.62±0.41 68.03±2.37(1)(2)15.71±0.20(1)(2)27.86±3.99(1)
3 讨 论
既往研究显示,V.vulnificus可通过消化道和局部伤口两种途径感染人类,且病程进展迅速,经消化道感染后主要表现为肠胃炎、败血症和蜂窝组织炎等,经伤口感染后主要表现为败血症、脓毒血症和坏死性筋膜炎等[10]。上述两种感染途径均可迅速导致人体发生严重的炎性反应,从而造成多器官损伤,病死率超过50%[11]。呼吸道是人体与外界相通的重要途径,发生海上淹溺事件时,V.vulnificus可能通过呼吸道入侵人体,但目前对V.vulnificus经呼吸道感染的报道少见。本研究采用滴鼻法建立了不同浓度V.vulnificus经呼吸道感染小鼠模型,对其早期感染进程(0~12 h)中的致伤作用进行了病理学观察,可为进一步研究V.vulnificus多途径感染致病性及临床救治提供参考。
本研究广泛摘取V.vulnificus经呼吸道感染早期小鼠循环系统、呼吸系统、消化系统、免疫系统、泌尿系统的重要器官组织,病理学观察显示,回肠、肺、肝、脾等器官出现不同程度的损伤,应为V.vulnificus经呼吸道感染后主要的受累靶器官。其中肝细胞损伤程度随菌液接种浓度增高而加重。肺组织随菌液接种浓度增高,其炎性浸润程度呈上升趋势。回肠组织的病变程度随V.vulnificus菌液接种浓度增高而呈现更加复杂的临床变化。脾组织代偿性造血功能出现的频率随V.vulnificus感染程度加重而增高,提示合并多组织损伤程度加深。
本研究结果显示,小鼠经呼吸道感染V.vulnificus后,可在12 h 内引起呼吸系统、消化系统、免疫系统等器官不同程度的组织结构损伤、细胞变形和炎性细胞浸润,这些病理学表现可对感染组小鼠的腹泻、喘咳等外观生理学症状做出解释。对V.vulnificus经呼吸道感染与经其他途径感染进行比较,经腹腔、皮下和肌肉感染V.vulnificus除可引起脾、肺、肝产生病理学变化外,还可导致小鼠出现心脏和肾组织损伤,但胃和肠无显著病理变化;V.vulnificus经消化道感染较之其他感染途径的致伤作用更为广泛,可导致小鼠心脏、肝、脾、肺、肾、胃和肠等器官组织的广泛损伤,引起更为严重的继发感染[12-15]。本研究结果显示,V.vulnificus可通过呼吸道感染小鼠,在其早期感染进程中,心脏、肾和胃受到的影响较小。此结果可为判定V.vulnificus的感染途径提供参考,从而及时针对受累器官展开临床诊断和治疗。对于不同途径感染V.vulnificus后受累靶器官的损伤情况及其致伤机制有待进一步研究。
本研究结合病理学观察,测定了小鼠受累靶器官回肠、肺、肝、脾中炎性因子IL-6、IL-10、IFN-γ和TNF-α 的表达水平,结果显示,经呼吸道感染V.vulnificus后靶器官中IL-6、IL-10、IFN-γ 和TNF-α的表达量随菌液接种浓度升高而增加,提示靶器官损伤程度随小鼠感染程度加重而加重。作为促炎因子,IL-6、IFN-γ和TNF-α的表达增加会引起机体炎性反应,在此基础上易合并其他症状而造成器官损伤[16-17]。陆海霞等[14]的研究显示,小鼠经腹腔途径感染V.vulnificus后,肝组织中IL-6、IFN-γ 和TNF-α表达明显升高,与本研究结果一致。在本研究中,感染组小鼠靶器官中抑炎因子IL-10 表达量明显升高,究其原因,可能是由于V.vulnificus感染早期机体分泌促炎因子,导致促炎反应的发生和促炎细胞因子的大量释放,随之刺激抑炎因子代偿性分泌增多。此外,本研究结果提示,当促炎因子总体表达水平显著高于抑炎因子时,会引起靶器官发生炎性反应,导致器官、组织和细胞受损。
既往研究显示,V.vulnificus在感染过程中会诱导多种炎性因子参与机体内的炎性反应[18]。为进一步明确V.vulnificus经呼吸道感染小鼠后血清炎性因子谱的变化规律,同时为V.vulnificus呼吸道感染的无创性诊断提供参考,本研究进一步检测了小鼠血清中多种炎性因子的变化,结果显示,不同浓度感染组小鼠血清中多种促炎因子表达水平均呈升高趋势,在高浓度感染组中尤为明显,其中TNF-α和MCP-1的表达变化相对更为显著。TNF-α 作为发生感染时体内重要的炎性介质之一,可刺激其他细胞因子如IL-6、血小板活化因子的产生,引起多器官功能损害,是组织损伤的早期敏感指标[19]。而巨噬细胞、单核细胞在靶器官受到严重损伤时可诱导分泌MCP-1,导致其表达水平明显升高[20]。这两种促炎因子表达水平的显著变化提示V.vulnificus呼吸道感染早期宿主体内可能存在广泛的炎性反应。同时,本研究结果显示,血清中平衡炎性反应的细胞因子IL-27表达水平迅速下降,造成表达失调,加剧了机体的炎性反应,进而协同促炎因子而对机体造成损伤。IL-27的类似变化鲜见于其他相关研究,提示其具备作为V.vulnificus呼吸道感染早期敏感指标的潜在价值。此外,TNF-α 和GM-CSF 在高浓度感染组小鼠血清中表达水平明显增高,均超过100 pg/ml。IL-10 和IFN-β 作为抑炎因子,其表达量在感染后变化不明显,提示其可能不适合作为V.vulnificus呼吸道感染早期检测指标。由此可见,在经呼吸道感染V.vulnificus后,及时监测血清中炎性因子谱的变化对于病情判断和临床治疗具有重要指导意义。
本研究存在一定局限性。首先,感染实验采用标准菌株,缺乏对不同来源菌株的相关研究,从而导致实验结果可能存在偏差,因此需要加强对国内其他来源V.vulnificus菌株的呼吸道致病性研究;其次,尚未以V.vulnificus致病的具体机制为突破点开展进一步探索。基于上述两点,本课题组在未来应进一步展开样本扩大实验和V.vulnificus呼吸道致病机制研究。
综上所述,本研究成功构建了多浓度V.vulnificus呼吸道感染小鼠模型,结果显示,回肠、肺、肝和脾是该途径感染重要的靶器官;感染早期小鼠出现了明显的外观生理学改变,靶器官中IL-6、IL-10、IFN-γ和TNF-α呈高表达,同时血液中多种炎性因子表达失衡,促使机体内过度炎性反应的发生,诱导小鼠广泛的机体损伤。TNF-α、MCP-1 和IL-27 可能成为V.vulnificus经呼吸道感染早期的潜在敏感指标。
