五味子醇甲对小鼠神经管畸形的预防作用及其机制研究
2024-01-21茹意谢良骐王新亮肖保国金小明马存根柴智樊慧杰
茹意,谢良骐,王新亮,肖保国,金小明,马存根*,柴智,樊慧杰*
1山西中医药大学多发性硬化益气活血重点研究室/神经生物学研究中心,山西晋中 030619;2复旦大学华山医院神经病学研究所,上海 200025;3美国印第安纳大学医学院,印第安纳波利斯 46202
神经管畸形(neural tube defects,NTDs)是常见的严重出生缺陷性疾病之一[1]。据世界卫生组织统计,全球每年约有9 万例NTDs 患儿死亡,860 万例患儿残疾[2]。目前叶酸(folic acid)是预防NTDs 的唯一用药,但仍有约30%的NTDs 不能被预防[3-4],因此,亟需寻找更有效的药物来弥补该不足。NTDs的发病机制尚不明确,但大量研究显示,磷脂酰肌醇-3-激酶/蛋白激酶B(phosphatidylinositol 3 kinase/protein kinase B,PI3K/Akt)信号通路与NTDs 的发生密切相关[5]。有研究显示,激活PI3K/Akt 信号通路可降低NTDs的发生率[6]。
五味子醇甲(schisandrin,SCH)是中药五味子中可通过血脑屏障的二苯并环辛二烯(dibenzocyclooctadiene lignans)木脂素类成分[7-8],具有抗凋亡、抗氧化、神经保护等多种药理作用[9-11]。有临床研究报道,SCH对人体健康不会造成危害[12-13]。研究显示,SCH对多种神经系统疾病(如阿尔茨海默病、帕金森病等)有一定的治疗作用[14-15],但其能否预防全反式维甲酸(all-trans retinoic acid,atRA)诱导的NTDs 仍不明确。本研究利用atRA 建立NTDs 小鼠模型和PC12细胞损伤模型,观察SCH对NTDs是否有预防作用,并探讨其可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 8~10 周龄SPF 级未经产近交系C57BL/6 小鼠58 只(雌性40 只,雄性18 只),体重(18±2) g,购自北京维通利华实验动物科技有限公司[实验动物生产许可证号:SCXK(京)2021-0006]。饲养于恒温(22±2) ℃、相对湿度40%~60%、12 h/12 h昼夜循环的标准实验室条件下。所有动物实验均按照《实验动物-动物福利伦理审查指南》的伦理标准进行。本研究方案经山西中医药大学实验动物伦理委员会批准(AWE20200319)。
1.1.2 细胞 大鼠肾上腺嗜铬细胞瘤细胞(PC12 细胞)由山西中医药大学益气活血国家中医药管理局重点实验室提供,培养于含有10%胎牛血清、1%青链霉素的DMEM 高糖培养基中,于37 ℃、5% CO2培养箱中培养。
1.1.3 药物 (1)SCH购自成都普菲德生物技术有限公司,白色粉末状,纯度≥99%;分子式C24H32O7;分子量432.51;批号20120205。SCH 药液配制:①动物实验,将SCH粉末溶解于5%羧甲基纤维素钠中配制成浓度8 mg/kg的药液,采用超声使其充分溶解,于4 ℃冰箱中保存,使用前恢复至室温并充分摇匀。②细胞实验,将SCH 粉末溶解于DMSO 中,用移液枪反复吹打至药物粉末完全溶解,配置成浓度8000 μmol/L 的母液分装放置于-20 ℃保存,避免反复冻融。使用时用完全培养基稀释为2.5 μmol/L的浓度。
(2)叶酸购自北京斯利安药业有限公司;规格0.4 mg/片;批号S181112。避光密封保存。叶酸药液配制:将叶酸药片在研磨钵中研磨成粉末状,于电子天平上精确称量,用生理盐水作为溶剂溶解,将其配制成终浓度为2.44 μg/ml的叶酸药液,再经超声进一步充分溶解,将配好的药液分装,避光保存于4℃冰箱中。使用前恢复至室温并充分摇匀。根据人(60 kg)︰小鼠(20 g)=1︰9.1确定小鼠的叶酸用药剂量为61.0 μg/kg。
(3)atRA 购自美国Sigma 公司,避光密封置于-20 ℃保存;批号WXBD1910V。atRA 混悬液配制:①动物实验中,atRA 的用药剂量为7.5 mg/kg,如小鼠体重为20 g,则注射含有atRA 粉末0.15 mg 的混悬液。精确称取atRA 粉末,用无水乙醇和橄榄油的混合液(无水乙醇体积︰橄榄油体积=8︰92)作为溶剂,将配好的药液分装,避免反复冻融,避光存储在-20℃冰箱中。使用时提前取出,恢复至室温并充分摇匀。②细胞实验,将atRA 粉末溶解于DMSO 中,用移液枪反复吹打至药物粉末完全溶解,配置成为浓度为5000 μmol/L 的母液分装、避光放置于-20 ℃保存,使用前用完全培养基稀释为2.5 μmol/L浓度。
1.1.4 试剂与仪器 磷酸化PI3K(p-PI3K)抗体(#4228S)、p-Akt 抗体(#4060)、Akt 抗体(#4685)购自美 国Cell Signaling Technology 公 司;β-actin 抗 体(AP0060)和羊抗兔IgG(ZJ2020-R)购自南京Bioworld科技有限公司。
HE 染色试剂盒(20201016)购自北京索莱宝科技有限公司;体视显微镜(EZ4D)、荧光显微镜(DM4000B LED)、冰冻切片机(CM1950)购自德国Leica公司;显微镜(DP72)购自日本OLYMPUS公司;电泳仪(PowerPacTM)、转膜仪(PowerPacTM)购自美国Bio-Rad公司;凝胶成像分析仪(Azure C300)购自美国Azure Biosystems公司。
1.2 实验分组与造模 (1)动物实验:在小鼠适应性喂养1 周后,雌鼠与雄鼠交配过夜(下午7 时至早晨7 时),次日早晨7 时取出雌鼠检查阴道栓,将有阴道栓的雌鼠随机分为对照组、模型组、叶酸组与SCH 组,每组9 只。将发现阴道栓当天中午记为胚胎(embryo,E)0.5 d(E 0.5 d)。在E 7.5 d时,除对照组外各组孕鼠腹腔注射atRA(7.5 mg/kg),对照组孕鼠给予等体积橄榄油腹腔注射;在E 0.5 d-E 11.5 d,叶酸组孕鼠持续灌胃给予叶酸[61.0 μg/(kg·d)],SCH组持续灌胃给予SCH[8.0 mg/(kg·d)]干预,对照组和模型组孕鼠则灌胃给予等体积的生理盐水。E 11.5 d麻醉脱颈处死孕鼠,剖宫产分离胚胎。
(2)细胞实验:将PC12 细胞分为对照组、模型组与SCH 组。使用atRA(20 μmol/L)处理PC12 细胞12 h,建立PC12 细胞损伤模型。在atRA 处理12 h后,使用浓度为2.5 μmol/L的SCH继续处理24 h。
1.3 指标检测
1.3.1 胎鼠NTDs 发病率 在E 11.5 d 实行剖宫产、取出胎鼠后,于体视显微镜下辨别是否发生NTDs及其畸形类型,记录、拍照并计算NTDs发病率。
1.3.2 胎鼠组织冷冻切片制备 每组随机取出整个胎鼠组织,置于1×PBS 溶液中洗涤(3 min×3 次),后置于4%多聚甲醛溶液中4 ℃固定6~12 h;置于10%、20%、30%蔗糖溶液中进行梯度脱水处理各24 h;3 d后用1×PBS 溶液洗涤,使用OCT(optimum cutting temperature)包埋胶制作整个胎鼠组织包块,置于液氮中快速冷冻,保存于-80℃冰箱,用于制作冷冻切片(于胎鼠冠状位进行7 μm 的连续切片),切片晾干后保存于-80 ℃冰箱,以备后续HE染色。
1.3.3 HE染色观察胎鼠神经管闭合情况 取出冷冻切片,按照HE染色试剂盒说明书进行HE染色操作,待切片自然晾干后中性树胶封片。在显微镜下观察各组胎鼠神经管的发育闭合情况并拍照。
1.3.4 Western blotting 检测胎鼠脑组织和PC12 细胞中p-PI3K、Akt、p-Akt蛋白表达水平 提取各组胎鼠脑组织和PC12细胞的蛋白,计算30 μg蛋白样本量,用合适的SDS-PAGE 凝胶电泳分离蛋白。电泳完毕后,将分离好的蛋白凝胶用湿转膜法转移到硝酸纤维(PVDF)膜上,5%脱脂奶粉摇床上封闭2 h;充分洗涤后分别加入相应稀释后抗体,p-PI3K 抗体(1︰1000)、p-Akt 抗体(1︰1000)、Akt 抗体(1︰1000)、β-actin 抗体(1︰5000),4 ℃孵育过夜;次日洗涤后加入相应的IgG(1︰5000),置于摇床上慢速室温孵育2 h。使用化学发光凝胶成像系统进行化学发光反应曝光条带,ImageJ软件进行灰度值比较。
1.4 统计学处理 采用GraphPad Prism 8.0 软件进行统计分析。符合正态分布的计量资料以±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。计数资料以例(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 atRA 干预孕鼠建立NTDs 胎鼠模型 体视显微镜下观察各组胎鼠形态,可见正常胎鼠后脑部及后颈部外观饱满光滑,后脑神经上皮完全融合,形成前、中、后脑泡,眼、耳泡,尾弯曲细长;atRA 干预后,部分胎鼠表现出不同的畸形类型(图1)。

图1 体视显微镜下胎鼠形态观察Fig.1 Morphology of fetus mice under stereomicroscope
2.2 SCH 对胎鼠NTDs 发病率的影响 与对照组比较,其他各组胎鼠NTDs发病率均明显升高(P<0.01);与模型组比较,叶酸组和SCH 组胎鼠NTDs 发病率降低(P<0.01);与叶酸组比较,SCH 组胎鼠NTDs 发病率降低(P<0.01,表1)。

表1 各组胎鼠NTDs发病率比较Tab.1 The incidence of NTDs in each group of mice
HE染色结果显示,对照组、SCH组、叶酸组胎鼠中脑、后脑、末脑、间脑、端脑、四脑室等各结构发育良好,外观光滑,发育状态良好;模型组胎鼠只见中脑、间脑、端脑,而后脑、末脑被破坏,神经组织外露;对照组、SCH 组、叶酸组胎鼠神经管管腔规则,闭合良好,各结构清晰,细胞排列整齐;模型组胎鼠神经管呈现未闭合状态(图2)。
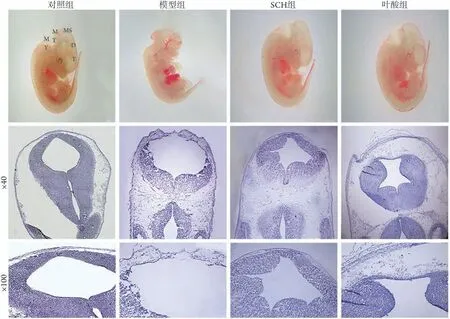
图2 各组胎鼠神经管闭合情况(HE染色)Fig.2 Neural tube closure in each group of fetal mice (HE staining)
2.3 SCH 对胎鼠脑组织中p-PI3K、Akt、p-Akt 蛋白表达的影响 Western blotting检测结果显示,与对照组比较,模型组胎鼠脑组织中p-PI3K、p-Akt 蛋白表达均明显降低(P<0.01,P<0.05);与模型组比较,叶酸组p-PI3K、p-Akt 蛋白表达差异无统计学意义(P>0.05),SCH 组p-PI3K、p-Akt 蛋白表达明显增高(P<0.05);与叶酸组比较,SCH 组p-PI3K、p-Akt 蛋白表达明显增高(P<0.05,图3)。

图3 各组NTDs胎鼠脑组织中p-PI3K、p-Akt蛋白表达水平Fig.3 Protein expression levels of p-PI3K and p-Akt in brain tissue of NTDs fetal mice in each group
2.4 SCH 对各组PC12 细胞p-PI3K、p-Akt 蛋白表达的影响 Western blotting检测结果显示,与对照组比较,模型组p-PI3K、p-Akt 蛋白表达水平明显降低(P<0.05);与模型组比较,SCH 组p-PI3K、p-Akt 蛋白表达水平明显增高(P<0.05,图4)。
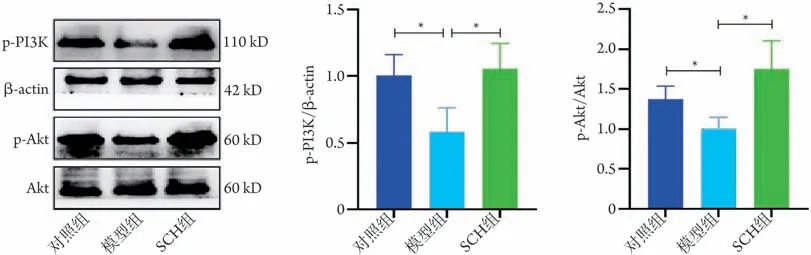
图4 各组PC12细胞中p-PI3K、p-Akt蛋白表达水平Fig.4 Protein expression levels of p-PI3K and p-Akt in each group of PC12 cells
3 讨 论
NTDs是常见的出生缺陷性疾病[16],主要包括脊柱裂(spinal bifida)、无脑儿(anencephaly)和其他畸形类型[17],在世界范围内发病率为0.5‰~2.0‰[18]。中国出生缺陷防治报告指出,我国目前出生缺陷发生率为5.6%,每年新增出生缺陷患儿约90万例,其中NTDs 占2%左右[19]。我国的NTDs 发病呈现明显的地域差异,北方地区是NTDs 的高发区,其中山西吕梁的发病率达5.57‰[20-21]。有报道指出,NTDs 患儿呈现明显的性别差异,女患儿发病率∶男患儿发病率=3∶1[22]。NTDs呈现高病死率和高致残率,患儿一般在孕期即流产,仅小部分患儿可出生,出生后大部分会在短时间内死亡,平均寿命不到1 年[23-24],是导致死胎、死产和新生儿死亡的主要诱因,给家庭和社会带来了沉重负担[25]。目前NTDs 发病机制尚不完全清楚,且其主要预防药物叶酸仍然存在不足。因此,寻找更加有效的NTDs 预防药物显得尤为重要。近年来,草本植物的提取物由于其突出的生物活性越来越受到关注。
atRA 作为一种维生素A 的生物活性形式,在神经系统发育过程中发挥重要作用[26],是诱导小鼠NTDs的常用药物[27-28]。本课题组前期研究显示,五子衍宗丸(WYP)可较好地预防atRA 诱导的NTDs 胎鼠发病[29]。大量研究显示,SCH 可发挥多种药理作用,如神经保护、抗神经细胞凋亡、抗氧化应激、增强小鼠的学习与认知能力等[30]。此外,本课题组利用网络药理学构建了“药物WYP主要单体成分—NTDs 关键靶点”网络,提示SCH 与NTDs 关系密切[31];2022年中国药典显示,SCH是WYP的主要质控成分之一[32-33]。因此,虽未有SCH预防NTDs的相关报道,但基于前期研究,推测SCH可能具有预防NTDs 的作用。本研究观察到,SCH 可明显降低atRA 诱导的NTDs 胎鼠模型的发病率,并且SCH 组胎鼠NTDs 发病率低于叶酸组,提示SCH 对胎鼠NTDs具有更好的预防作用。
NTDs的发病机制复杂,涉及多条信号通路,如PI3K/Akt 信 号 通 路[6]、经 典Wnt/β-catenin 信 号 通路[34]、平面细胞极性(planar cell polarity,PCP)信号通路[35]、骨形态发生蛋白(bone morphogenetic protein,BMP)信号通路[36]、音猬因子(sonic hedgehog,Shh)信号通路[37]、维甲酸代谢通路[38]等。其中PI3K/Akt 信号通路更受关注,被认为是神经信号转导的关键通路,与神经发育密切相关;通过激活该通路的关键分子,可增强或抑制其下游因子,进而减少NTDs的发生[6]。同时,PI3K/Akt 信号通路也是一条抗细胞凋亡保护性通路,其激活能够促进细胞增殖和抑制细胞凋亡[39],而这正与NTDs 的基本发病机制(神经细胞过度凋亡)相契合[40]。因此,激活PI3K/Akt信号通路成为多种药物治疗疾病的作用靶点[41-42]。Akt为PI3K下游重要的靶激酶,也是调节神经细胞凋亡的重要因子[43]。Akt激酶的磷酸化是PI3K/Akt信号通路被激活的主要表现[44]。事实上,SCH 通过正向激活PI3K/Akt 信号通路减轻疾病症状,已在多种神经系统疾病模型中得到验证,如SCH 激活PI3K/Akt 信号通路改善帕金森病小鼠运动障碍[45]。
本研究的小鼠体内实验结果显示,SCH 可影响PI3K/Akt 信号通路主要蛋白的表达,上调p-PI3K 和p-Akt 表达水平,降低NTDs 的发病率;采用SCH 进一步干预损伤后的神经元样细胞,可增强p-PI3K、p-Akt 的表达,提示SCH 可能激活PI3K/Akt 信号通路。由此可见,SCH 降低NTDs 发病率的作用机制可能是通过激活PI3K/Akt信号通路而实现的。
综上所述,SCH 可降低小鼠NTDs 发病率,且其预防作用优于叶酸;这种预防作用可能与激活PI3K/Akt信号通路有关。
