CysLT2受体拮抗剂HAMI3379对大鼠脑缺血损伤的保护作用及其机制
2024-01-21李明星应苗法顾胜龙赵蕊
李明星,应苗法,顾胜龙,赵蕊
浙江大学医学院附属邵逸夫医院药剂科,浙江杭州 310016
缺血性脑卒中又称为脑梗死,是临床常见的脑卒中类型,具有较高的致残率、病死率及复发率;由于其治疗时间窗窄,预后效果差,目前仍缺乏有效的治疗手段[1-2]。已有研究显示,缺血性脑损伤的发生与氧化应激损伤、炎症反应、谷氨酸的兴奋毒性、钙超载、细胞凋亡及线粒体功能紊乱相关,其中炎症反应在脑缺血损伤过程中发挥重要作用[3]。在缺血性脑损伤发生后,小胶质细胞的激活是炎症反应发生的第一步;在缺血急性期,活化的小胶质细胞能够分泌炎性因子,促进炎症反应的发生[4]。与外周巨噬细胞极化类似,小胶质细胞的激活也有M1和M2两种极化表型,M1型称为经典的激活,可促进炎症反应的发生,对神经元有损伤作用;M2型称为替代激活,对神经元有保护作用[5]。半胱氨酰白三烯2(cysteinyl leukotriene 2,CysLT2)受体是高度活化的脂质调控子,在缺血的脑组织和受损的神经元中高度表达,参与调控脑损伤的过程[6]。本课题组前期研究显示,CysLT2受体激动剂NMLTC4能够诱导小胶质细胞呈M1型激活,促进炎性因子如白细胞介素(interleukin,IL)-1β、肿瘤坏死因子(tumor necrosis factor,TNF)-α 的释放,促进神经元凋亡;CysLT2受体拮抗剂HAMI3379 可逆转小胶质细胞的M1型激活,促进其向M2型转化,抑制神经元凋亡,发挥神经保护作用[7]。本研究拟在动物水平进一步观察HAMI3379 对大鼠脑缺血损伤的保护作用,并探讨其可能的机制。
1 材料与方法
1.1 实验动物 健康成年雄性SD 大鼠30 只,体重200~250 g,购于浙江省医学科学院实验动物中心[实验动物生产许可证号:SCXK(浙)2014-0001]。动物饲养及所有动物实验均在浙江省医学科学院实验动物中心完成。本研究获浙江省医学科学院实验动物伦理委员会批准(SRRSH202102027)。
1.2 动物分组、建模与给药 将雄性SD 大鼠随机分为假手术组、模型组与HAMI3379组,每组10只。采用大脑中动脉阻断术(middle cerebral artery occlusion,MCAO)构建大鼠脑缺血损伤模型[8],具体步骤如下:SD大鼠术前称重后麻醉、固定,在颈正中部切开,暴露并分离双侧颈总动脉,结扎颈总动脉近心端,用动脉夹夹住颈总动脉的远心端并剪开一小切口,将尼龙线从切口插入,将切口用缝线轻轻扎住,然后松开颈总动脉远心端的动脉夹,将尼龙线轻轻送入颈内动脉,再送入Willian's 环,尼龙线头端距颈总动脉分叉处约1.0 cm,阻塞大脑中动脉起始部,造成大脑中动脉缺血。最后,将尼龙线固定好,缝合皮肤,消毒,将大鼠放在加热箱内保温,待其麻醉完全苏醒后放回动物饲养室。待实验到达终点,大鼠断头取脑组织,用于后续相关指标的检测。HAMI3379 组大鼠分别在MCAO 术前和术后30 min 腹 腔 注 射HAMI3379( 美 国Cayman,No.10580)0.2 mg/kg,共给药2 次;假手术组和模型组大鼠按同样时间腹腔注射生理盐水(1 ml/kg)2次。
1.3 大鼠脑缺血损伤后神经症状评分 大鼠脑缺血损伤后,参照神经症状评分标准,每组取5 只大鼠进行神经症状评分:0 分,无任何神经功能缺损症状;1 分,轻度神经功能缺损,左前爪不能完全伸直;2 分,中度神经功能缺损,向左侧行走;3 分,重度神经功能缺损,向左侧转圈;4分,不能自发行走且意识丧失。
1.4 TTC染色法观察大鼠脑梗死情况 将冷冻脑组织切成厚 2 mm 的切片,置于0.5% TTC 溶液中37 ℃避光孵育15 min,然后将切片置于多聚甲醛中固定,染成红色者为正常脑组织,染成白色者为梗死脑组织;采用 ImageJ 软件测定脑组织梗死面积,计算脑梗死体积。脑梗死体积=脑切片梗死面积×切片厚度之和。
1.5 免疫荧光染色法检测大鼠脑缺血损伤后小胶质细胞的激活情况 将脑组织切片PBS 洗3 次,3%过氧化氢室温孵育30 min,PBS洗3次,5%山羊血清室温封闭2 h,加入抗离子钙结合衔接分子1(ionized calcium binding adapter molecule 1,Iba1)抗体(英国Abcam, EPR16589,1∶100),4 ℃孵育过夜;回收一抗,加入Cy3 标记的山羊抗兔IgG (H+L)(上海碧云天,A0516,1∶200),37 ℃避光孵育 30 min;中性树脂封片;荧光显微镜下观察、拍照。
1.6 NeuN染色法观察脑缺血损伤后神经元的数量取脑组织冷冻切片用0.01 mol/L PBS 冲洗5 min×3次,山羊血清室温封闭30 min,吸水纸吸干,滴加小鼠NeuN抗体(1∶200),置于湿盒中孵育,4 ℃冰箱中过夜。用0.01 mol/L PBS 冲洗 5 min×3 次,然后加Cy3荧光素标记山羊抗小鼠IgG 二抗(1∶500)孵育2 h,PBS 洗5 min×3 次;DAPI 复染15 min,PBS 洗5 min×1次;甘油封片,荧光显微镜下观察、拍照,选取60倍油镜视野下的图片统计神经元数量。
1.7 Fluoro-Jade B 染色法观察大鼠神经元的变性情况 取脑组织切片,依次将切片放入二甲苯Ⅰ15 min、二甲苯Ⅱ 15 min、无水乙醇Ⅰ 5 min、无水乙醇Ⅱ 5 min、85%乙醇5 min、75%乙醇5 min、蒸馏水洗;0.1%冰醋酸作溶剂,配置 FJB 工作液,FJB染色4 ℃过夜;二甲苯透明1 min,中性树脂封片;荧光显微镜下观察、拍照。
1.8 Real-time PCR 检测大鼠脑组织中M1/M2 极化分子CD86、IL-1β、TNF-α、CD206、转化生长因子-β(transforming growth factor-β, TGF-β)、IL-10的mRNA 表达水平 取脑组织100 mg,用组织匀浆器研磨成匀浆,加入1 ml Trizol 裂解液和200 μl 氯仿,12 000 r/min 离心15 min,取上清加入等体积的异丙醇,10 000 r/min 离心10 min,去上清并加入75%乙醇洗1 次,7500 r/min 离心5 min,加入100 μl DEPC水溶解。设计并合成 M1/M2 表型基因引物 (表1),引物由生工生物工程(上海)股份有限公司合成。按照试剂盒说明书进行反转录和扩增实验;以GAPDH作为内参对照基因,以2-ΔΔCt法处理结果数据。

表1 Real-time PCR引物序列Tab.1 Primer sequences for real-time PCR
1.9 Western blotting 检测大鼠脑组织中CysLT2受体蛋白和核因子κB(nuclear factor kappa-B,NF-κB)相关的蛋白激酶Cα(protein kinase Cα,PKCα)、NF-κB 抑制蛋白(inhibitor of NF-κB,IκBα)、p65 蛋白和p50 蛋白的表达水平 取脑组织100 mg,加入500 μl RIPA裂解液(上海碧云天,P0013B),采用组织匀浆器研磨,冰上裂解30 min,12 000 r/min 离心15 min,收集上清,采用BCA 试剂盒进行定量(上海碧云天,P0009);取30 mg 蛋白样品与上样缓冲液混合,行SDS-聚丙烯酰胺凝胶电泳,转膜,5%脱脂奶粉室温封闭2 h,加入兔抗CysLT2(英国Abcam,1∶500)、PKCα( 美 国Proteintech, 1∶1000)、 IκBα( 美 国Proteintech,1∶1000)、p65(美国Proteintech,1∶1000)抗体,4 ℃孵育过夜;加入山羊抗兔IgG二抗常温孵育1 h,TBST 洗膜,显影、定影;采用ImageJ 软件对蛋白条带进行灰度分析。
1.10 统计学处理 采用 SPSS 19.0 软件进行统计分析。计量资料符合正态分布时以±s表示,多组间比较采用单因素方差分析(One-Way ANOVA),进一步两两比较采用Tukey 检验;神经症状评分数据采用非参数Kruskal-Wallis(K-W)检验[7]。P<0.05 为差异有统计学意义。
2 结 果
2.1 脑缺血损伤后大鼠神经症状评分变化 大鼠脑缺血损伤模型构建成功24 h 后,对各组大鼠神经症状进行评分,结果显示,与假手术组比较,模型组大鼠神经症状评分明显增高(P<0.05);与模型组比较,HAMI3379组大鼠神经症状评分明显降低(P<0.05,图1)。
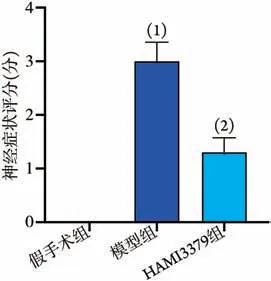
图1 脑缺血损伤后各组大鼠神经症状评分(±s,n=5)Fig.1 The neurological symptom scores in each group of rats after cerebral ischemic injury (±s, n=5)
2.2 各组大鼠脑缺血后脑梗死体积比较 大鼠脑缺血损伤后,缺血一侧大脑半球能够观察到明显的梗死区,提示脑缺血损伤模型构建成功。脑冠状切片的 TTC 染色结果显示,正常脑组织呈红色,梗死区呈白色(图2)。与假手术组比较,模型组大鼠脑梗死体积明显增大(P<0.05);与模型组比较,HAMI3379组大鼠脑梗死体积明显缩小(P<0.05)。

图2 HAMI3379对大鼠脑缺血后脑梗死体积的影响Fig.2 Effects of HAMI3379 on cerebral infarct volume in rats
2.3 HAMI3379 对脑缺血损伤后小胶质细胞激活的影响 Western blotting 检测结果显示,脑缺血损伤后,与假手术组比较,模型组大鼠脑组织中CysLT2蛋白表达水平明显增高(P<0.05);与模型组比较,HAMI3379 组CysLT2蛋白表达水平明显降低(P<0.05,图3A)。免疫荧光染色检测结果显示,与假手术组比较,模型组大鼠脑组织小胶质细胞标志分子Iba1 阳性细胞数明显增多(P<0.05);与模型组比较,HAMI3379 组小胶质细胞Iba1 阳性细胞数明显减少(P<0.05,图3B)。
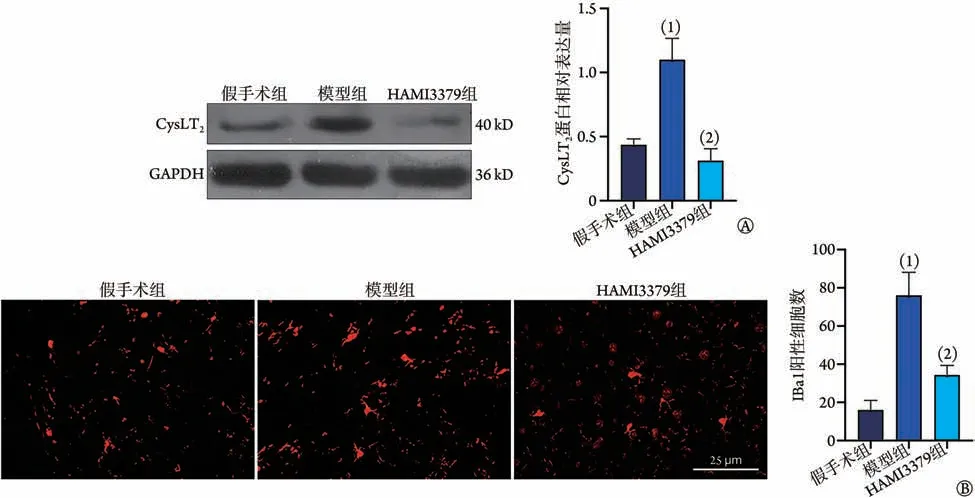
图3 大鼠脑缺血损伤后脑组织中CysLT2表达水平和Iba1阳性细胞数的变化(±s,n=3)Fig.3 The expression of CysLT2 and count of Iba1 positive cells in brain tissue of rats after cerebral ischemia injury (±s, n=3)
2.4 HAMI3379 对大鼠脑缺血损伤后小胶质细胞M1/M2 极化分子 mRNA 表达的影响 Real-time PCR法检测显示,与假手术组比较,模型组M1/M2极化表 型 分 子CD86、IL-1β、TNF-α、CD206、TGF-β、IL-10的mRNA 表达均明显上调(P<0.05,图4);与模型组比较,HAMI3379 组M1 极化分子CD86、IL-1β、TNF-α的mRNA 表达均明显下调(P<0.05),M2 极化表型分子CD206、TGF-β、IL-10的mRNA 表达均明显上调(P<0.05)。

图4 HAMI3379对大鼠脑缺血损伤后小胶质细胞 M1/M2 极化分子 mRNA 表达的影响(±s,n=5)Fig.4 Effects of HAMI3379 on mRNA level of M1/M2 polarized phenotype molecules in rat`s microglia after cerebral ischemia injury (±s,n=5)
2.5 HAMI3379 对大鼠脑缺血损伤后神经元数量及变性情况的影响 NeuN染色结果显示,神经元胞质被染成红色,细胞核呈蓝色,与假手术组比较,模型组神经元数量明显减少(P<0.05,图5A);与模型组比较,HAMI3379组神经元数量明显增多(P<0.05)。Fluoro-Jade B 染色结果显示,变性神经元胞体和轴突或树突呈绿色荧光;与假手术组比较,模型组变性神经元数量明显增多(P<0.05);与模型组比较,HAMI3379 组变性神经元数量明显减少(P<0.05,图5B)。
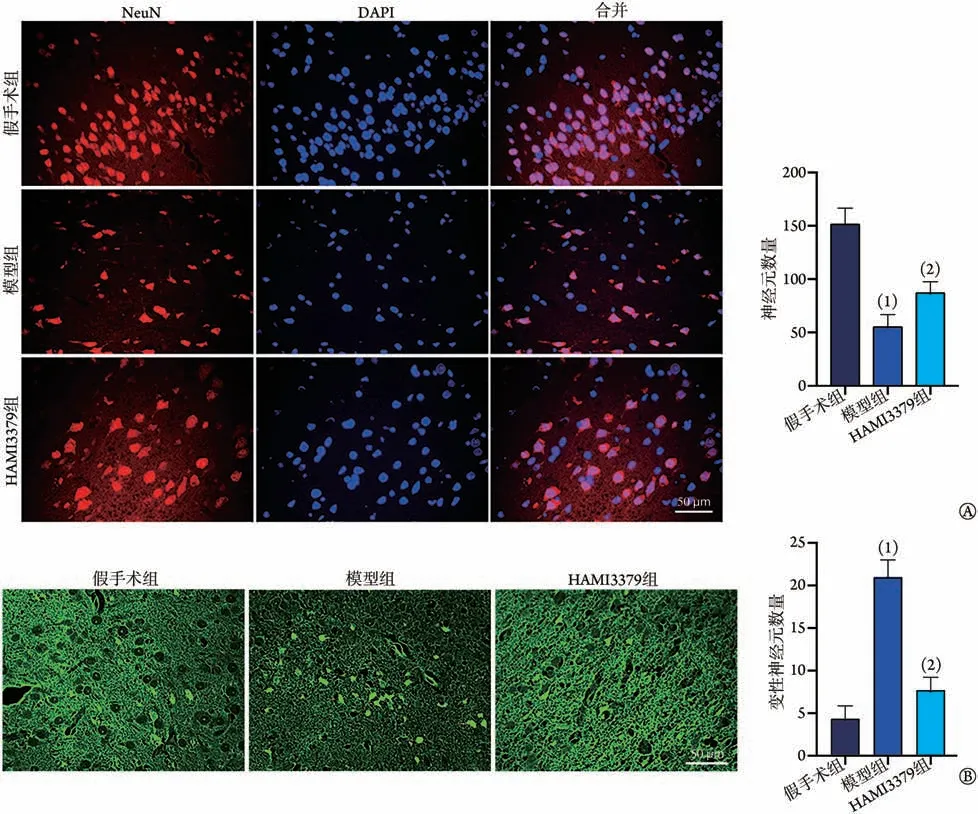
图5 HAMI3379 对大鼠脑缺血损伤后神经元数量及变性情况的影响(±s,n=3)Fig.5 Effects of HAMI3379 on the number and degeneration of neurons in rats after cerebral ischemia injury (±s, n=3)
2.6 HAMI3379对大鼠脑缺血损伤后脑组织中PKCα/IκBα/NF-κB 信 号 通 路 蛋 白 表 达 的 影 响 Western blotting 检测结果显示,与假手术组比较,模型组大鼠脑组织中PKCα、IκBα、p65、p50 蛋白的表达均明显上调(P<0.05);与模型组比较,HAMI3379 组大鼠脑组织中PKCα、IκBα、p65、p50 蛋白的表达均明显下调(P<0.05,图6)。

图6 HAMI3379 对大鼠脑缺血损伤后脑组织中PKCα/IκBα/NF-κB信号通路蛋白表达的影响(±s,n=3)Fig.6 Effects of HAMI3379 on protein expression of PKCα/IκBα/NF-κB signaling pathway in rat's brain after cerebral ischemia injury (±s, n=3)
3 讨 论
5-脂氧酶产物CysLT 是一类重要的炎性介质,在外周和中枢神经系统均可发挥调节作用。CysLT受体可分为CysLT1和CysLT2受体,均属于G 蛋白偶联受体[9]。CysLT1受体分布于支气管、肺、鼻黏膜及外周血白细胞、肥大细胞等组织和细胞,在脑内分布较少,正常情况下仅在脑微血管内皮细胞表达;CysLT2受体除表达于人外周血白细胞、脾和淋巴结外,还特异性地表达于心脏、肾上腺和脑[10]。既往研究显示,CysLT2受体在人、大鼠、小鼠脑内均有表达;在人脑,CysLT2受体主要表达于血管平滑肌细胞,在脑外伤及肿瘤时,CysLT2受体表达增强;在大鼠脑内,CysLT2受体主要表达于大脑皮层和脑室周围的星形胶质细胞,局灶性脑缺血后,CysLT2受体表达上调;另外,在小鼠脑缺血损伤模型中,CysLT2受体的表达也显著上调[11-12]。本研究探究HAMI3379 对CysLT2受体的表达是否有影响,结果显示,HAMI3379 可显著下调CysLT2受体的表达。有研究显示,在大鼠脑缺血损伤模型构建前后30 min,脑内注射CysLT2受体shRNA 或腹腔注射CysLT2受体选择性拮抗剂HAMI3379 可抑制CysLT2受体功能,脑损伤变化观察结果显示,两者均可改善大鼠局灶性脑缺血后神经功能缺陷,减少脑梗死体积,减轻神经元损伤;两者对神经损伤保护作用的有效时间窗是缺血后0~1 h,且两次给药比单次注射HAMI3379 效果更好,HAMI3379 腹腔注射给药可剂量依赖性改善大鼠脑缺血后的神经功能损伤[13]。因此,本研究在探究HAMI3379 对脑缺血损伤的保护作用时,采取MCAO 术前和术后两次腹腔注射HAMI3379。
既往研究显示,CysLT2受体并不直接介导神经元损伤,而是通过激活小胶质细胞间接介导神经元损伤;大鼠脑缺血损伤24 h后,小胶质细胞被激活,IL-1β、TNF-α、γ干扰素(interferon-γ,IFN-γ)的表达量增加;HAMI3379能够抑制缺血中心区小胶质细胞活化及中性粒细胞聚集,减轻炎症反应及神经元损伤[11]。在小鼠创伤性脑损伤早期,小胶质细胞与巨噬细胞中M1/M2极化表型分子均显著表达,随着损伤时间的延长,M2 极化表型的小胶质细胞不断增多,逐渐取代M1极化表型的小胶质细胞,发挥抗炎作用[14-15]。在缺血缺氧的小鼠模型中,缺血诱导小鼠小胶质细胞呈M1型极化激活,促进炎性因子释放及加重组织损伤;而抑制小胶质细胞的M1型极化激活,增加M2型极化相关基因的表达,可抑制炎性因子释放及减轻组织损伤[16-17]。另有研究显示,在大鼠缺血再灌注损伤1~8 周,免疫荧光染色观察显示CD68+/Iba1、CD206+/Iba1 比值增大,小胶质细胞呈M1 型极化,脑血流循环不足,发生慢性灌注损伤[18]。
本研究在大鼠脑缺血损伤模型中观察到,脑缺血损伤后,大鼠脑组织缺血中心区小胶质细胞标志分子Iba1 表达增加,小胶质细胞被激活;小胶质细胞M1 和M2 极化表型分子的mRNA 表达均明显上调;HAMI3379 可抑制M1 极化表型分子mRNA 表达上调,增加M2极化表型分子mRNA的表达,促进小胶质细胞由M1向M2极化表型转化,且抑制神经元变性及神经元数量的减少。Zhao 等[19]研究显示,抑制CysLT2受体表达及ERK1/2磷酸化,可抑制小胶质细胞的M1 型极化,增加M2 型小胶质细胞的数量,以及缺血半球皮质和海马中抗炎细胞因子及神经营养因子的生成,减轻脑缺血损伤。在原代小胶质细胞和BV-2细胞系水平,CysLT2受体能够直接调控小胶质细胞的M1 与M2 型极化,CysLT2受体激动剂NMLTC4可诱导小胶质细胞呈M1型极化激活,促进炎性因子IL-1β、TNF-α 的释放,增加其吞噬功能,促进神经元的凋亡;HAMI3379 可抑制M1 极化分子的表达,上调M2极化分子的表达,抑制炎性因子释放及吞噬功能,减少神经元凋亡,发挥神经保护作用。
本研究存在一定的局限性。研究显示,大鼠脑缺血损伤后,脑组织中PKCα、IκBα、p65、p50 蛋白的表达明显上调,PKCα/IκBα/NF-κB 信号通路呈活化状态;而HAMI3379 可抑制上述蛋白的表达,改善脑缺血损伤,提示CysLT2受体可能通过调控PKCα/IκBα/NF-κB 信号通路介导大鼠脑缺血损伤;但在动物水平,未能将CysLT2受体沉默或使用NFκB 抑制剂Bay11-7082 干预,探究HAMI3379 对脑缺血损伤的调控作用,后续研究将进一步深入探究。
综上所述,本研究从动物水平探究了CysLT2受体拮抗剂HAMI3379 对小胶质细胞M1/M2 极化表型的调控作用,结果表明,其可能通过PKCα/IκBα/NF-κB 信号通路调控小胶质细胞极化表型的转化,抑制小胶质细胞的M1型极化激活,促进其由M1向M2型转变,抑制神经元变性,发挥神经保护作用。
