抗虫转基因水稻及其杂交水稻对土壤微生物群落多样性与组成的影响*
2024-01-20宋亚娜陈在杰胡太蛟吴明基
宋亚娜,陈在杰,林 艳,胡太蛟,吴明基,王 锋
(福建省农业科学院生物技术研究所/福建省农业遗传工程重点实验室 福州 350003)
根据国际农业生物技术应用服务组织(ISAAA)报告显示: 在转基因商业化的23 年中(1996—2018 年),转基因作物为全球带来了2249 亿美元的经济效益,惠及1600 万~1700 万农民;2019 年29 个国家种植了1.904 亿hm2的转基因作物,比1996 年增加了约112 倍[1]。2019 年我国转基因作物种植面积320 万hm2,世界排名第七,种植作物主要为棉花(Gossypiumspp.)和木瓜(Chaenomeles sinensis)。2020—2022 年,农业农村部已陆续批准了多个转基因玉米(Zea mays)材料生产应用的安全证书,转基因玉米将很快加入到我国转基因作物商业化种植中。可见,在保障粮食安全的前提下,转基因作物的研发应用十分有意义,但转基因作物一定要经过安全评价,在严格监管、依法依规、确保安全的原则下推进生产应用。种植转基因作物对土壤微生物群落组成及功能的影响,是其环境安全性评价的重要内容。土壤是生命赖以生存的基础,微生物群落多样性直接关系到土壤物质、能量循环和土壤生态系统的稳定性与可持续性。
抗虫转基因水稻(Oryza sativa)是主要研发的水稻转基因作物之一。对稻田土壤微生物群落组成与功能的研究,可为抗虫转基因水稻的环境安全评价提供理论依据。研究表明,不同植物的根系分泌物组成和数量的差异,影响了土壤微生物的群落组成及功能[2-5]。转基因作物所含有的外源基因及其表达产物,可通过根系分泌物和作物残留物进入农田土壤,与土壤微生物发生互作后可能改变土壤微生物群落的多样性及其功能[6-7]。苏云金芽孢杆菌(Bacillus thuringiensis)杀虫蛋白Bt基因对鳞翅目(Lepidoptera)害虫具有较高的抗性,已被广泛应用到水稻、棉花、玉米、油菜(Brassica campestris)等多种转基因作物中[8]。多年来,有关转Bt基因抗虫作物对土壤微生物群落影响的研究结果并不一致。如抗虫转基因棉花种植过程中可令土壤可培养细菌或真菌的多样性及丰度产生变化[9],抗虫转基因玉米残体对土壤细菌群落也能产生一定影响[10]等;也有研究表明,转Bt基因水稻秸秆还田降解对稻田土壤细菌和真菌群落没有显著影响[11-12],cry1Ac/cpti抗虫转基因水稻连续种植4 年后对稻田土壤细菌或真菌的群落组成及丰度也没有显著影响[13]。
以往关于转基因植物对土壤微生物群落影响的研究存在不同结果,部分原因在于土壤微生物群落组成极其复杂且功能高度冗余,研究在一定程度上受到了检测技术的限制。近年来,高通量测序技术的发展实现了大规模的土壤微生物基因测序,为研究土壤微生物的种类、结构和多样性提供了丰富的信息[14-15]。高通量测序在稻田微生物多样性的研究中已大量应用,如在生物黑炭对红壤稻田根际微生物影响的研究中发现,一些对植物生长有益的促生菌有增加的趋势[16];采用高通量测序技术发现轮作土壤微生物丰富度远高于连作[17];对细菌16S rRNAV3-V4 区的高通量测序结果显示,转Hvsusiba2基因的低甲烷排放水稻的土壤细菌群落组成与野生型水稻存在差异[18]等。目前,对抗虫转基因水稻土壤微生物群落组成及功能的研究还不够深入,通过对细菌16S rRNA基因和真菌ITS基因的高通量测序分析,能够较全面地揭示稻田土壤微生物的群落组成、多样性及功能,从而深入探讨抗虫转基因水稻对土壤微生物群落的影响及其意义。
本研究对转cry1Ab基因的抗虫转基因水稻及以其为亲本的抗虫转基因杂交水稻的土壤细菌及真菌进行高通量测序分析,明确不同抗虫转基因水稻、非转基因常规水稻及杂交水稻的土壤细菌和真菌的群落组成、多样性及功能的差异,为抗虫转基因水稻的环境安全评价提供理论依据。
1 材料与方法
1.1 田间试验
本研究在位于福建省福州市前洋村(26°11′N,119°16′E)的福建省农业科学院的试验站进行。田间试验经过农业农村部农业转基因生物安全管理办公室的生产性试验安全审批: 农基安审字 (2020)第195 号。试验设置6 个水稻品种处理,分别为: ‘闽丰A/MFB’ ‘天丰A/MFB’ ‘谷丰A/MFB’ ‘天优华占’‘MFB’和‘闽恢3301’。其中,‘闽恢3301’为籼型常规水稻,‘MFB’是‘闽恢3301’背景的无选择标记转cry1Ab抗虫转基因水稻恢复系,‘天优华占’ (国审稻2008020)为籼型三系杂交水稻,‘闽丰A/MFB’ ‘天丰A/MFB’ ‘谷丰A/MFB’分别为籼型不育系‘闽丰1A’‘天丰A’ ‘谷丰A’与恢复系‘MFB’的杂交组合水稻。试验每个处理重复3 次,共18 个田间小区随机排列,小区面积为20 m2。水稻栽培的肥水和田间管理按当地常规进行,且所有处理均不打抗虫农药。供试土壤为红壤,基本理化性状如下: 有机质20.01 g·kg−1、pH 6.28、全 氮0.92 g·kg−1、全磷0.73 g·kg−1、全钾18.47 g·kg−1、碱解氮70.93 mg∙kg−1、有效磷57.70 mg·kg−1和速效钾31.67 mg·kg−1。田间试验于2022年5 月初播种,6 月初插秧,9 月中旬收获。
1.2 土壤样品采集
分别于水稻分蘖期、齐穗期和成熟期采集稻田土壤,在每个小区内采用五点取样法取耕层(0~20 cm)土壤,将5 点采集的土壤混合为1 个样品。田间采集的土样放入冰盒中保存送至实验室,然后去除根系、杂草、土壤动物和石块等杂质后混匀,于−70 ℃冷冻保存,随后用于土壤微生物分析。
1.3 土壤微生物DNA 提取
土壤微生物总DNA 提取采用FastDNA SPIN Kit(For Soil) (QBIOgene)的试剂盒方法,称取0.5 g 解冻后的土壤样品,按试剂盒的试验步骤进行土壤微生物总DNA 提取,DNA 样品于−20 ℃冰箱保存待用。
1.4 土壤微生物的高通量测序
将冻存的稻田土壤DNA 样品用干冰包装后,寄送至上海派森诺生物科技股份有限公司进行微生物基因高通量测序。分别利用通用引物338F: ACTCCTACGGGAGGCAGCAG/806R: GGACTACHVGGGTWTCTAAT 和F: GGAAGTAAAAGTCGTAACAAGG/R: GCTGCGTTCTTCATCGATGC 对细菌16S rRNA的V3-V4 区和真菌ITSV1 区进行扩增[10],PCR 反应体系为: 2x Premix Taq 25 μL、正向反向引物 (10 mmol·L−1) 各1 μL、DNA (20 ng∙μL−1) 3 μL、无菌水补至50 μL。PCR 扩增条件为: 细菌94 ℃预变性5 min,94 ℃ 30 s,52 ℃ 30 s 和72 ℃ 30 s;真菌98 ℃预变性3 min,98 ℃ 15 s,50 ℃ 30 s 和 72 ℃ 30 s;均进行35 个循环,最后72 ℃延伸10 min。采用Illumina 测序平台进行测序,使用QIIME2 (2019.4) 软件包对原始序列进行分析[19]。通过DADA22 和Vsearch 方法进行序列去噪和聚类,在97%相似度水平对高质量序列聚类,获得门、纲、目、科和属各水平下的分类单元。利用QIIME (2019.4)软件计算微生物群落α-多样性指数,包括物种丰富度指数Chao1 和Observed_species,多样性指数Shannon 指数和Simpson 指数及均匀度指数Pielou_e;并进行群落β-多样性分析,依据Bray-Curtis 距离进行群落组成的主坐标分析、绘制距离矩阵与PCoA 分析的二维散点图,同时进行样品间的PERMANOVA、Anosim 和Permdisp 等差异显著性检验[20],用R (v3.2.0)语言、pheatmap (1.0.12)软件包使用平均丰度前20 位属的丰度数据绘制物种组成热图。使用PICRUSt2 (2.2.0)软件进行群落功能预测,并依据Bray-Curtis 距离绘制功能单元PCoA 分析的二维散点图。
1.5 水稻考种
收获时各小区取5 株水稻进行考种,测定有效穗数、结实率、千粒重、单株产量等性状。
1.6 数据分析
使用 Microsoft Excel 2007 软件进行数据处理及绘图,利用SPSS 17.0 软件进行处理间的单因素方差分析 (one-way ANOVA)及LSD 0.05 水平的显著性检验。
2 结果与分析
2.1 水稻产量性状
本研究分析了田间试验中不同品种水稻的有效穗数、结实率、千粒重及单株产量等性状,如表1所示。不同品种水稻的千粒重差异不显著,此外仅‘谷丰A/MFB’的有效穗数较低,但结实率和单株产量差异较为明显。其中,抗虫转基因水稻‘MFB’的结实率和单株产量都显著高于非转基因水稻‘闽恢3301’ (P<0.05),杂交水稻‘天优华占’的结实率和单株产量与‘闽恢3301’差异不显著,但抗虫转基因杂交水稻‘闽丰A/MFB’ ‘天丰A/MFB’和‘谷丰A/MFB’的结实率和单株产量均显著高于‘天优华占’或‘闽恢3301’(P<0.05),且‘闽丰A/MFB’和‘天丰A/MFB’的结实率和单株产量还显著高于‘MFB’ (P<0.05)。上述结果表明抗虫转基因水稻及其杂交水稻都能显著提高水稻产量。
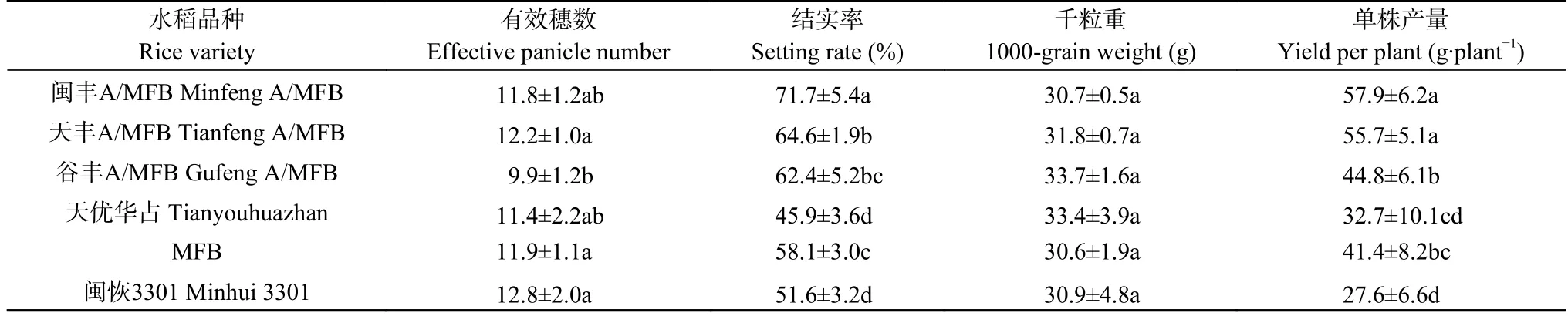
表1 不同品种水稻的产量性状Table 1 Yield characteristics of different rice varieties
2.2 水稻土壤微生物群落的多样性
表2 为稻田土壤细菌群落的α-多样性指数,在水稻分蘖期、齐穗期及成熟期,抗虫转基因水稻‘MFB’土壤细菌群落的物种丰富度指数Chao1 和Observed_species 及多样性指数Shannon 均高于非转基因水稻‘闽恢3301’或杂交水稻‘天优华占’,且Observed_species 指数的差异均达到显著性水平(P<0.05),水稻成熟期丰富度指数Chao1 和多样性指数Shannon 的差异也达显著水平(P<0.05);水稻各生育期内3 个转基因杂交水稻‘闽丰A/MFB’ ‘天丰A/MFB’和‘谷丰A/MFB’土壤细菌群落的物种丰富度指数Chao1 和Observed_species 与‘天优华占’无显著差异;但与‘天优华占’比较,‘闽丰A/MFB’的土壤细菌群落多样性指数Shannon 在水稻齐穗期时显著提高(P<0.05),而成熟期时显著降低(P<0.05);水稻成熟期3 个转基因杂交水稻土壤细菌群落的Chao1 和Observed_species 及Shannon 均显著低于‘MFB’ (P<0.05);水稻分蘖期及成熟期‘MFB’土壤细菌群落的多样性指数Simpson 均显著高于‘闽恢3301’(P<0.05),但齐穗期时显著低于‘闽恢3301’ (P<0.05);与水稻分蘖期和成熟期比较,齐穗期不同品种水稻土壤细菌群落的Simpson 和Pielou_e 指数的差异较大。
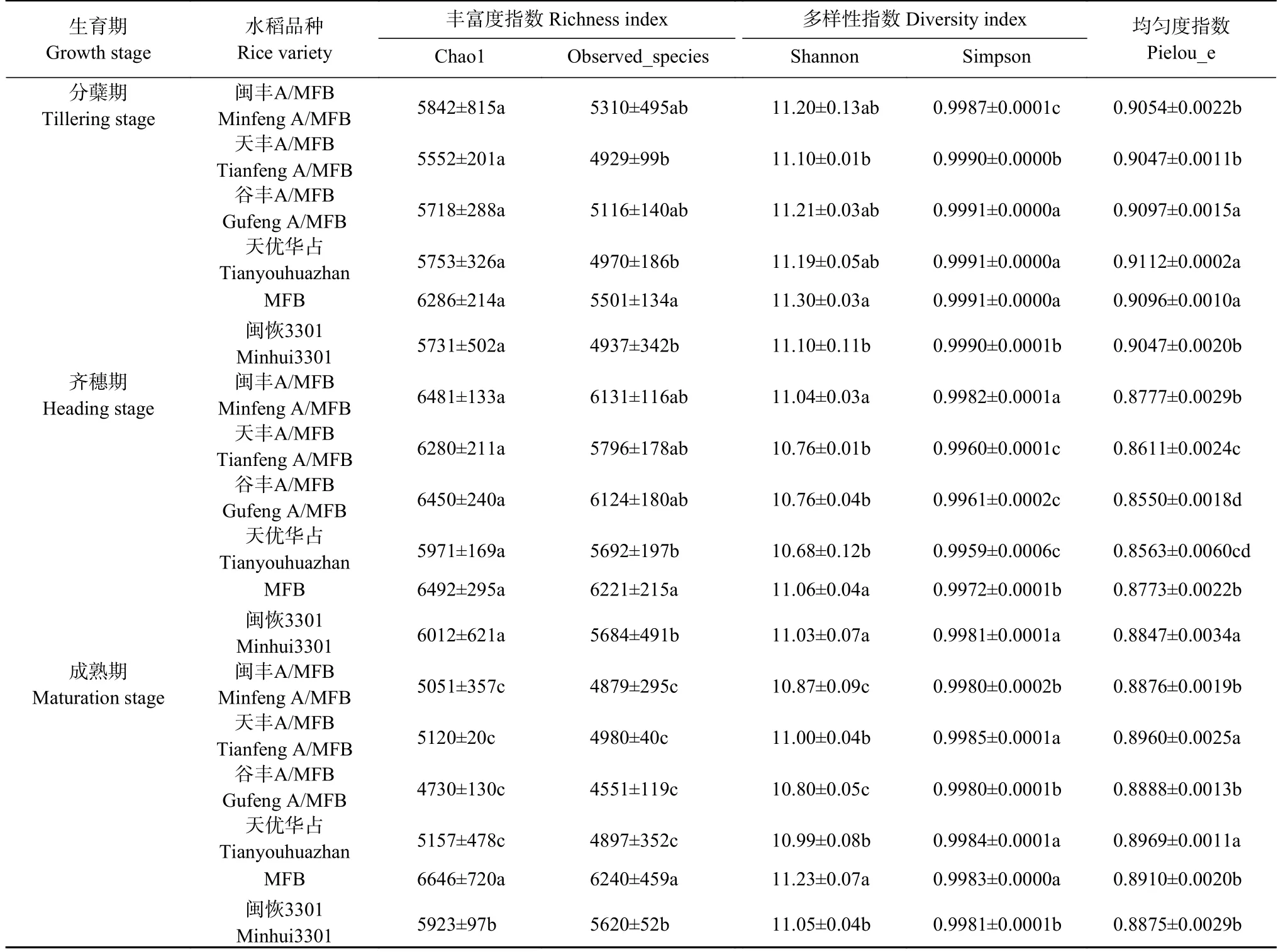
表2 不同品种水稻不同生育期稻田土壤细菌群落的α-多样性指数Table 2 Alpha diversity indexes of bacterial communities in paddy soils at different growth stages of different rice varieties
由此可见,抗虫转基因水稻‘MFB’土壤细菌群落多样性高于非转基因水稻‘闽恢3301’或杂交水稻‘天优华占’,水稻成熟期前者的物种丰富度指数Chao1和Observed_species 及多样性指数Shannon、Simpson均显著高于后二者(P<0.05);此外,在水稻齐穗期转基因杂交水稻‘闽丰A/MFB’ ‘天丰A/MFB’和‘谷丰A/MFB’土壤细菌群落的物种丰富度指数Chao1 和Observed_species 及多样性指数Shannon 均介于‘MFB’与‘天优华占’之间。
稻田土壤真菌群落的α-多样性指数如表3 所示,水稻分蘖期抗虫转基因水稻‘MFB’土壤真菌群落的物种丰富度指数Chao1 和Observed_species、多样性指数Shannon 和Simpson 及均匀度指数Pielou_e 均显著高于(P<0.05)非转基因水稻‘闽恢3301’,但水稻齐穗期和成熟期二者差异不显著;水稻齐穗期‘MFB’土壤真菌群落的各项α-多样性指数均显著高于(P<0.05)杂交水稻‘天优华占’及3 个转基因杂交水稻‘ 闽丰A/MFB’ ‘ 天丰A/MFB’和‘ 谷丰A/MFB’,且‘天丰A/MFB’和‘谷丰A/MFB’的土壤真菌群落的Chao1、Observed_species 及Shannon 指数显著高于‘天优华占’(P<0.05);水稻成熟期仅‘天丰A/MFB’土壤真菌群落的物种丰富度指数Chao1、Observed_species 和多样性指数Shannon 显著低于(P<0.05) ‘天优华占’,且其丰富度指数Chao1 和Observed_species 也显著低于‘MFB’(P<0.05)。此外,水稻齐穗期和成熟期土壤真菌群落的物种丰富度指数Chao1 和Observed_species 显著高于水稻分蘖期(P<0.05),齐穗期和成熟期的这2 个指数是分蘖期的3~4 倍。
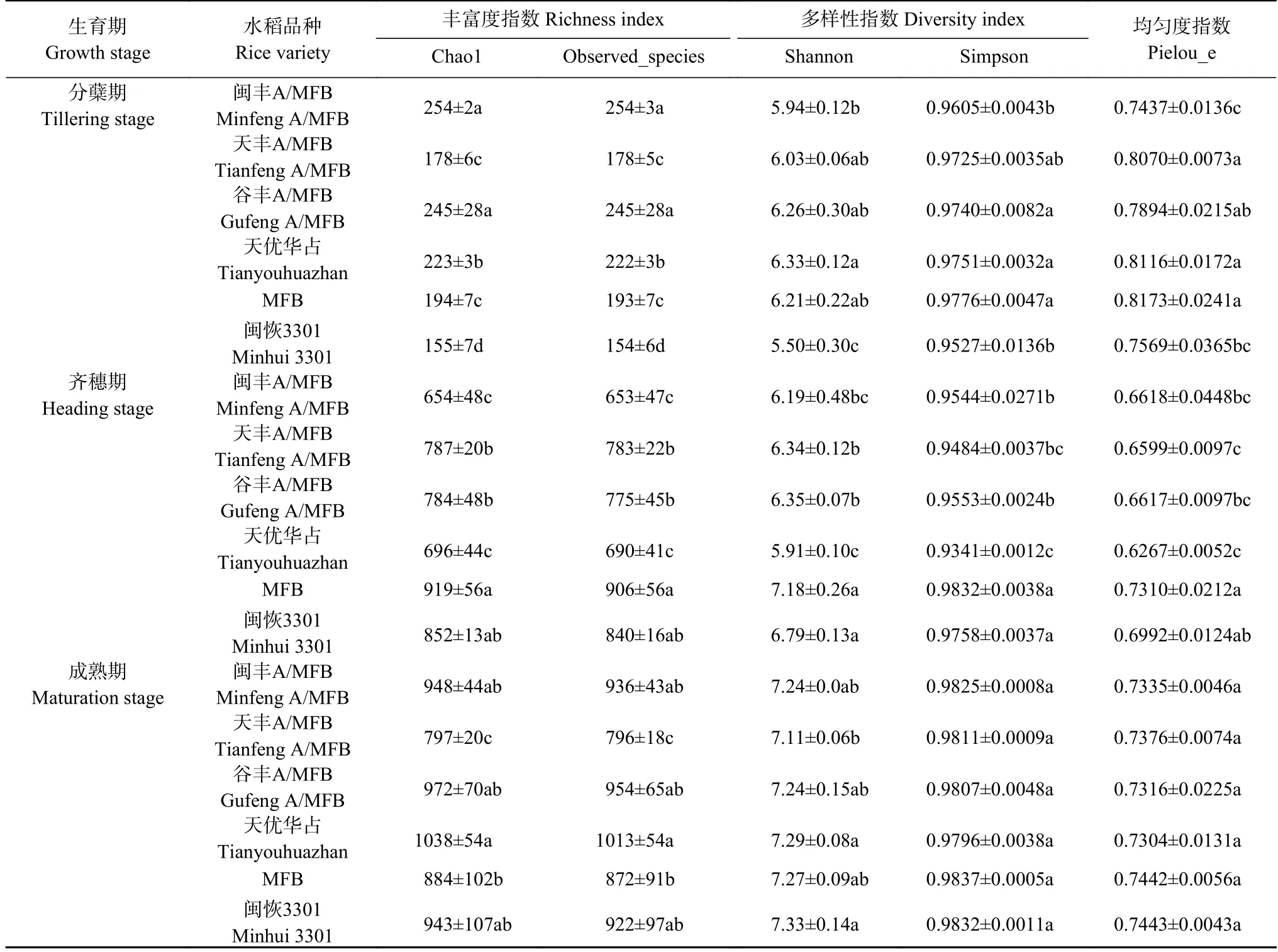
表3 不同品种水稻不同生育期稻田土壤真菌群落的α-多样性指数Table 3 Alpha diversity indexes of fungal communities in paddy soils at different growth stages of different rice varieties
由此可见,水稻分蘖期的抗虫转基因水稻‘MFB’土壤真菌群落的α-多样性指数显著高于非转基因水稻‘闽恢3301’ (P<0.05),但随水稻生长差异缩小;水稻齐穗期‘MFB’土壤真菌群落的α-多样性指数与杂交水稻‘天优华占’间差距较大,且转基因杂交水稻‘闽丰A/MFB’ ‘天丰A/MFB’和‘谷丰A/MFB’土壤真菌群落的多样性指数Shannon 和Simpson 及均匀度指数Pielou_e 均介于‘MFB’与‘天优华占’之间,‘天丰A/MFB’和‘谷丰A/MFB’土壤真菌群落的丰富度指数Chao1 和Observed_species 指数也介于‘MFB’与‘天优华占’之间。
不同品种水稻土壤细菌及真菌群落的β-多样性以主坐标分析散点图的形式进行展示(图1 和图2)。水稻分蘖期时,仅抗虫转基因杂交水稻‘闽丰A/MFB’的土壤细菌群落组成散点在主坐标1 (PCo1)坐标轴上的投影与其他品种水稻的投影距离较远,说明其土壤细菌群落组成与其他品种水稻存在一定差异;水稻齐穗期,‘天丰A/MFB’ ‘谷丰A/MFB’及‘天优华占’的土壤细菌群落组成散点分布较为聚集,说明其土壤细菌群落组成较为相似,但上述三者与‘闽丰A/MFB’ ‘闽恢3301’及‘MFB’间的细菌群落组成散点在PCo1 坐标轴上均存在一定投影距离,说明其土壤细菌群落组成存在一定差异;水稻成熟期‘MFB’在PCo1 坐标轴上的投影仍与‘闽恢3301’的投影存在一定距离,但‘闽丰A/MFB’ ‘天丰A/MFB’ ‘谷丰A/MFB’及‘天优华占’的散点分布集中,且在PCo1 方向上远离‘MFB’及‘闽恢3301’,说明3 个转基因杂交水稻的土壤细菌群落组成与杂交水稻‘天优华占’比较接近,但与‘MFB’及‘闽恢3301’均存在差异,抗虫转基因水稻‘MFB’与非转基因水稻‘闽恢3301’间也存在一定差异。但是,进一步进行组间差异分析的PERMANOVA、Anosim 和Permdisp 等显著性检验结果表明,在水稻各生育期不同品种水稻的土壤细菌群落组成间的差异均没有达到显著性水平。
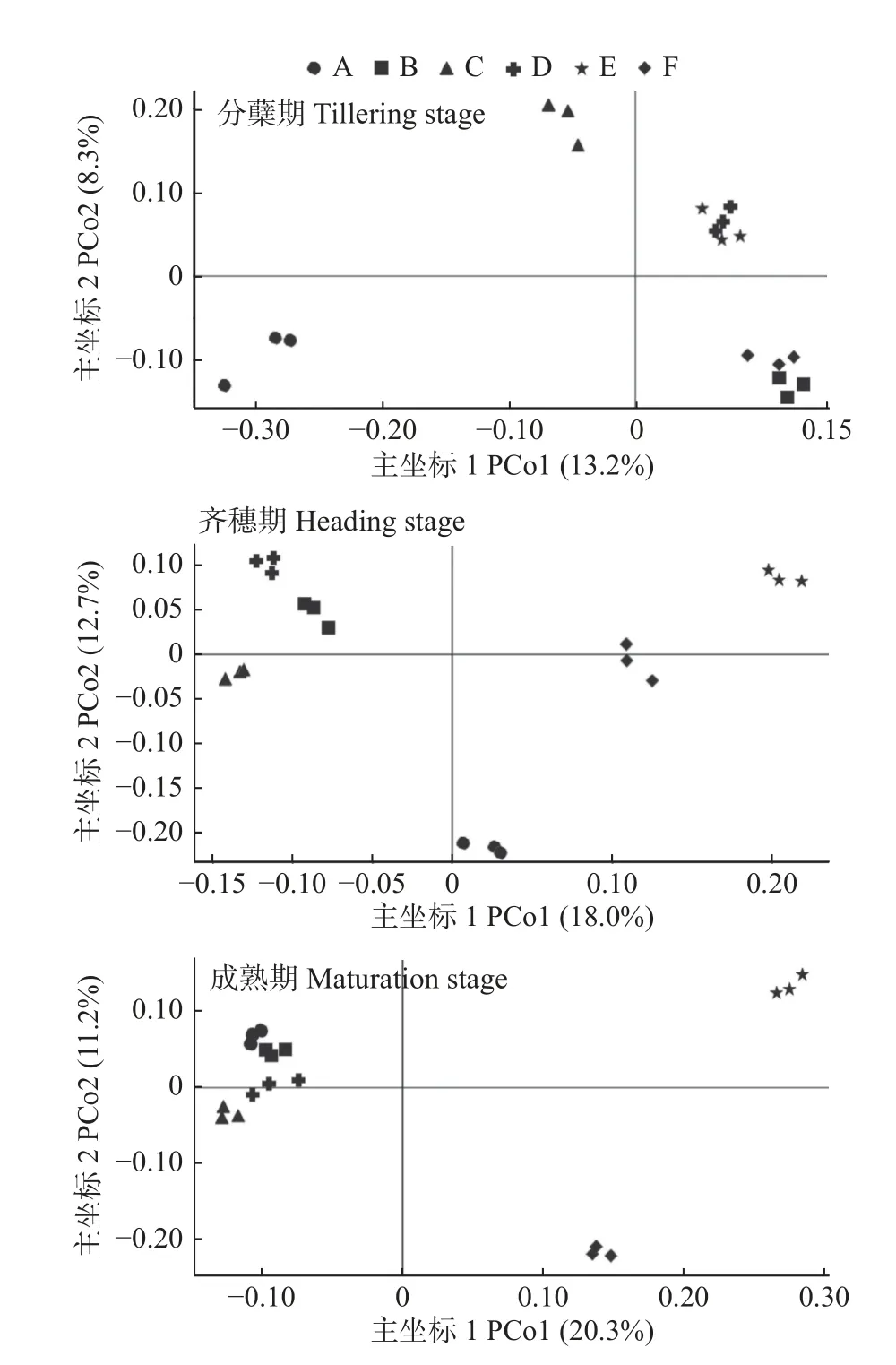
图1 不同品种水稻不同生育期稻田土壤细菌群落β-多样性的主坐标分析Fig.1 Principal co-ordinates analysis for beta diversity of bacterial communities in paddy soils at different growth stages of different rice varieties
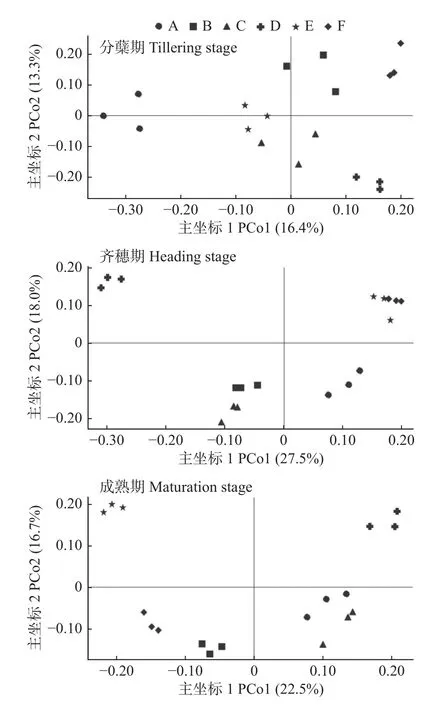
图2 不同品种水稻不同生育期稻田土壤真菌群落β-多样性的主坐标分析Fig.2 Principal co-ordinates analysis for beta diversity of fungal communities in paddy soils at different growth stages of different rice varieties
图2 为稻田土壤真菌群落组成的主坐标分析,水稻分蘖期主坐标散点图的主坐标1 (PCo1)与主坐标2 (PCo2)的解释度分别为16.4%和13.3%,二者十分接近,表明不同处理在 PCo1 与PCo2 方向上的分布差异接近;不同品种水稻各重复散点分散分布,表明其土壤真菌群落组成间差异不大;水稻齐穗期和成熟期,PCo1 与PCo2 的解释度差异增加,不同品种水稻的土壤真菌群落组成在PCo1 方向上出现一定分布差异,其中杂交水稻‘天优华占’与非转基因水稻‘闽恢3301’及抗虫转基因水稻‘MFB’间的分布距离较大,3 个转基因杂交水稻‘闽丰A/MFB’ ‘天丰A/MFB’和‘谷丰A/MFB’的分布位于‘MFB’与‘天优华占’之间。说明土壤真菌群落组成在‘MFB’与‘闽恢3301’间差异不大,‘天优华占’的土壤真菌群落组成与这二者的差异较大,但PERMANOVA、Anosim及Permdisp 等显著性检验结果表明上述差异均未达到显著性水平。
由上述结果可见,本研究中不同品种水稻的土壤细菌或真菌群落的α-多样性指数存在较大差异,但其β-多样性指数的差异不显著。
2.3 水稻土壤微生物群落的物种组成
细菌16S rRNAV3-V4 区高通量测序的物种分类注释与组成分析表明,本研究稻田土壤中的细菌主要包括(图3): 变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)、硝化螺菌门(Nitrospirae)、拟杆菌门(Bacteroidetes)、匿杆菌门(Latescibacteria)和己科河菌门(Rokubacteria)。这10 类菌门总量占各样品细菌总量的95%以上,其中变形菌门、酸杆菌门、绿弯菌门、厚壁菌门和放线菌门在各样品中所占比例较高,依次均占30.2%、18.2%、15.8%、12.4%和7.6%,可见这5 类细菌是本研究稻田土壤细菌的主要优势菌门。

图3 不同品种水稻不同生育期土壤主要细菌门的相对丰度Fig.3 Relative abundances of main bacterial phylum in paddy soils at different growth stages of different rice varieties
水稻分蘖期时(图3),抗虫转基因水稻‘MFB’土壤的变形菌门相对丰度显著高于非转基因常规水稻‘闽恢3301’ (P<0.05),但其酸杆菌门、绿弯菌门、厚壁菌门和放线菌门的相对丰度均显著低于‘闽恢3301’(P<0.05);3 个转基因杂交水稻‘闽丰A/MFB’ ‘天丰A/MFB’和‘谷丰A/MFB’的土壤变形菌门相对丰度与杂交水稻‘天优华占’无显著差异,但都显著低于‘MFB’ (P<0.05);除‘闽丰A/MFB’的土壤酸杆菌门和绿弯菌门外,3 个转基因杂交水稻的土壤酸杆菌、绿弯菌门及厚壁菌门的相对丰度均接近或高于‘天优华占’及‘MFB’,尤其是厚壁菌门的相对丰度以‘MFB’最低,‘天优华占’ ‘谷丰A/MFB’ ‘天丰A/MFB’和‘闽丰A/MFB’依次显著提高(P<0.05)。
水稻齐穗期(图3),与‘闽恢3301’相比,‘MFB’土壤厚壁菌门相对丰度显著提高(P<0.05),但其酸杆菌门及放线菌门的相对丰度均显著降低(P<0.05);‘天优华占’及3 个转基因杂交水稻的土壤厚壁菌门相对丰度均显著低于‘MFB’ (P<0.05),其中,‘闽丰A/MFB’和‘天丰A/MFB’还显著低于‘天优华占’ (P<0.05);而‘天优华占’及3 个转基因杂交水稻的土壤变形菌门和放线菌门相对丰度均高于‘MFB’,且除‘闽丰A/MFB’的土壤变形菌门外,均达到显著性水平(P<0.05)。
水稻成熟期(图3),除‘闽丰A/MFB’土壤放线菌门外,‘MFB’的土壤变形菌门和放线菌门的相对丰度均显著高于其他品种水稻(P<0.05),而其绿弯菌门相对丰度显著低于其他品种水稻(P<0.05);6 个水稻品种中,‘天优华占’的土壤酸杆菌门相对丰度最高,显著高于其他品种水稻(P<0.05),而其土壤厚壁菌门的相对丰度最低。此外,不同品种水稻土壤芽单胞菌门、硝化螺菌门、拟杆菌门、匿杆菌门和己科河菌门的相对丰度差异不大。
由上述结果可见,水稻各生育期,抗虫转基因水稻‘MFB’土壤细菌中占比最高的变形菌门的相对丰度高于非转基因水稻‘闽恢3301’,且在水稻分蘖期和成熟期时差异显著(P<0.05);水稻齐穗期,杂交水稻‘天优华占’的土壤变形菌门相对丰度最高,3 个转基因杂交水稻‘闽丰A/MFB’ ‘天丰A/MFB’和‘谷丰A/MFB’土壤的变形菌门相对丰度介于‘MFB’与‘天优华占’之间。
真菌ITSV1 区高通量测序的物种分类注释与组成分析结果(图4)表明,稻田土壤真菌主要包括: 子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、罗泽真菌门(Rozellomycota)和被孢霉门(Mortierellomycota),分别占样品真菌总量的57.2%、4.6%、2.4%和0.8%,由此可见子囊菌门是本研究稻田土壤真菌的主要优势种群。水稻分蘖期和齐穗期,抗虫转基因水稻‘MFB’的土壤子囊菌门相对丰度显著低于非转基因水稻‘闽恢3301’ (P<0.05);水稻齐穗期,杂交水稻‘天优华占’的土壤子囊菌门相对丰度显著高于‘MFB’ (P<0.05),3 个转基因杂交水稻‘闽丰A/MFB’‘天丰A/MFB’和‘谷丰A/MFB’的土壤子囊菌门相对丰度介于‘天优华占’与‘MFB’之间,且差异显著(P<0.05);水稻成熟期,‘天优华占’的土壤子囊菌门相对丰度显著低于其他品种水稻(P<0.05)。此外,不同品种水稻土壤的担子菌门、罗泽真菌门和被孢霉门相对丰度差异较小。

图4 不同品种水稻不同生育期土壤主要真菌门的相对丰度Fig.4 Relative abundances of main fungal phylum in paddy soils at different growth stages of different rice varieties
由此可见,与非转基因水稻‘闽恢3301’相比,稻田土壤真菌中占比最高的子囊菌门相对丰度在抗虫转基因水稻‘MFB’土壤中具明显降低,且在水稻分蘖期和齐穗期差异显著(P<0.05);水稻齐穗期杂交水稻‘天优华占’土壤子囊菌门相对丰度最高,且转基因杂交水稻‘闽丰A/MFB’ ‘天丰A/MFB’和‘谷丰A/MFB’的土壤子囊菌门相对丰度介于‘天优华占’与‘MFB’之间。
进一步使用平均丰度前20 位的属的丰度数据绘制了稻田土壤细菌及真菌的物种组成聚类热图(图5)。水稻齐穗期稻田土壤细菌菌属的物种组成在抗虫转基因水稻‘MFB’与非转基因水稻‘闽恢3301’之间的聚类距离最远,而水稻成熟期二者可首先聚类,说明水稻齐穗期‘MFB’的土壤细菌群落物种组成与‘闽恢3301’差异较大,而水稻成熟期二者较为相似。同时,水稻成熟期转基因杂交水稻‘闽丰A/MFB’ ‘天丰A/MFB’和‘谷丰A/MFB’的土壤细菌菌属的物种组成首先与杂交水稻‘天优华占’聚类,说明与常规水稻‘闽恢3301’或‘MFB’比较而言,4 个杂交水稻土壤细菌群落物种组成相似性更高。

图5 不同品种水稻不同生育期土壤细菌群落的物种组成聚类热图Fig.5 Cluster heat maps of bacterial communities in paddy soils at different growth stages of different rice varieties
土壤真菌群落物种组成热图显示(图6),水稻分蘖期及齐穗期,稻田土壤真菌菌属的物种组成均首先在‘MFB’与‘闽恢3301’间聚类,而成熟期二者聚类距离最远,说明水稻生长前期‘MFB’的土壤真菌群落物种组成与‘闽恢3301’比较相似,到水稻成熟期时二者差异增大。水稻齐穗期‘天丰A/MFB’ ‘闽丰A/MFB’及‘谷丰A/MFB’的土壤真菌菌属的物种组成先依次与‘MFB’聚类后,再与‘天优华占’聚类,表明‘MFB’的土壤真菌群落物种组成与‘天优华占’差异较大,而‘天丰A/MFB’ ‘闽丰A/MFB’和‘谷丰A/MFB’的土壤真菌群落物种组成介于‘MFB’与‘天优华占’之间。

图6 不同品种水稻不同生育期土壤真菌群落的物种组成聚类热图Fig.6 Cluster heat map of fungal communities in paddy soils at different growth stages of different rice varieties
2.4 水稻土壤微生物群落的功能组成
本研究进一步使用PICRUSt2 (2.2.0)软件对土壤细菌和真菌的群落功能进行了预测分析,并依据Bray-Curtis 距离绘制功能单元PCoA 分析的二维散点图(图7 和图8),对不同品种水稻土壤微生物群落的功能组成进行了比较。水稻分蘖期,仅‘闽丰A/MFB’的土壤细菌群落功能单元组成散点的分布远离其他品种;水稻齐穗期,土壤细菌群落功能单元组成散点分别在‘天优华占’‘谷丰A/MFB’及‘天丰A/MFB’间或‘MFB’ ‘闽恢3301’及‘闽丰A/MFB’间分布接近;水稻成熟期,土壤细菌群落功能单元组成散点在‘MFB’与‘闽恢3301’间的距离较大,在‘天优华占’ ‘谷丰A/MFB’及‘天丰A/MFB’间的分布仍较为接近且远离‘MFB’。此外,从水稻分蘖期、齐穗期到成熟期,抗虫转基因水稻‘MFB’的土壤细菌群落功能组成与非转基因水稻‘闽恢3301’的差异逐渐增大,3 个转基因杂交水稻与杂交水稻‘天优华占’的土壤细菌群落功能组成的差异逐渐缩小,且与‘MFB’的差异逐渐增加。

图7 不同品种水稻不同生育期土壤细菌群落功能单元主坐标分析Fig.7 Principal co-ordinates analysis for functional unit of bacterial communities in paddy soils at different growth stages of different rice varieties

图8 不同品种水稻不同生育期土壤真菌群落功能单元主坐标分析Fig.8 Principal co-ordinates analysis for functional unit of fungal communities in paddy soils at different growth stages of different rice varieties
由图8 可见,水稻分蘖期,仅‘闽丰A/MFB’土壤真菌群落功能单元组成的3 个重复散点分布较为集中,其余品种重复散点分布分散,说明不同品种间土壤真菌群落功能组成差异不明显;水稻齐穗期,‘天优华占’的土壤真菌群落功能单元重复散点分布集中,且与其他品种在PCo1 坐标轴上存在较大的投影距离,说明‘天优华占’的土壤真菌群落功能组成与其他品种水稻存在一定差异;水稻成熟期,除‘谷丰A/MFB’外,在‘天优华占’与其他品种水稻间土壤真菌群落功能组成仍存在一定差异。
由此可见,不同品种水稻土壤细菌或真菌群落功能组成差异不明显,但细菌群落功能组成的差异较真菌明显,且抗虫转基因水稻‘MFB’与非转基因水稻‘闽恢3301’间土壤细菌群落功能组成的差异具有随水稻生长逐渐增大的趋势。
3 讨论
水稻是主要的粮食作物,全球有50%以上人口以稻米为主粮。在我国,水稻总产量约占粮食总产量的40%左右,是维持国家粮食安全的砥柱[21]。水稻鳞翅目害虫如二化螟(Chilo suppressalis)、三化螟(Scirpophaga incertulas)、稻纵卷叶螟(Cnaphalocrocis medinalis)等是我国水稻生产中的主要害虫,培育和推广具有抗虫能力的水稻品种是解决上述问题的有效途径。迄今为止,尚未发现任何对鳞翅目(Lepidoptera)害虫具有抗性的稻种资源,因此不可能通过常规育种及分子标记辅助选择技术方式培育抗虫水稻品种。目前只有采取植物转基因技术,将外源抗虫基因导入水稻中,才能培育出抗鳞翅目害虫水稻新品种。抗虫转基因水稻的应用,对保障我国粮食安全,保持农业可持续发展,保护生态环境,实现农业生物技术的产业化等多方面都具有十分重要的意义。
苏云金芽孢杆菌在芽孢期产生的杀虫晶体蛋白(Cry 蛋白)对鳞翅目害虫具有很强的杀虫活性,目前cry基因已被广泛应用到各种抗虫转基因作物中[22-25]。本研究的抗虫转基因水稻中的cry1Ab基因是用人工合成的方法获得的一种结构基因,序列全长为1848 bp,编码为615 个氨基酸。利用cry1Ab基因,构建cry1Ab抗虫基因的双T-DNA 载体pCDMARUBb-Hyg,通过农杆菌介导将双T-DNA 载体pCDMARUBb-Hyg 转化优良水稻恢复系‘闽恢3301’,并通过多代自交、检测与选择获得了无选择标记转cry1Ab抗虫基因水稻纯合株系‘MFB’。以抗虫转基因水稻‘MFB’为恢复系分别与籼型不育系‘闽丰1A’ ‘天丰A’和‘谷丰A’杂交,获得了抗虫转基因杂交水稻‘闽丰A/MFB’ ‘天丰A/MFB’和‘谷丰A/MFB’。本研究田间试验中抗虫转基因水稻具有显著的增产效应,‘MFB’及其3 个转基因杂交水稻的产量显著高于非转基因的常规水稻‘闽恢3301’或杂交水稻‘天优华占’(P<0.05)。同时转基因杂交水稻的产量具有高于转基因水稻恢复系‘MFB’的趋势,如‘闽丰A/MFB’和‘天丰A/MFB’的产量均显著高于‘MFB’ (P<0.05),这也体现出了植物的杂种优势[26]。
土壤微生物在土壤养分转化、有机质分解、腐殖质形成及污染物生物降解等土壤生化过程中起着重要作用[27-28]。土壤微生物群落多样性变化能反映土壤环境状况,是衡量土壤质量和维持土壤微生态平衡的重要指标。抗虫转基因水稻由于对水稻鳞翅目害虫具有较好的抗性而增产效应明显,生长状况优于非转基因水稻。水稻植株生长状况及外源基因的导入均可改变其根系分泌物及脱落物的组成与数量,从而可能影响土壤微生物的生长及其群落多样性与功能。
本研究通过对细菌16S rRNA基因和真菌ITS基因的高通量测序,分析了抗虫转基因水稻及其杂交水稻与非转基因常规水稻及杂交水稻间土壤微生物群落组成的差异。发现水稻生长季,稻田土壤优势细菌或真菌菌门的相对丰度在抗虫转基因水稻‘MFB’与非转基因水稻‘闽恢3301’间,以及抗虫转基因杂交水稻‘闽丰A/MFB’ ‘天丰A/MFB’和‘谷丰A/MFB’与非转基因杂交水稻‘天优华占’间均存在差异。与非转基因常规水稻‘闽恢3301’比较,抗虫转基因水稻‘MFB’土壤中数量最多的细菌变形菌门相对丰度明显提高,真菌数量最多的子囊菌门相对丰度明显降低;水稻齐穗期抗虫转基因杂交水稻‘闽丰A/MFB’‘天丰A/MFB’和‘谷丰A/MFB’的土壤变形菌门及子囊菌门相对丰度都介于‘天优华占’与‘MFB’之间。说明种植抗虫转基因水稻及其转基因杂交水稻均会改变稻田土壤微生物物种组成的相对丰度。另外,基于丰度前20 位菌属的聚类分析也表明,在水稻某些生长阶段土壤细菌或真菌的群落组成在抗虫转基因水稻‘MFB’与非转基因水稻‘闽恢3301’间存在一定差异。
虽然,本试验中土壤微生物群落β-多样性的主坐标分析表明,不同品种水稻细菌或真菌的群落组成的差异均没有达到显著水平。但是,微生物群落的α-多样性指数在不同品种水稻间存在显著差异,且土壤细菌群落的α-多样性指数差异在水稻生长后期表现更为明显,土壤真菌则是在水稻生长前期更为突出。如在水稻成熟期时抗虫转基因水稻‘MFB’土壤细菌群落的物种丰富度指数Chao1、Observed_species 和多样性指数Shannon、Simpson 均显著高于非转基因水稻‘闽恢3301’ (P<0.05);水稻分蘖期‘MFB’土壤真菌群落的物种丰富度指数Chao1 和Observed_species、多样性指数Shannon、Simpson 及均匀度指数Pielou_e 均显著高于‘闽恢3301’ (P<0.05)。另外,水稻齐穗期也可见3 个抗虫转基因杂交水稻的土壤细菌或真菌群落的多样性指数Shannon 均介于‘天优华占’与‘MFB’之间。说明与非转基因常规水稻或杂交水稻比较,种植抗虫转基因水稻或其杂交水稻均可提高稻田土壤微生物群落的多样性。
此外,对微生物群落功能组成的分析表明,稻田土壤细菌群落功能组成在不同品种水稻间的差异比真菌群落功能组成的差异明显。抗虫转基因水稻‘MFB’的土壤细菌群落功能组成与非转基因水稻‘闽恢3301’间的差异随水稻生长逐渐增大,水稻成熟期最明显;而抗虫转基因杂交水稻‘闽丰A/MFB’‘天丰A/MFB’和‘谷丰A/MFB’的土壤细菌群落功能组成与杂交水稻‘天优华占’更为相似。转基因与非转基因水稻的土壤真菌群落功能组成没有明显差异。这说明抗虫转基因水稻对土壤细菌群落功能的影响更大。
研究表明,将cry1Ab基因引入植物后可改变植物化学成分,转cry1Ab基因玉米的植株淀粉、木质素、低蛋白质及可溶性氮含量都发生了变化[29]。植物化学成分的变化可通过改变植物根系分泌物及凋落物的成分组成影响土壤微生物的生存状况,从而改变其群落组成与功能。本研究中,种植抗虫转基因水稻及其杂交水稻均改变了细菌或真菌群落组成中主要菌门的相对丰度,提高了稻田土壤细菌或真菌群落的α-多样性指数;由于土壤微生物组成种类的复杂性及其群落结构与功能的冗余性,稻田土壤微生物群落组成及功能总体上变化不显著;但仍可预测出抗虫转基因水稻土壤细菌群落功能组成具有发生改变的趋势。结合已有研究发现[30],种植抗虫转基因水稻有助于提高土壤微生物群落的多样性,连续种植多年后可能改变土壤微生物群落的组成及功能。因此,可通过多年田间定位试验,分析稻田土壤微生物群落组成与功能、水稻根系分泌物代谢组及土壤pH、养分含量等根际微环境的变化状况,进一步明确种植抗虫转基因水稻对土壤微生物群落的影响并深入探讨其机制。
4 结论
本研究结果表明: 与非转基因常规水稻或杂交水稻比较,转cry1Ab基因的抗虫转基因水稻及其转基因杂交水稻均可显著增产(P<0.05)。同时,稻田土壤主要细菌或真菌种类的相对丰度产生变化,与非转基因水稻‘闽恢3301’相比,抗虫转基因水稻‘MFB’土壤细菌的变形菌门或土壤真菌的子囊菌门的相对丰度分别在水稻分蘖期和成熟期显著提高(P<0.05)或在水稻分蘖期和齐穗期显著降低(P<0.05),且在水稻齐穗期转基因杂交水稻‘闽丰A/MFB’ ‘天丰A/MFB’和‘谷丰A/MFB’的土壤变形菌门或子囊菌门的相对丰度均介于抗虫转基因水稻‘MFB’与杂交水稻‘天优华占’之间。转cry1Ab抗虫转基因水稻也提高了细菌或真菌群落的多样性指数,在水稻成熟期或分蘖期,‘MFB’土壤细菌或真菌群落的物种丰富度指数Chao1、Observed_species 及多样性指数Shannon、Simpson 均显著高于‘闽恢3301’ (P<0.05),且在水稻齐穗期3 个转基因杂交水稻土壤细菌及真菌群落的多样性指数Shannon 均介于‘MFB’与‘天优华占’之间;但转cry1Ab抗虫转基因水稻及其转基因杂交水稻均未显著影响土壤细菌或真菌群落的组成及功能。
