生物质混煤加压富氧燃烧SO2的排放特性
2024-01-20卢昌杰
卢昌杰,刘 彦,廉 盟
(1.杭州电子科技大学机械工程学院,浙江 杭州 310018;2.杭州电子科技大学理学院,浙江 杭州 310018)
0 引 言
富氧燃烧技术是以体积浓度大于95%的氧气和锅炉的循环烟气构成的混合气体作为助燃剂,使得燃烧后烟气中CO2的含量超过90%[1],以便于对CO2进行集中收集的技术,因而受到广泛的重视[2]。但在富氧燃烧系统中,燃烧和换料发生在常压下,CO2收集和O2的制取则在高压下进行,系统压力先升高后降低,造成大量的能量损失。因此,专家学者们进一步提出加压富氧燃烧技术,与常规富氧燃烧相比,加压富氧燃烧技术使整个系统处于高压下,不仅降低各部件的能量消耗,还提高系统内蒸汽的凝结温度[3],减少锅炉热损失,大大提高锅炉的综合发电效率[4]。由于生物质-煤的组成结构复杂,元素众多,转化途径多样,在加压富氧燃烧中气氛、压力等因素的变化会导致燃烧后干烟气中污染物(如NOx、SO2)的析出特性发生改变,不仅会对锅炉结构产生侵蚀,而且会对环境产生污染[5]。
近些年来,国内外很多学者对生物质混煤富氧燃烧过程中污染物生成特性进行实验探究。段元强[6]等在加压流化床燃烧系统上实验发现,在0.1~0.7 MPa压力范围内和21%O2/79%CO2气氛下压力增加可以抑制生物质与煤混合燃料中NO和SO2的排放;Lei[7]等通过加压热重傅里叶红外技术对煤中氮、硫转为NOx、SO2的转化进行分析,结果表明:在压力为0.1~3.0 MPa的富氧气氛下,随着压力的升高,煤中氮向NO、N2O的转化率也升高但硫向SO2的转化率先升高后降低。
尽管已有相当多的学者在研究生物质掺混对煤燃烧过程中SO2生成的影响,但是生物质和煤粉在加压富氧条件下燃烧存在协同机制[8],反应压力的提高所导致SO2生成行为变化的规律尚无统一的认识[9]。为此,本文借助Chemkin软件中连续理想柱塞流动模型(PFR)研究O2/CO2气氛下生物质混煤燃烧SO2的排放特性,分析了生物质掺混比、燃烧气氛和燃烧压力对SO2排放特性的影响;同时采用生成速率(ROP)方法揭示了硫从燃料硫转化为主要硫化物的关键反应路径,可为减少加压富氧条件下生物质混煤中SO2的排放提供理论指导和技术支持。
1 模型和计算方法
本文研究采用我国典型的山西煤,生物质选用麦秆。表1列出了山西煤和麦秆的工业分析和元素分析,其中:FCad为煤中固定碳含量;Vad为煤挥发分含量;Aad为煤灰分含量;Mad为煤中水分含量。

表1 山西煤和麦秆的工业分析和元素分析
本文研究中,采用Chemkin软件中PFR模型对生物质混煤加压富氧燃烧过程中硫转化行为的数值模拟研究。温度、压力、流量和热解反应物摩尔分数是PFR模块的主要输入参数。将前三个输入参数设置为实验需要的数值以模拟真实的反应过程。各热解气成分采用David Merrick[10]的挥发分燃烧模型计算[11]。David Mrrick计算模型由三部分组成,分别为每种挥发分组分的最终产率、热解动力模型以及焦炭组成的预测,根据元素平衡建立方程组。上述得到的热解组分按照比例作为Chemkin的输入用于之后PFR模型计算使用,如表2所示。

表2 Chemkin模型输入的挥发份成分
2 结果与分析
2.1 麦秆掺混比对SO2排放的影响
在0.1 MPa,900 ℃,氧浓度为30%的O2/CO2条件下,SO2在不同掺混比下的排放速率和总排放量曲线如图1所示。

图1 不同掺混比下SO2排放速率和总排放量
由图1可知,在纯煤燃烧下,SO2最高排放速率为1.85×10-9mol/(cm3·s),SO2总的排放量为8.65×10-8(mol·cm-3);当麦秆的掺混比达到50%后,SO2最高生成速率下降到1.16×10-9mole/(cm3·s),总的排放量为4.63×10-8(mol·cm-3),SO2的最高生成速率下降37.29%,总的排放量也下降46.47%。随着麦秆掺混比的升高,SO2的排放速率和总排放量不断降低。这是因为:(1)与西安煤相比,麦秆中硫含量较低,降低混合燃料SO2转化率,减少SO2的生成速率和生成量;(2)麦秆与西安煤相比,硅、铝含量较低,而碱金属(以K为主)和碱土金属(以Ca为主)较多,这些碱金属和碱土金属在混合燃料燃烧时与生成的SO2再次反应形成硫酸盐[12],降低混合燃料的SO2排放[13];(3)麦秆中的挥发分含量高。在混合燃料燃烧时,挥发份的大量析出,与混合燃料发生抢氧燃烧[14],使燃烧区内氧含量下降,抑制SO2的生成。
2.2 不同气氛对SO2排放的影响
在0.1 MPa,900 ℃,掺混比为30%条件下,SO2在不同气氛下的排放速率和总排放量曲线如图2所示。
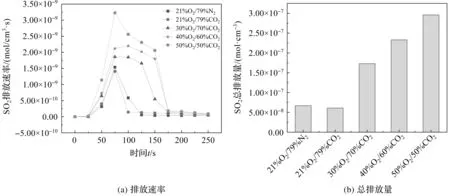
图2 不同气氛下SO2排放速率和总排放量
从图2可以看出,当氧气浓度同样为21%时,在O2/N2气氛下,SO2的最高排放速率为1.54×10-9mol/(cm3·s),SO2总的排放量为6.73×10-8(mol·cm-3);在O2/CO2气氛下SO2的最高生成速率为1.41×10-9mol/(cm3·s),总的排放量为6.10×10-8(mol·cm-3)。SO2的最高生成速率下降8.44%,总的排放量也下降9.36%。O2/CO2气氛下SO2的排放得到了削弱,原因是:(1)N2的比热容和密度都比CO2小,由O2/N2气氛变为O2/CO2气氛时,混合燃料燃烧强度降低,燃烧反应速率减慢,燃料中的硫元素释放也相应减少[12,13];(2)CO2浓度较高,使得CO的生成增加,CO在燃料粒子表面上形成局部的还原气氛,促进燃烧过程中燃料硫向S、COS、CS2等的转化。同时,从图2可以看出,O2/CO2气氛下,SO2的排放速率和总的排放量随O2浓度的升高而增加,这是由于随着氧气含量的提高,燃烧情况得到改善,燃烧速度的提高,燃料自身的加热导致粒子的温度较快升高,燃料中难析出的硫提前析出,同时飞灰中金属元素对S的束缚作用减弱,从而导致SO2的排放增加。
2.3 不同压力对SO2排放的影响
在900 ℃,掺混比30%,氧浓度为30%的O2/CO2条件下,SO2在不同压力下的排放速率和总排放量曲线如图3所示。
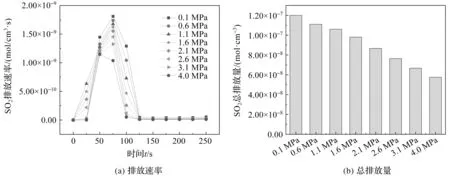
图3 不同压力下SO2排放速率和总排放量
在常压燃烧下,由图3可知SO2的最高生成速率为1.81×10-9mol/(cm3·s),SO2总的排放量为1.19×10-7(mol·cm-3);当燃烧压力达到1.6 MPa,SO2的最高生成速率下降到1.62×10-9mol/(cm3·s),总的排放量为9.81×10-8(mol·cm-3),SO2的最高生成速率下降10.4%,总的排放量也下降17.5%。随着燃烧压力的升高,SO2的实时生成速率和总排放量不断降低,可能因为:(1)O2的高分压促进了SO2向SO3的转化,之后灰渣中的碱性金属(钠、钾、钙等)和相应的化合物迅速与酸性SO3发生反应生成更稳定的硫酸盐[13]。(2)在O2/CO2气氛下,高分压的CO2被还原成CO。由图4可知,当工作压力从0.1 MPa增加到4.0 MPa时,燃烧系统中CO排放速率显著升高,部分SO2在烟气中被CO还原转化为单质硫,随后活性较高的单质硫与小分子挥发性物质结合生成有机硫。
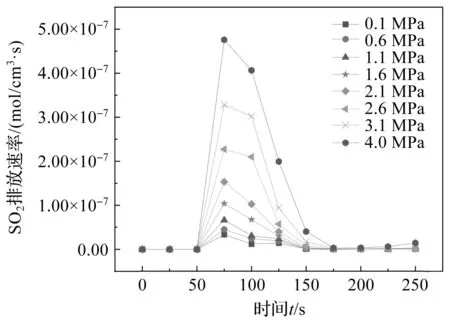
图4 不同压力下CO排放速率
3 路径分析
3.1 SO2转化路径分析
生成速率ROP(Rate of Production)显示反应过程中每个基元反应对应于指定组分的生成速率或分解速率的贡献值。通过分析总结,可以进一步确定SO2的主要生成或消耗路径,对于深入了解SO2在反应过程中的生成与演化行为提供了直观的计算结果。在GRI-Mech 3.0机理模型中涉及SO2转化的基元反应见下表3。

表3 基元反应
图5、图6分别显示在常压和加压富氧条件下参与SO2转化的重要基元反应的反应速率。
由图5可知,在常压(0.1 MPa)富氧气氛下,涉及SO2转化的八个主要基元反应分别是R24,R25,R28,R66,R74,R75,R90,R92,其中四个基元反应(R25,R28,R66,R74)促进了SO2的生成,其它的四个基元反应(R24,R75,R90,R92)以消耗SO2为主。由图5可知,基元反应R24与R25参与整个燃烧过程,是SO2消耗和生成速率最高的两个基元反应,R92的最大反应速率为-5.14×10-9mol/(cm3·s),R24的最大反应速率为2.13×10-9mol/(cm3·s),由此可认为SO可能是SO2转化过程的中间产物,此外基元反应R28也促进了SO向SO2的转化,进一步证明SO可能是重要的中间产物。由于反应R24,R75,R90,R92对SO2的消耗速率低于反应R25,R28,R66,R74对SO2的生成速率,所以SO2最终在烟气中释放出一定的体积浓度。

图5 0.1 MPa下SO2的ROP分析
由图6可知,在加压(1.6 MPa)燃烧过程后,涉及SO2的主要基元反应与0.1 MPa时相同,但这八个基元反应的反应速率显著提高。对于SO2生成速率最高的基元反应R24,其SO2生成速率系数峰值达到7.72×10-8(mol/cm3·s),而SO2消耗的主要基元反应R25,其SO2生成速率系数峰值达到-9.92×10-8(mol/cm3·s),压力提高对于消耗SO2基元反应的促进作用大于对SO2生成反应的增强效应,所以SO2最终释放体积浓度低于0.1 MP时。
综上所述,燃烧系统加压后,SO2的消耗量超过生成量。SO2的减少是由基元反应R24,R25,R28,R66,R74,R75,R90,R92这八个主要基元反应相互作用的结果。

图6 1.6 MPa下SO2的ROP分析
3.2 加压硫化物转化路径分析
根据该模型的ROP分析和敏感性分析,可以得到整个燃烧过程中涉及硫转化的关键反应路径如图7所示。由David Merrick[10,11]的挥发分燃烧模型可知,混合燃料中的S在脱挥发期主要转化为H2S和COS,H2S和COS通常首先与H、O和OH活性基反应生成SH、HSO和SO等对于硫转化十分重要的中间产物。

图7 生物质混煤加压富氧燃烧硫转化路径
从转化路径图7可知,在H2S到SO2的整个氧化反应过程中,氧活性基是主要的氧化剂。最初,H2S通过R38和R57转化为SH和HSO,然后SH和HSO通过R41和R62氧化为SO,小部分的SH和HSO通过R61转化为HOS,然后通过R62进一步氧化成SO,通过上述的氧化路径会形成和积累大量的SO,经由R23进一步与H、O和O2反应生成SO2。此外,部分的HSO经R57直接氧化生成SO2。通过上述反应路径,H2S中的硫原子转移到了SO2中。
图7还显示从COS到SO2的转换过程。COS刚开始经由R151,R143和R158生成为SH、CS和CS2。然后部分生成的SH和CS通过R142转换为CS2;另一部分的SH、CS和CS2分别通过R42、R140和R167转化为SO2和S。值得注意的是,S作为一种高活性物质,既可以与环境中氧原子结合由R20生成SO,然后再经R1491氧化为SO2,也可以直接通过R70生成SO2。此外,COS生成的另一中间产物SH通过R41和R25参与SO的形成,进而形成SO2。
综上,生物质混煤燃烧过程中硫原子的迁移和转化与硫化物的形成和消耗是非常复杂的,其中H、O和OH自由基对维持和加速整个反应过程至关重要,SO和HSO是形成SO2的主要前体。
4 结束语
本文借助PFR模型对生物质混煤加压富氧燃烧过程中SO2排放特性进行了较为详细的分析和讨论,分析了生物质掺混比、燃烧气氛、燃烧压力对SO2生成的影响规律;同时采用反应速率(ROP)方法揭示了硫从燃料硫转化为主要硫化物的关键反应路径,主要结论如下:
1)生物质的掺混一定程度上可以减少SO2的析出,生物质掺混比越大,烟气中SO2释放速率和总排放量越低;
2)随着氧气浓度的增加,O2/CO2气氛下SO2的排放显著升高;在相同氧气浓度下,燃烧气氛由空气转变为O2/CO2气氛后,SO2的释放速率和总排放量减少;
3)在O2/CO2气氛下,随着燃烧压力的提高,SO2的生成量逐渐降低;
4)ROP分析表明:生物质混煤燃烧中,涉及SO2转化的八个主要基元反应分别是R24,R25,R28,R66,R74,R75,R90,R92。基元反应R24与R25参与整个燃烧过程,是SO2消耗和生成速率最高的两个基元反应,压力提高对于消耗SO2基元反应的促进作用大于对生成SO2基元反应的增强效应;
5)在生物质混煤硫转化过程中,H、O、OH活性基对硫转化行为具有重要的影响。HSO和SO是SO2转化的重要中间产物,SH是参与H2S和COS转化的重要中间产物。
由于模拟条件的理想化,忽略了很多实际中可能存在的问题,这可能导致模拟结果与实验结果有所差别,下一步希望与实验相结合,得出更为准确的结论。
