舒肝宁注射液联合西药治疗病毒性肝炎的Meta分析Δ
2024-01-18张佳楠杨玉晴李春晓王盼盼
张佳楠,杨玉晴,李春晓,郭 静,张 丽,凌 霄,王盼盼
(1.河南中医药大学药学院,郑州450046; 2.河南中医药大学第一附属医院药学部,郑州 450000; 3.河南省中药临床应用、评价与转化工程研究中心/河南省中药临床药学中医药重点实验室,郑州 450000; 4.河南中医药大学呼吸疾病中医药防治省部共建协同创新中心,郑州 450046)
根据世界卫生组织2022年的报道,全球每年约有110万人死于包括肝炎在内的慢性肝病,仅在2019年,因急性病毒性肝炎感染并发症引起死亡的人数高达7.8万人,病毒性肝炎已严重影响到全球人民的生命健康,世界卫生组织定下将在2030年结束病毒性肝炎流行的目标[1]。病毒性肝炎几乎在任何一个国家都是一种国际公共威胁,我国可能受其影响最严重[2-3]。在我国,慢性病毒性肝炎每年导致约38万人死亡,其中在全球范围内,我国乙型肝炎病毒感染率高达33.33%,丙型肝炎病毒感染率为7%[4]。病毒性肝炎是由肝炎病毒引起的一种肝脏感染性疾病,随着病情的发展,不给予治疗的话,将发展为肝硬化甚至肝癌[5]。目前,临床上西医主要采用抗病毒药进行病毒性肝炎的治疗,如干扰素、核苷酸类似物等,但其应答率低、不良反应发生率高,导致临床有效性和安全性无法保证[6-7]。中医药疗法具有疗效突出、不良反应发生率低等优势[8],被广泛应用于病毒性肝炎的治疗[9-26]。
舒肝宁注射液是由茵陈、栀子、黄芩、板蓝根、灵芝5种中药提取成分制成的中药复方制剂,具有清热解毒、利湿退黄、益气扶正、保肝护肝的功效[27]。与传统用于护肝的中药饮片相比,舒肝宁注射液具有生物利用度高、疗效快等特点[28-29]。近年来,舒肝宁注射液与西药联合治疗的方式被广泛用于各种类型病毒性肝炎的治疗,可有效改善肝功能和临床症状,疗效确切,安全性较高[30-31]。然而,对于舒肝宁注射液应用的有效性和安全性,尚缺乏多中心、大样本的临床研究支持。本研究基于文献Meta分析方法,对舒肝宁注射液联合西药治疗病毒性肝炎的疗效及安全性进行系统评价,为临床合理用药提供理论依据。
1 资料与方法
1.1 纳入与排除标准
(1)研究类型:随机对照试验(RCT),仅限中英文文献。(2)研究对象:符合病毒性肝炎诊断标准的患者,年龄、病程不限。(3)干预措施:对照组使用西药治疗,观察组在对照组基础上加用舒肝宁注射液。(4)结局指标:临床总有效率、肝功能指标[包括总胆红素(TBIL)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、碱性磷酸酶(ALP)、结合胆红素(DBIL)]以及不良反应。(5)排除标准:非随机、对照研究文献;非临床研究文献(药理实验、文献综述、系统评价、Meta分析、病例报告);观察组干预措施非舒肝宁注射液联合西药治疗;无主要结局指标的文献;数据不完整的文献;重复纳入的文献。
1.2 文献检索方法
计算机检索the Cochrane Library、PubMed、Embase、Web of Science、中国生物医学文献服务系统、万方数据库、中国知网、维普数据库8个数据库,检索时间为建库至2022年6月。首选主题词+自由词的方式进行检索,中文检索词包括“病毒性肝炎”“病毒型肝炎”和“舒肝宁”,英文检索词包括“viral hepatitis”“virus hepatitis”和“shuganning injection”。
1.3 文献筛选、资料提取与质量评价
由2名研究人员分别检索文献,首先将初筛文献导入Endnote软件查重,然后通过阅读文献标题和摘要初筛,最后阅读全文去除不符合的文献。意见有分歧时,须讨论或综合第3名研究人员的意见进行决断。应用Excel软件提取资料:文献基本信息,如第一作者、发表年份、标题等;患者基本情况,如病例数、性别、年龄、疾病、疗程等;对照组与观察组的干预措施;结局指标与结果数据。参照Cochrane协作网推荐的RCT偏倚风险评估工具对纳入研究进行方法学质量评价,包括随机序列生成、分配隐藏、所有研究参与者和人员采用盲法、结果评估的盲法、不完整的结果数据、选择性报告和其他偏倚。
1.4 统计学方法
数据整合和Meta分析采用RevMan 5.3软件,漏斗图的制作和Egger检验使用R语言。二分类变量使用相对危险度(RR)表示;连续性变量使用均数差(MD)表示,若对相同变量使用不同测量工具,则采用标准化均数差(SMD)进行分析;均以95%CI表示区间估计。当各研究间同质性较好时(P≥0.1,I2≤50%),采用固定效应模型;当各研究间异质性较大时,分析原因,采用剔除文献等方式进行亚组分析或敏感性分析,若异质性仍较大(P<0.1,I2>50%),则选用随机效应模型[32]。对于不宜进行Meta分析的研究,则采用定性分析[33]。当结局指标纳入的文献数量≥10篇,采用漏斗图分析是否存在发表偏倚。P<0.05为差异有统计学意义。
2 结果
2.1 文献筛选结果
共检索出247篇文献,包括中文文献245篇、英文文献2篇;剔除重复文献113篇,阅读题目及摘要排除86篇,阅读全文排除30篇,最终纳入文献18篇,见图1。
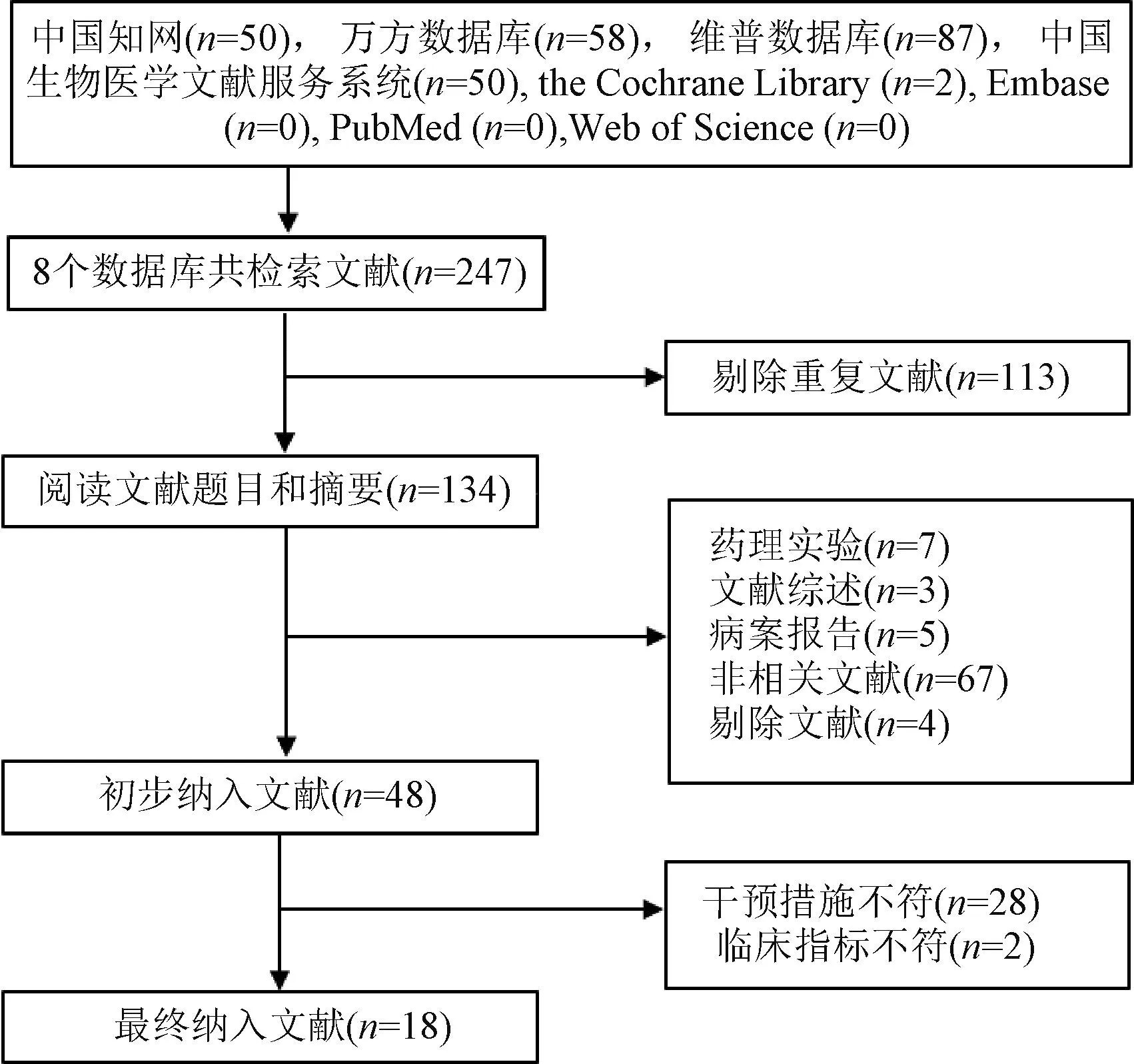
图1 文献筛选流程Fig 1 Process of literature screening
2.2 纳入研究的基本特征
纳入的18篇文献[9-26]均为中文文献,共1 423例患者,其中对照组695例,观察组728例,所有研究的基线资料具有可比性。纳入研究的基本特征见表1。
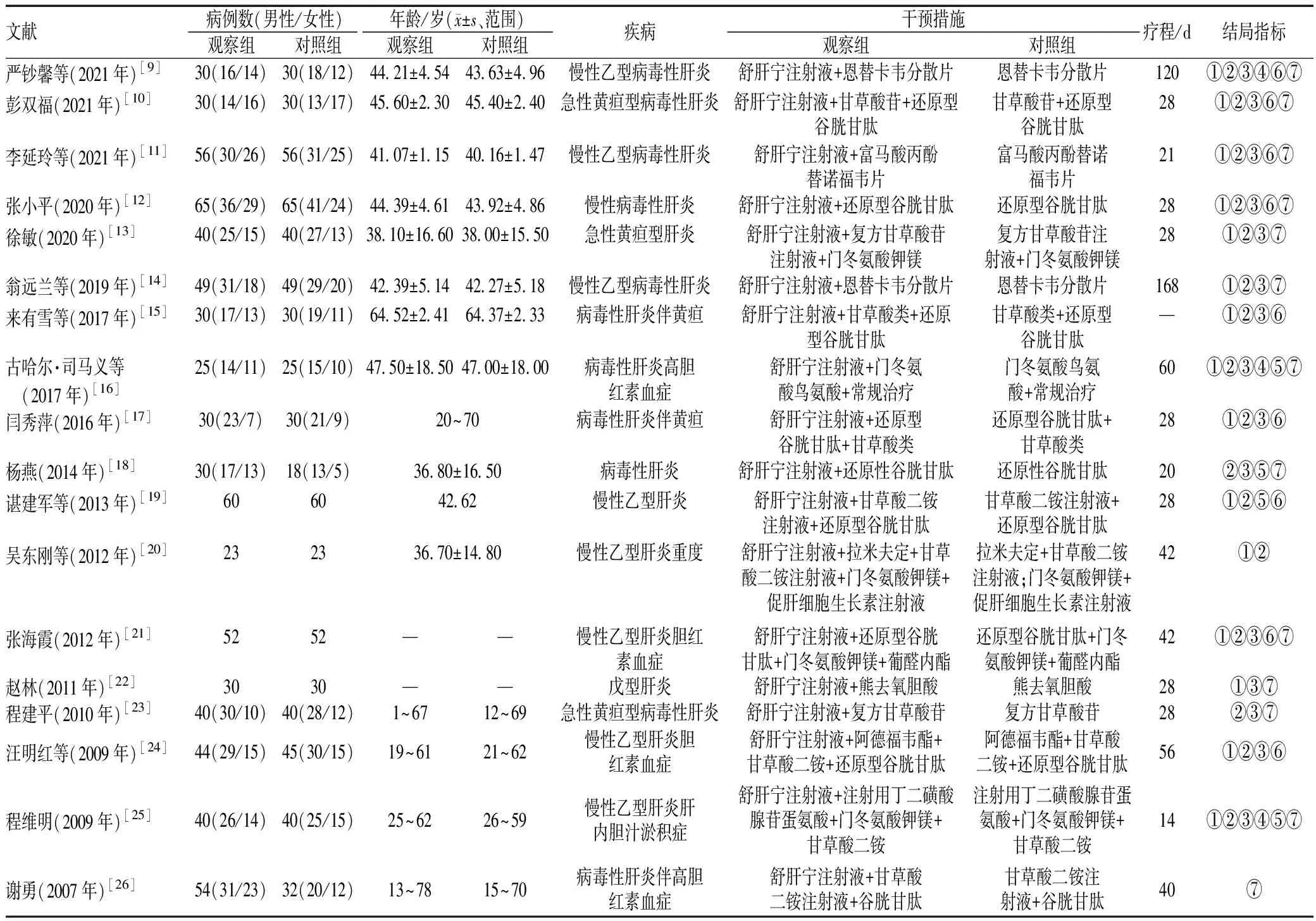
表1 纳入研究的基本特征Tab 1 Basic characteristics of included literature
2.3 纳入文献的偏倚风险评估
纳入的18篇文献中,4篇[9-10,14-15]采用随机数字表法进行随机分配,1篇[16]采用随机抽选法,1篇[21]采用简单随机化法,均属于“低风险”,其余12篇均未描述具体的随机方法,偏倚风险不清楚;4篇[11-13,24]采用非盲,属于“高风险”,其余14篇均未提及盲法的实施,偏倚风险不清楚;所有研究均未提及是否分配隐藏,结局指标均未缺失,未见其他偏倚;18篇文献的偏倚风险均较高,文献质量普遍较低,见图2。
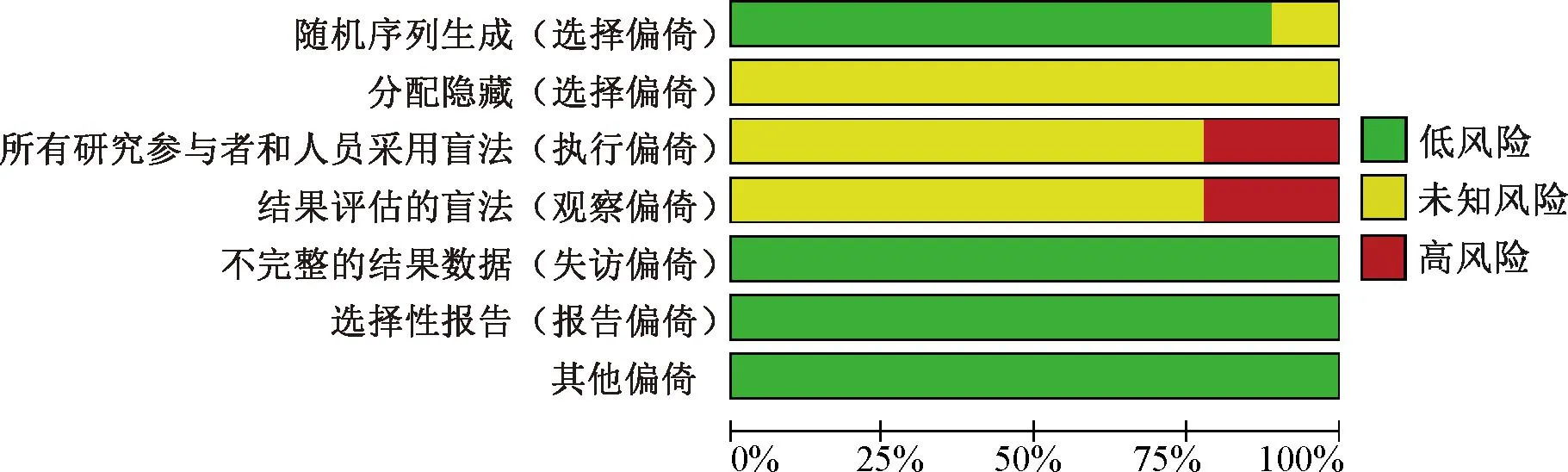
图2 纳入研究的方法学质量评价Fig 2 Methodological quality evaluation of included literature
2.4 Meta分析结果
2.4.1 临床总有效率:13篇文献[9-14,16,18,21-23,25-26]对临床总有效率进行了比较,共1 048例患者(观察组541例,对照组507例)。异质性检验结果显示,各研究间同质性较高(P=0.44,I2=1%),采用固定效应模型合并效应量分析。Meta分析结果显示,观察组患者的临床总有效率明显高于对照组,差异有统计学意义(RR=1.21,95%CI=1.15~1.28,P<0.000 01),见图3。
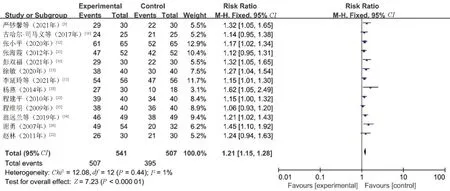
图3 临床总有效率的Meta分析森林图Fig 3 Meta-analysis on clinical total effective rate
2.4.2 TBIL:15篇文献[9-17,19-22,24-25]报告了TBIL水平,共1 209例患者(观察组604例,对照组605例)。不同研究数据间均数差异性偏大,故以SMD作为合并效应量。异质性检验结果显示,I2=90%,P<0.000 01,提示有明显异质性。通过敏感性分析,文献[11]、文献[13]和文献[19]对本次Meta分析的研究结果存在较大干扰,剔除后仍存在明显异质性(P<0.000 01,I2=82%);经过亚组分析,仍存在较大异质性,提示该结局指标不适合进行Meta分析,仅进行组间比较。除1篇文献中两组患者TBIL水平的差异无统计学意义(P>0.05)外,其余文献中两组患者TBIL水平的差异均有统计学意义(P<0.05),从整体来看,舒肝宁注射液联合西药在降低TBIL水平方面较单纯使用西药有明显优势,见表2。
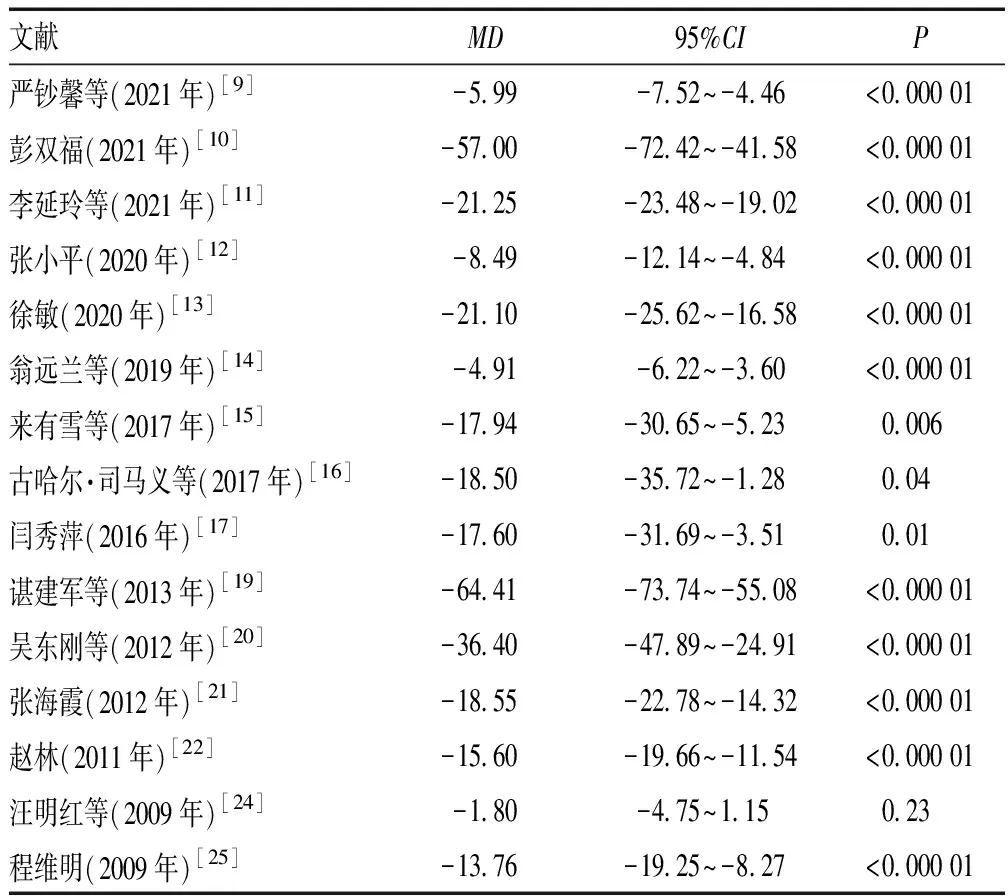
表2 TBIL水平的组间比较结果Tab 2 Results of comparison among groups on TBIL level
2.4.3 ALT:16篇文献[9-21,23-25]报告了ALT水平,共1 277例患者(观察组644例,对照组633例)。异质性检验结果显示,I2=95%,P<0.000 01,提示有明显异质性。通过敏感性分析,文献[9]、文献[10]、文献[11]、文献[13]和文献[14]对本次Meta分析的研究结果存在较大干扰,剔除后纳入研究的异质性降低(P=0.16,I2=30%),通过固定效应模型进行分析。结果显示,观察组患者的ALT水平明显低于对照组,差异有统计学意义(MD=-17.05,95%CI=-20.29~-13.81,P<0.000 01),见图4。
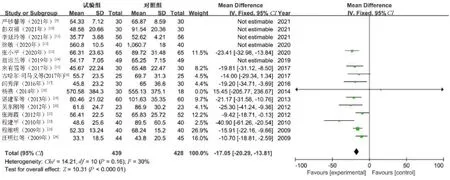
图4 ALT水平的Meta分析森林图Fig 4 Meta-analysis on ALT level
2.4.4 AST:15篇文献[9-18,21-25]报告了AST水平,共1 277例患者(观察组644例,对照组633例)。异质性检验结果显示,I2=93%,P<0.000 01,提示有明显异质性。通过敏感性分析,文献[10]、文献[12]和文献[13]对本次Meta分析的研究结果存在较大干扰,剔除后纳入研究的异质性降低(P=0.15,I2=30%),通过固定效应模型进行分析。结果显示,观察组患者的AST水平明显低于对照组,差异有统计学意义(MD=-9.89,95%CI=-11.25~-8.53,P<0.000 01),见图5。
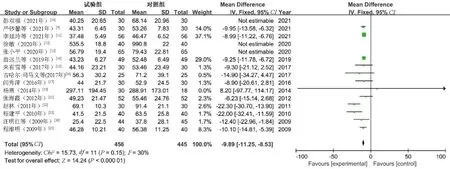
图5 AST水平的Meta分析森林图Fig 5 Meta-analysis on AST level
2.4.5 ALP:3篇文献[9,16,25]报告了ALP水平,共190例患者(观察组95例,对照组95例),以MD值作为合并效应量。异质性检验结果显示,各研究间同质性较高(P=0.18,I2=42%),采用固定效应模型合并效应量分析。Meta分析结果显示,观察组患者的ALP水平明显低于对照组,差异有统计学意义(MD=-15.27,95%CI=-20.62~-9.92,P<0.000 01),见图6。
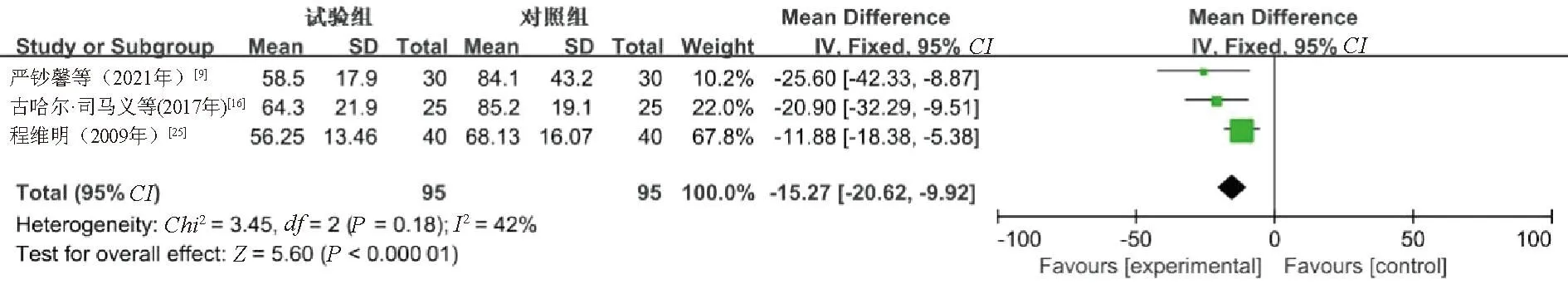
图6 ALP水平的Meta分析森林图Fig 6 Meta-analysis on ALP level
2.4.6 DBIL:4篇文献[16,18-19,25]报告了DBIL水平,共298例患者(观察组155例,对照组143例)。不同研究数据间均数差异性偏大,故以SMD值作为合并效应量。异质性检验结果(P<0.000 01,I2=97%)提示有明显异质性,该结局指标不适合进行Meta分析,仅进行组间比较。结果显示,仅文献[18]中两组患者DBIL水平的差异无统计学意义(MD=10.9,95%CI=-20.07~41.87,P=0.49),其余文献中观察组患者的DBIL水平均明显低于对照组,差异均有统计学意义(文献[16]:MD=-14.5,95%CI=-22.62~-6.38,P=0.000 5;文献[19]:MD=-42.14,95%CI=-46.49~-37.79,P=0.000 5;文献[25]:MD=-6.15,95%CI=-10.15~-2.15,P=0.003)。从整体上看,舒肝宁注射液联合西药在降低DBIL水平方面有明显优势。
2.4.7 不良反应:9篇文献[9-12,15,17,19,21,24]报告了不良反应发生情况,共发现58例不良反应(其中观察组24例,对照组34例),多为疲乏、头痛、眩晕、皮疹、皮肤瘙痒、恶心呕吐、腹泻等,干预后症状缓解或消失,均未影响治疗。各研究间存在异质性(P=0.09,I2=41%),故Meta分析采用随机效应模型,研究结果显示,观察组与对照组患者不良反应发生率的差异无统计学意义(RR=0.82,95%CI=0.37~1.83,P=0.63),即舒肝宁注射液不能降低不良反应发生率,但从总体效应上看,优势明显趋于观察组,见图7。
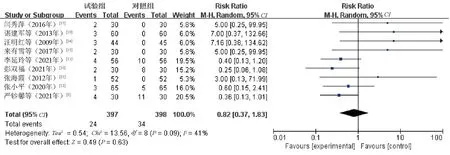
图7 不良反应发生率的Meta分析森林图Fig 7 Meta-analysis on incidence of adverse drug reactions
2.5 发表偏倚分析
对纳入文献研究数量≥10篇的结局指标临床总有效率、TBIL、ALT和AST,使用R语言进行倒漏斗图的绘制和Egger检验。漏斗图两侧分布不对称,说明可能存在发表偏倚;运用Egger检验进一步定量分析,结果显示,总有效率(t=5.39,P=0.002 0)、TBIL(t=-2.92,P=0.011 9)、ALT(t=-4.55,P=0.000 5)存在发表偏倚,AST(t=-1.00,P=0.337 5)不存在发表偏倚,见图8。

A.总有效率;B.TBIL;C.ALT;D.AST。A.total clinical effective rate; B.TBIL; C.ALT; D.AST.图8 发表偏倚漏斗图Fig 8 Funnel plot of publication bias
3 讨论
中医学中,正气不足、湿热疫毒隐伏是病毒性肝炎的发病基础,其临床表现为黄疸、肝区疼痛、乏力、食欲减退等,与相关肝功能指标(如ALT、AST等)具有相关性[34-36]。舒肝宁注射液具有护肝保肝、扶正益气、清热解毒、退黄利湿的功效[27,37],与中医强调的以“祛邪扶正”为治则,包括清热利湿、解毒疏肝、保肝利胆的辨证施治不谋而合,在临床上得到了广泛应用。
3.1 临床总有效率
西医对病毒性肝炎的发病原因统一认为是由包括甲型肝炎病毒、乙型肝炎病毒(HBV)、戊型肝炎病毒在内的病毒引起的,或通过免疫介导使肝细胞受损,导致肝功能出现异常[38-39]。《舒肝宁注射液治疗急性和慢性肝病专家共识(2020版)》[34]中指出,临床上配合使用舒肝宁注射液,对急性或慢性病毒性肝炎、肝硬化等均有不同程度的抗炎、保肝、利胆等功效。也有研究结果表明,舒肝宁注射液可显著抑制HepG2.2.15细胞中稳定复制的野生型HBV和HepG2.A64细胞中稳定复制的恩替卡韦耐药型HBV的复制,与低浓度恩替卡韦或替诺福韦酯联合应用时,可协同增强其抗病毒的功效[40]。此外,舒肝宁注射液还可以通过抗炎、保护肝细胞等来达到治疗肝炎的目的。其成分栀子具有保肝、抗炎等功效[41],与茵陈合用可起到保护肝细胞膜、避免肝细胞坏死以及改善肝脏微循环的作用[10]。舒肝宁注射液的组分合用起效,在临床上综合表现为显著改善临床症状,提高治疗有效率。
3.2 肝功能指标
肝脏生化指标检测是临床用于判断肝功能异常的最基本方式,在病毒性肝炎的诊断中表现为AST、ALT、TBIL、ALP及DBIL等任一肝功能指标的病理性异常升高,临床上多采用降低该类指标的数值反映干预措施的治疗效果[30,42]。本研究中,舒肝宁注射液中的茵陈及其有效成分可诱导肝酶系统,增强肝脏对胆红素的摄取、结合、排泄能力,促进胆红素的清除,降低TBIL水平[43]。栀子苷通过激活磷酸肌醇3-激酶蛋白/丝氨酸/苏氨酸蛋白激酶信号通路,可降低炎症因子水平,改善肝组织病理损伤;还可以显著降低病毒性肝炎患者的ALT、AST、TBIL、直接胆红素等指标水平,改善大鼠肝功能[44]。本研究结果显示,舒肝宁注射液联合西药可以显著降低TBIL、DBIL、ALT、AST、ALP水平,促进肝功能恢复正常,提高临床治愈率。
3.3 安全性
9篇文献报告了不良反应,结果显示,与对照组相比,总体效应优势趋于观察组,且每篇文献报告的不良反应均未影响治疗,用药安全性较高。
3.4 研究的局限性
本研究存在一定的局限性:(1)纳入的大多数研究为小样本研究,且质量偏低,多数研究未描述随机分组方法、盲法和方案的隐藏,可能会造成发表偏倚,结论强度受到一定限制;(2)所纳入研究的治疗方法、给药时间、剂量、疗程及联合用药在规定范围内有所差别,虽然本研究已经采用亚组分析,但是仍可能会导致研究结果的真实性降低;(3)本研究是针对病毒性肝炎所进行的系统评价,由于临床上病毒性肝炎又可细分为多种不同类型,病因较为复杂,可能会导致异质性。
综上所述,本研究结果显示,与常规西药治疗相比,舒肝宁注射液联合常规西药治疗病毒性肝炎患者可显著提高临床疗效,降低TBIL、ALT、AST、ALP及DBIL水平,改善肝功能,且在降低不良反应的发生率方面具有优势。今后应开展更多更高质量的多中心、大样本和前瞻性的随机、双盲临床研究进一步验证。
