华北退化荒地建植豆类和禾本植物人工草地对土壤真菌群落结构和功能的影响
2024-01-17阚海明马晓东徐恒康张国芳武菊英
阚海明,陈 超,马晓东,徐恒康,庞 卓,张国芳,武菊英
1 北京市农林科学院草业花卉与景观生态研究所,北京 100093 2 山东农业工程学院林业工程学院,济南 250100
草原是全球生态系统的重要组成部分,约占地球陆地总面积的40%和世界农业用地的69%[1-2]。在全球气候变暖、人类活动频繁的大背景下,草地退化现象普遍存在且日趋严重[3-4]。统计数据显示,约50%的草地遭受不同程度的退化,而干旱和半干旱地区尤甚[5]。草原退化会导致诸如土壤碳流失等环境问题,大大削弱草原生态系统作为稳定碳库的关键作用,最终导致全球碳循环等功能过程和土壤养分条件的恶化[6-8]。退化荒地是干旱半干旱地区重要的土地资源,采用建植人工草地的方式,可达到退化荒地植被生态恢复的目的。植被生态恢复效果的好坏,关系到提高区域生产力、保护区域生态环境、保障资源可持续利用和经济可持续发展等关键问题[6]。因此,开展人工草地建植工程,充分利用好退化荒地资源,有利于实现人与自然和谐相处,最终驱动区域经济、生态、社会的协调发展[1]。
土壤真菌群落不仅是土壤生态系统功能的指标,在采取适当管理措施的情况下还可促进植被恢复过程和系统健康,因而是退化生态系统恢复的重要基础[9-10]。微生物功能群是根据微生物的生态功能,对生态功能相似的物种进行的功能分组[11]。其中,土壤真菌功能群主要反映的是真菌对植物宿主的依赖程度[12-14]。例如,菌根等共生真菌与70%-90%的陆生植物建立共生关系,通过提高宿主植物在环境胁迫下的养分利用效率和抗性来促进植物生长[15-16]。腐生真菌对植物生长和代谢活动至关重要,因其能够降解凋落物和腐殖质,为土壤中的植物提供额外的养分[17]。病原真菌是生物胁迫的主要来源,它们侵染特定宿主并改变植被的种间竞争模式,最终导致植物群落多样性的变化[18]。前人研究揭示了共生真菌、腐生真菌和病原真菌在调节草原生态系统中植被-土壤-微生物关系中的协同作用[19-20]。迄今为止,多数研究关注了天然植被演替过程中土壤微生物群落的变化。然而,高度退化草原的植被覆盖率极低,利用自然恢复策略修复高度退化草原效果不佳,建植人工草地是恢复这类草原植被的常用管理策略[21]。
紫花苜蓿(Medicagosativa)和无芒雀麦(Bromusinermis)均为多年生优质牧草,在我国有非常广阔的种植面积,在改良土壤、培肥地力、保持水土等方面具有独特作用[22-23]。本研究在华北半干旱区的退化土地长期生态定位站开展了田间试验,通过模拟退化草原不同生态管理措施,探明建植豆科植物和禾本植物人工草地对土壤真菌群落结构和生态功能特性的影响。在此基础上,通过测定植被生物量和物种多样性,结合土壤理化因子等数据,分析土壤真菌结构与环境因子之间的关系。本研究的结果可从土壤真菌的角度为华北地区退化草原生态系统管理策略提供理论依据,并为开拓紫花苜蓿等优质牧草的市场应用前景提供实践依据。
1 材料与方法
1.1 研究区域概况
本研究的田间试验位于北京市延庆区的退化土地长期生态定位站(40°27′53″N,115°50′23″E;501 m a.s.l.;图1)。本区域属温带半干旱地区,是典型的大陆性季风气候,夏季炎热多雨,冬季寒冷干燥。年平均气温(MAT)为 8.4℃,其中7月(24.0℃)是最热的月份。年平均降水量(MAP)为466 mm,降雨主要集中在植物生长期(5-9月),约占年降雨总量的85.6%,年平均相对湿度为62%。土壤质地介于壤土和沙土之间,研究区域的植被以荒地植物为主,包括白草(Pennisetumcentrasiaticum)、臭草(Melicascabrosa)和菌陈蒿(Artemisiacapillaris)等。

图1 研究区域和实验设置Fig.1 Study area and experimental setupCK:对照;LG:豆科植物人工草地;GG:禾本植物人工草地
1.2 试验设计与取样
该试验于2015年在土壤质地和植被分布相对均匀的退化荒地进行,设置3种退化草原生态系统植被恢复方法:
(1)对照组(CK):通过植被的自然生长恢复退化荒地;
(2)建植豆科植物草地(LG):2015年5月,将紫花苜蓿种子以200粒/m2的密度免耕播种;
(3)建植禾本科植物草地(GG):2015年5月,将无芒雀麦种子以200粒/m2的密度免耕播种。
播种后,先灌溉和施肥以确保草的成活,此后植被的生长主要依靠天然降水。植被建立后,将研究区域围栏封育。每个处理区域约1 hm2,本研究随机选取9块10 m×10 m的样地(图1),每种管理方法各三块样地,每块样地相距约50 m。2019-2021年的每年8月份,在每个样点随机抽取3个平行的1 m×1 m样方,记录每样方内植物的种名,用尺子测量每株植物的高度,计算植物总盖度,依照Steinauer 等人[24]描述的方法在样方内收割植被的地上部分并留样,用于测定植被生物量。每种管理方法需在3块样地的9个样方内取9个重复土壤样本,3年时间共取27个样本。
1.3 土壤样品采集
土壤样品取样前,先去除土层顶部的凋落物。使用不锈钢取土钻从每个样方分别收集土层0-30 cm深度的五个子样品,用手去除土壤子样品中的根、土壤动物、石子后,将各样方中相同土层深度的子样品混合,过2 mm网筛后将其分为几个部分:一部分保存在-80℃用于DNA提取,一部分保存在4℃用于测定有效氮(AN)、有效磷(AP)等指标,剩余部分置于阴凉干燥处自然风干,测定土壤中的pH、总有机碳(TOC)、总氮(TN)、总磷(TP)等土壤理化指标。
1.4 土壤理化性质测定
使用pH计在土壤/水(体积比1∶2.5)悬浮液中测定土壤pH值。土壤容重(BD)采用环刀法测定:利用环刀采集不稳定的天然土壤样品并烘干,BD计算公式为:BD (g/cm3) = 土壤干重 (g)/土壤体积 (cm3)。TOC含量通过重铬酸钾氧化外加热法测定[25]。AN通过碱解还原扩散法测定[26]。采用碳酸氢钠萃取法和钼蓝法测定AP[27]。使用元素分析仪(Vario Macro,德国)测定TN。使用紫外可见分光光度计测定TP(钼蓝法)。
1.5 Illumina MiSeq测序
利用E.Z.N.A.®土壤DNA试剂盒(Omega Bio-tek, 美国)从土壤样品中提取微生物群落基因组DNA样品,使用琼脂糖凝胶电泳和NanoDrop2000紫外可见分光光度计(Thermo Scientific,美国)检测DNA提取物的浓度和纯度。以引物对ITS3_KYO2F (5′-GATGAAGAACGYAGYRAA-3′)和ITS4R (5′-TCCTCCGCTTATTGATATGC-3′)扩增真核生物核糖体 RNA基因 ITS 的 ITS2 区。PCR反应体系包含 5×TransStart FastPfu 缓冲液 4 μL、2.5 mM dNTPs 2 μL、正向引物 (5 μM) 0.8 μL、反向引物 (5 μM) 0.8 μL、TransStart FastPfu DNA 聚合酶 0.4 μL、模板 DNA 10 ng,最后用dd H2O补足至总体积20 μL。PCR扩增条件如下:95℃初始变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,共27个循环,72℃单次延伸10 min,4℃结束。每个样本3个重复,从2%琼脂糖凝胶中提取PCR产物并使用AxyPrep DNA 凝胶提取试剂盒(Axygen Biosciences,美国)进行回收产物纯化,并使用 QuantusTM荧光计(Promega,美国)进行定量,合格的PCR产物在Illumina MiSeq平台上机测序。使用Fastp 0.20.0版本对原始数据进行解复用和质量过滤[28],按照标准协议(Majorbio公司,中国上海)对获得的序列进行合并。根据不同聚类程序的特点,生成操作分类单元(OTU)和扩增子序列变体(ASVs),分别分析真菌群落多样性和真菌功能群[29]。本研究使用UPARSE 7.1版软件以97%的相似度为界限对OTU进行聚类,使用QIIME2管道中的DADA2插件[30],通过噪声抑制进行质量控制拼接后,从优化的序列中获得ASVs。使用QIIME2中的Naive Bayes分类器对ASVs进行物种分类分析。
1.6 数据处理
采用LEfSe方法 (http://huttenhower.sph.harvard.edu/lefse/)识别人工草地的潜在微生物生物标志物。使用R v.3.5.4 (https://www.r-project.org/) 软件中的phyloseq R包进行微生物α多样性(包括 Chao 和 Shannon 指数)分析。使用 vegan R包进行非度量多维尺度分析 (NMDS),并利用相似性分析 (ANOSIM) 来确定各处理的样本之间的差异。使用vegan R包进行主坐标约束性分析 (CAP) 可视化微生物组成与环境因素之间的关系,Mantel检测用于检验微生物群落距离矩阵和环境变量距离矩阵之间的相关性和显著性。利用FUNGuild软件用于分析真菌的功能群,有助于预测不同植被恢复方法实施过程中土壤真菌群落的潜在功能。基于数据库FUNGuild中已报告的各分类水平的功能群数据,本研究中的真菌群落划分为三大类功能群,即病原真菌、腐生真菌和共生真菌[31]。根据Lozano等人[32]描述的功能群分类标准,本研究中39.2%的ASV可以被归入三个真菌功能群,其中病原真菌占5.0%,腐生真菌占25.1%,共生真菌占9.2%;91.3%的共生真菌是丛枝菌根真菌(AMF)。
2 结果与分析
2.1 土壤真菌群落组成
通过对81个样本的微生物多样性数据分析,共获得高质量ITS序列708 8322个,它们聚集成6 315个OTU,隶属于真菌17门60纲145目347科896属。三个最丰富的真菌门是Ascomycetes、Mortierellomycota、Basidiomycetes,占土壤真菌总数量的73.3%-99.6%。所有样品中相对丰度最高的真菌门是Ascomycetes,CK、LG和GG处理下Ascomycetes的平均丰度分别为68.5%、63.5%和58.9%。LG处理相较于CK的Basidiomycetes相对丰度明显升高,GG处理相较于CK的Mortierellomycota相对丰度明显提高(图2)。属水平上,人工草地的建植显著(P<0.05)增加Fusarium、Gibellulopsis、Beauveria、Trichocladium、Aphanoascus、Lophotrichus的丰度,但显著(P<0.05)降低Paraphoma、Titaea、Periconia的丰度(图2)。使用LEfSe方法中的一对多比较策略确定各处理潜在的土壤微生物生物标志物。LG处理下真菌生物标志物(阈值为 3)的丰度均高于CK,而GG处理下真菌生物标志物的丰度低于CK(图3)。

图2 2019-2021年CK、LG和GG处理下退化草地的土壤真菌群落组成Fig.2 Microbial community composition in degraded grasslands under the CK, LG, and GG treatments from 2019 to 2021标有*、**和***的值分别表示0.05、0.01和0.001水平的显著差异,19、20、21分别表示于2019年、2020年、2021年取样;Ascomycota:子囊菌门;Mortierellomycota:被孢霉门;Basidiomycota:担子菌门;Unclassified未分类的;Glomeromycota:球囊菌门;Chytridiomycota:壶菌门;Others:其它的;Fusarium:镰刀菌属;Gibellulopsis:吉贝罗普西属;Paraphoma:异茎点霉属;Beauveria:白僵菌属;Trichocladium:短梗蠕孢属;Titaea:Titaea属;Periconia:黑团孢属;Aphanoascus:隐囊菌属;Lophotrichus:瓶毛壳属

图3 基于LEfSe分析的退化荒地植被恢复与重建的真菌群落的生物标志物Fig.3 Microbial biomarkers of fungal communities for vegetation restoration of a degraded grassland based on the LEfSe analysisLEfSe:线性判别分析;进化分枝图的圆圈从内到外表示从门到属的分类群,处理间丰度差异显著的分类群用彩色圆点标记,图中显示了高于阈值3.0的真菌LEfSe分析结果
2.2 土壤真菌群落多样性
本研究选取Chao丰富度指数和香农多样性指数作为微生物α多样性代表。如图4a所示,CK和GG处理间的α多样性指数无显著差异。LG处理下真菌Chao丰富度显著(P<0.05)高于CK,但与GG处理无显著差异; 而LG处理下的真菌的香农多样性显著(P<0.05)高于GG,但与CK无显著差异。基于OTU之间 Bray-Curtis距离的 NMDS 分析可应用于可视化各处理间的群落水平相似性。NMDS结果显示,GG处理下真菌群落结构与CK相比完全分离,LG处理下真菌群落结构与其它处理未分离(图4)。ANOSIM 用于确定不同处理的样品间的距离是否显著大于各处理的内部样品间的距离。结果表明,不同处理方法显著影响了土壤真菌群落的结构(基于 999个随机排列,R=0.421,P<0.001),LG处理相较于其他处理对土壤真菌群落结构影响更大(图4)。
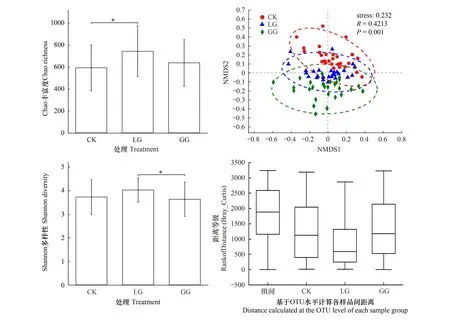
图4 CK、LG、GG处理下退化荒地植被恢复与重建的土壤真菌多样性指数Fig.4 Soil fungal diversity indices under CK, LG, and GG treatments for vegetation restoration of the degraded wasteland. Chao richness index of the fungal community
2.3 真菌群落多样性关联环境因子
基于各处理样品的土壤理化性质和Bray-Curtis距离等指标,采用CAP分析了土壤真菌群落结构与环境因子之间的关系。如图5所示,三组样品的真菌群落结构分离明显:CK的真菌群落结构落在第一象限,LG处理的真菌群落结构落在第三、四象限,GG处理的真菌群落结构落在第二象限。土壤容重和凋落物质量等因素落在第一象限,AN落在第二象限,pH、植被物种丰富度和生物量、TOC、TN、TP、AP等因素均落在三、四象限。Mantel检验分析表明,TOC、TN、TP、AN、植物物种丰富度、根系生物量、凋落物质量均与真菌群落结构显著(P<0.05)相关(表1)。
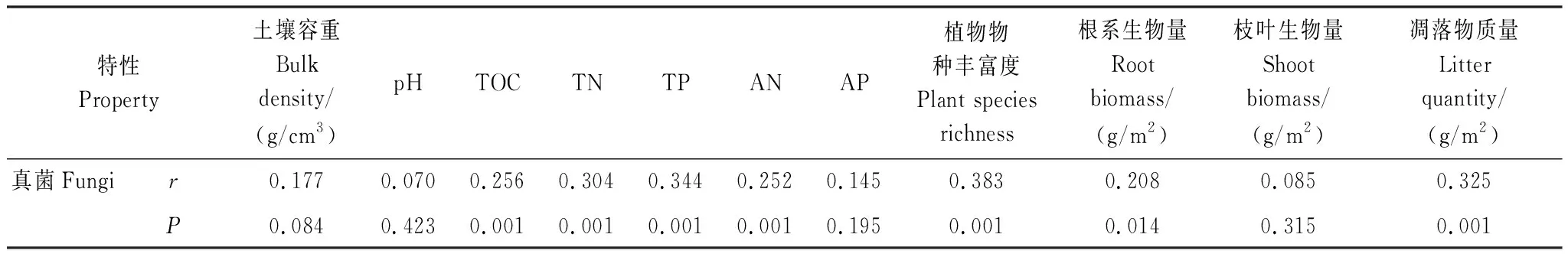
表1 土壤真菌群落结构与环境因子的Mantel检验分析Table 1 Mantel test analysis between soil fungal community structure and environmental factors across all samples

图5 退化荒地各处理土壤样品的真菌群落与环境因子之间关系的主坐标约束分析(CAP)Fig.5 Constrained analysis of principal coordinates (CAP) of fungal communities with environmental factors under CK, LG, and GG treatments for the degraded wastelandpH:酸碱度;TOC:总有机碳;TN:总氮;TP:总磷;AN:有效氮;AP:有效磷
2.4 土壤真菌群落功能群特征
本研究利用FUNGuild 预测了退化荒地土壤真菌功能群的分类,并重点关注了可以完全归为共生真菌、腐生真菌和病原真菌三大类功能群的土壤真菌。如图6所示,丰度最大的功能群是“未定义的腐生真菌”,在CK、LG和GG 处理下的平均丰度分别为23.72%、17.32%和18.65%,而“内生真菌-凋落物腐生真菌-土壤腐生真菌-未定义的腐生真菌”的平均丰度在CK、LG和GG处理下的平均丰度分别为19.69%、19.49%和30.60%。可归为三大类功能群的土壤真菌中,共生真菌包括外生菌根真菌(EMF)、AMF、兰花菌根真菌和石蜡菌根真菌,建植豆类和禾本植物人工草地显著(P<0.05)增加了EMF的丰度,但降低了AMF、兰花菌根真菌和石蜡菌根真菌的丰度。本研究关注了六种主要腐生真菌,即木材腐生真菌、土壤腐生真菌、植物腐生真菌、叶腐生真菌、粪便腐生真菌和未定义的腐生真菌,以及同时具有两种或两种以上功能类型的腐生真菌。与CK相比,LG和GG处理显著(P<0.05)增加了总体腐生真菌的丰度,而单一或多种功能类型腐生真菌的丰度在不同处理之间差异很大。病原真菌主要有植物和动物病原真菌,LG和GG处理相较于CK的植物和动物病原真菌的丰度显著(P<0.05)升高(图6)。

图6 各处理下基于FUNGuild分类的真菌功能群相对丰度Fig.6 Relative abundance of fungal groups classified by FUNGuild under the CK, LG, and GG treatments
如图7所示,病原真菌相对丰度最高的4个真菌纲是Agaricomycetes、Dothideomycetes、Cystobasidiomycetes、Chytridiomycetes,它们占病原真菌总数量的98.3%-99.1%。所有样品中相对丰度最高的病原真菌纲是Agaricomycetes,CK、LG和GG处理下Agaricomycetes的平均丰度分别为88.1%、86.6%和85.6%。LG处理增加Cystobasidiomycetes、Chytridiomycetes的丰度,但降低Agaricomycetes的丰度。GG处理增加Dothideomycetes、Cystobasidiomycetes的丰度,也降低了Agaricomycetes的丰度。如图7所示,腐生真菌相对丰度最高的7个真菌纲是Sordariomycetes、Dothideomycetes、Eurotiomycetes、Agaricomycetes、Leotiomycetes、Pezizomycotina_cls_Incertae_sedis、Tremellomycetes,它们占腐生真菌总数量的98.3%-99.1%。所有样品中相对丰度最高的病原真菌纲是Sordariomycetes,CK、LG和GG处理下Sordariomycetes的平均丰度分别为44.2%、44.8%和56.9%。LG处理显著(P<0.05)增加Agaricomycetes、Leotiomycetes、Pezizomycotina_cls_Incertae_sedis的丰度,但显著(P<0.05)降低Dothideomycetes、Eurotiomycetes、Tremellomycetes的丰度。GG处理显著(P<0.05)增加Sordariomycetes、Leotiomycetes、Pezizomycotina_cls_Incertae_sedis的丰度,但显著(P<0.05)降低Dothideomycetes、Eurotiomycetes的丰度。如图7所示,共生真菌相对丰度最高的7个真菌纲是Glomeromycetes、unclassified_p__Glomeromycota、Agaricomycetes、Eurotiomycetes、Leotiomycetes、Paraglomeromycetes、Dothideomycetes,它们占土壤真菌总数量的99.9%-100.0%。所有样品中相对丰度最高的病原真菌纲是Glomeromycetes,CK、LG和GG处理下Glomeromycetes的平均丰度分别为90.3%、73.8%和86.9%。LG处理显著(P<0.05)增加unclassified_p__Glomeromycota、Eurotiomycetes、Paraglomeromycetes、Dothideomycetes的丰度,但显著(P<0.05)降低Glomeromycetes、Agaricomycetes的丰度。GG处理显著(P<0.05)增加unclassified_p__Glomeromycota、Agaricomycetes、Dothideomycetes的丰度,但显著(P<0.05)降低Glomeromycetes、Eurotiomycetes、Paraglomeromycetes的丰度。

图7 CK、LG和GG处理下沙荒地真菌功能群的组成Fig.7 Fungal group composition in the degraded wastelands under the CK, LG, and GG treatmentsAgaricomycetes:伞菌纲;Dothideomycetes:座囊菌纲;Cystobasidiomycetes:囊担菌纲;Chytridiomycetes:壶菌纲;Sordariomycetes:粪壳菌纲;Eurotiomycetes:散囊菌纲;Leotiomycetes:锤舌菌纲;Pezizomycotina_cls_Incertae_sedis:盘菌亚门未分类纲;Tremellomycetes:银耳纲;Glomeromycetes:球囊菌纲;unclassified_p__Glomeromycota:球囊菌门未分类纲;Paraglomeromycetes:类球囊霉纲
3 讨论
3.1 建植人工草地对土壤真菌群落结构和多样性的影响
本研究分析了不同分类水平下土壤真菌群落组成的变化。绝大多数样品中丰度最高的真菌门是Ascomycetes,这与黄土高原子午岭林区、东北大兴安岭林区土壤真菌群落的研究结论相似[33-34],即Ascomycetes是草地土壤样品中的优势真菌门。Ascomycetes是一类可分解木质素、角质素等难降解有机物的土壤腐生真菌,易受到植物种类和植物残茬的强烈影响[35]。另一类自然界中分布较广的腐生真菌是Basidiomycota,它们在各处理中呈现出与Ascomycetes相反的变化规律,这与Ascomycetes优势度有较大关联[36-37]。Mortierellomycota因与土壤养分关系密切被视为养分指示类群,它们在禾本植物草地中丰度最高,这与禾本植物草地土壤养分更丰富的事实相吻合[38]。一般认为微生物分类水平越低,生态功能相对越保守,因此,不同处理间差异显著的真菌属也值得关注[39]。豆类植物草地相较于其他草地增加了Fusarium和Beauveria的丰度,诸多研究表明它们可能是动物病原体和植物内生菌[40-41]。与此同时,建植人工草地抑制了病原真菌Paraphoma的生长[42]。
在本研究中,建植豆类植物草地增加了Chao丰富度和Shannon多样性等微生物α多样性,但建植禾本植物草地对微生物α多样性无显著影响。NMDS分析表明,不同处理下的土壤真菌群落结构受植物功能类型影响较大。这与Cline等[43]研究结果相一致,即禾本科植物、固氮豆科植物等植物功能类型是土壤真菌群落β多样性的主要驱动因素之一。LEfSe结果显示,LG处理的样品中真菌生物标志物的数量最多,其次是CK,GG处理最少。由于不同植物功能群与土壤养分水平相关性较强,作者们认为该结果是不同植物功能群宿主自身和土壤养分水平差异共同结果[44]。由此可知,人工草地用草的植物功能类型选择对退化荒地植被恢复与重建进程有较大影响。
3.2 微生物群落与环境因子的关系
CAP分析结果显示,土壤理化性质(pH、土壤容重、TOC、N、P等)、植被生物量、物种丰富度和凋落物质量等是微生物群落组成的重要驱动因素。根据土壤pH、磷、物种丰富度等环境变量,LG处理的真菌群落可沿CAP1轴分离,GG处理的真菌群落可根据土壤碳、氮等环境变量沿CAP2轴分离。此外,Mantel检验显示,真菌群落结构受植物物种丰富度、根系生物量、凋落物质量等植被参数的显著影响,并与TOC、TN、AN、TP等土壤养分含量显著相关。上述结果表明,随着LG和GG处理对土壤养分的快速消耗,复杂凋落物和土壤有机质的真菌分解类群丰度增加,并显著影响了相关微生物群落及其活动[33]。
3.3 真菌群落的功能预测
FUNGuild是预测土壤真菌功能群的实用工具[45]。结果显示,不同植被恢复方法改变了土壤真菌功能群的丰度。在本研究中,建植人工草地显著增加了EMF的相对丰度,但降低了真菌功能群中其他共生真菌的相对丰度。以往的研究表明,EMF具备通过释放胞外酶降解和获取有机氮的能力,EMF的增殖表明在有机养分含量相对较高的生态系统中,植物根系通过诱导外生菌根增加来提高有机养分的可获得性[46-47]。此外,本研究中还发现建植人工草地刺激了腐生真菌的总体数量增加,表明人工草地的有机养分形态更加丰富。需要注意的是,人工草地中病原真菌的相对丰度增加,表明在人工草地上放牧可能会增加对人类健康的不利风险[8]。
不同的植被恢复方法还改变了土壤真菌功能群的组成。纲水平上,建植人工草地对腐生真菌和共生真菌的组成比病原真菌组成影响更显著。研究表明,不同植物功能群关联的根系性状差异显著影响腐生真菌的组成,但对病原真菌群落组成影响很小[29, 37]。由于豆类植物和禾本植物优势度的增加,导致植被群落多样性和凋落物生化性质的变化,后者是决定腐生真菌群落组成的关键因素[29, 39]。在本研究中,禾本植物的凋落物顽固性强、生物可利用度低,因而Sordariomycetes等具有木质素分解能力的真菌丰度增加,相对富含氮的豆类植物有利于特定的Agaricomycetes、Leotiomycetes纲的腐生真菌和Eurotiomycetes、Paraglomeromycetes、Dothideomycetes纲的共生真菌生长。
4 结论
在本研究中,研究区域土壤表层样品的土壤真菌包括17门60纲145目347科896属。退化荒地植被恢复与重建过程中土壤真菌群落主要由Ascomycetes、Mortierellomycota和Basidiomycetes组成,土壤真菌功能群类型以腐生真菌为主,共生真菌次之,病原真菌最少。土壤真菌群落结构受地上植被变化的显著影响,且与土壤养分水平显著相关。建植人工草地对腐生真菌和共生真菌相较于病原真菌的群落组成影响更明显。在土壤养分消耗更大、凋落物输入更丰富的人工草地中,腐生真菌的丰度增加,共生真菌的丰度减少,这种适应性变化有利于增强真菌群落对有机养分的利用效率,表明土壤真菌在退化荒地植被恢复的土壤养分循环中发挥着关键的调节作用。综上,本研究的结果有助于理解建植人工草地与土壤真菌群落结构和功能之间的联系,并为退化草原生态系统植被恢复策略提供重要参考。
