MoS2/Ti3C2Tx异质复合材料的制备及电化学性能研究
2024-01-16陈璐宁
李 威,何 敏,3,陈璐宁,韩 林
(1.武汉科技大学冶金工业过程系统科学湖北省重点实验室,湖北 武汉,430065;2.武汉科技大学理学院,湖北 武汉,430065;3.武汉科技大学省部共建耐火材料与冶金国家重点实验室,湖北 武汉,430081)

已有研究表明,构建2D/2D异质复合结构不仅可以有效发挥单一2D材料的优势,还能借助协同效应进一步改善材料的电化学性能[7]。Chen等[8]采用真空抽滤结合激光刻蚀法制得MXene-MoS2柔性免支撑复合膜电极并用于微型超级电容器。所制复合电极的比容量较纯MXene材料电极相应值提高了60%,并且经6000次循环后仍能保持性能稳定。Chandran等[9]利用浸渍法将MoS2前驱体固定在MXene上,再经退火获得MoS2/MXene异质结构,所制复合材料电极在0.4 A/g电流密度下的最大比电容达到342 F/g。需要指出的是,MXene材料Ti3C2Tx的制备条件苛刻、制备过程复杂,材料易发生堆叠和氧化,且实际应用成本相对较高,在制备复合电极时大量使用MXene不利于电极电化学性能的充分发挥并增加了生产成本,故而有必要对MoS2/Ti3C2Tx异质复合材料的组成进行调控,从而进一步优化其结构和性能。因此,本文采用水热法制备MoS2/Ti3C2Tx异质复合材料,并借助SEM、XRD、XPS及电化学工作站对所制样品的形貌、结构、成分及电化学性能进行表征,以期为高容量异质复合电极材料的研发提供参考。
1 实验方法
1.1 试剂
四水合钼酸钠(Na2MoO4·4H2O)、硫脲(CH4N2S)、氢氧化钾(KOH)、钛碳化铝(Ti3AlC2)、氟化锂(LiF)、盐酸(HCl)等均为分析纯,去离子水为实验室自制。
1.2 材料的制备
1.2.1 MXene材料Ti3C2Tx的制备
采用选择性刻蚀法[10]制备MXene材料Ti3C2Tx。该制备方法依次分为刻蚀、洗涤和剥离3个主要步骤。首先,称取1.56 g的LiF加入20 mL浓度为9 mol/L的盐酸中,再向该溶液中缓慢加入1 g 的Ti3AlC2,在35 ℃下持续搅拌混合溶液48 h以保证其充分反应;然后,将混合液离心洗涤直至所得上清液为中性;将洗涤后的沉淀物移至试剂瓶中,往瓶中加入适量去离子水并充入氩气再超声处理90 min,获取上层液体即Ti3C2Tx分散液。
1.2.2 MoS2/Ti3C2Tx异质复合材料的制备
利用水热法制备MoS2/Ti3C2Tx异质复合材料。首先,取3组Ti3C2Tx分散液分别与适量去离子水混合,配制出体积均为35 mL的混合液,3组混合液中的Ti3C2Tx实际添加量分别为10、30、50 mg;混合液经超声处理1 h后向其中加入0.12 g 的Na2MoO4·4H2O并搅拌至溶解,再加入0.135 g 硫脲继续搅拌20 min,之后将混合液置于50 mL反应釜中,在200 ℃下反应24 h;依次使用水、无水乙醇离心洗涤反应所得固体产物,反复洗涤3遍后将固体产物移至50 ℃真空干燥箱中干燥12 h,所得MoS2/Ti3C2Tx异质复合材料样品按Ti3C2Tx实际添加量10、30、50 mg依次标记为S1、S2、S3。另外,在不添加Ti3C2Tx分散液的情况下,按照上述步骤制得纯MoS2作为对照样品。
1.3 样品的表征
利用 Apreo S HiVac 型扫描电子显微镜(SEM)及其附带的能谱仪(EDS)对样品形貌、结构及成分进行表征;使用SmartLab SE型 X 射线衍射仪 (XRD)表征样品的物相及晶体结构;借助AXIS SUPRA+型X射线光电子能谱仪(XPS)对样品中Mo、S、Ti、C等元素的价态进行表征。
1.4 电化学性能测试
利用上海辰华CHI660E型电化学工作站的三电极体系对所制样品进行电化学性能测试。其中对电极为铂电极,参比电极为氧化汞电极,所制样品为工作电极活性材料。工作电极的制备过程为:首先将样品与乙炔黑、聚偏二氟乙烯(PVDF)按质量比8∶1∶1混合成均匀分散的浆料,再把混合浆料均匀涂覆于洁净的泡沫镍正方形表面(1 cm×1 cm),经干燥处理后即可得到相应的工作电极,电极中的样品含量约为1 mg。电化学性能测试所用KOH 电解液的浓度为1 mol/L,测试电位区间为-0.85~0.4 V(相对于参比电极),循环伏安 (CV)测试的扫描速率为5 mV/s,恒电流充放电(GCD)测试的电流密度分别为1、2、4、5、10 A/g,电化学阻抗谱 (EIS)的测试频率范围为0.01 Hz~100 kHz,交流扰动电压为5 mV。
2 结果和讨论
2.1 样品的表征结果分析
图1所示为所制Ti3C2Tx、MoS2及MoS2/Ti3C2Tx异质复合材料(S2)样品粉体的XRD图谱。由图1可见,MoS2样品XRD图谱中的衍射峰位于2θ为14.2°、33.4°、39.2°及58.7°处,依次对应六方晶系2H相MoS2的(002)、(100)、(103)和(110)晶面(JCPDS No.00-37-1492),表明本实验成功制备了层状结构的MoS2。Ti3C2Tx样品XRD图谱中位于2θ为6.6°、18.2°、28.7°、36.3°和43.4°处的衍射峰依次对应Ti3C2Tx的(002)、(004)、(006)、(008) 和(0010)晶面[10-11],表明本实验成功制备了层状结构的Ti3C2Tx。S2样品XRD图谱中的最强衍射峰出现在2θ为6.2°处,相较于Ti3C2Tx的(002)晶面衍射峰的峰位向左偏移了0.4°,这可能是因为复合材料中MoS2的生长或插入导致Ti3C2Tx层间距增大所致。S2样品位于2θ为14.2°处的衍射峰对应2H相MoS2的(002)。S2样品位于2θ为33.3°和38.7°处的衍射峰特征与纯MoS2的(100)和(103)晶面衍射峰特征基本相符,只是前者特征峰所在位置向小角度方向略有偏移,这意味着MoS2与Ti3C2Tx构筑复合材料后,MoS2的团聚程度有所降低。上述分析表明本实验成功制备了MoS2/Ti3C2Tx异质复合材料。此外,S2样品位于2θ为47.9°、54.0°和54.9°处的衍射峰分别对应TiO2的(200)、(105)和(211)晶面(JCPDS No.01-071-1166),TiO2应为Ti3C2Tx在水热过程中的氧化产物。XRD测试结果表明,相较于单一的MoS2或Ti3C2Tx,二者复合成MoS2/Ti3C2Tx异质材料后,更利于离子的传输及暴露更多活性位点,从而获得更佳的电化学性能。
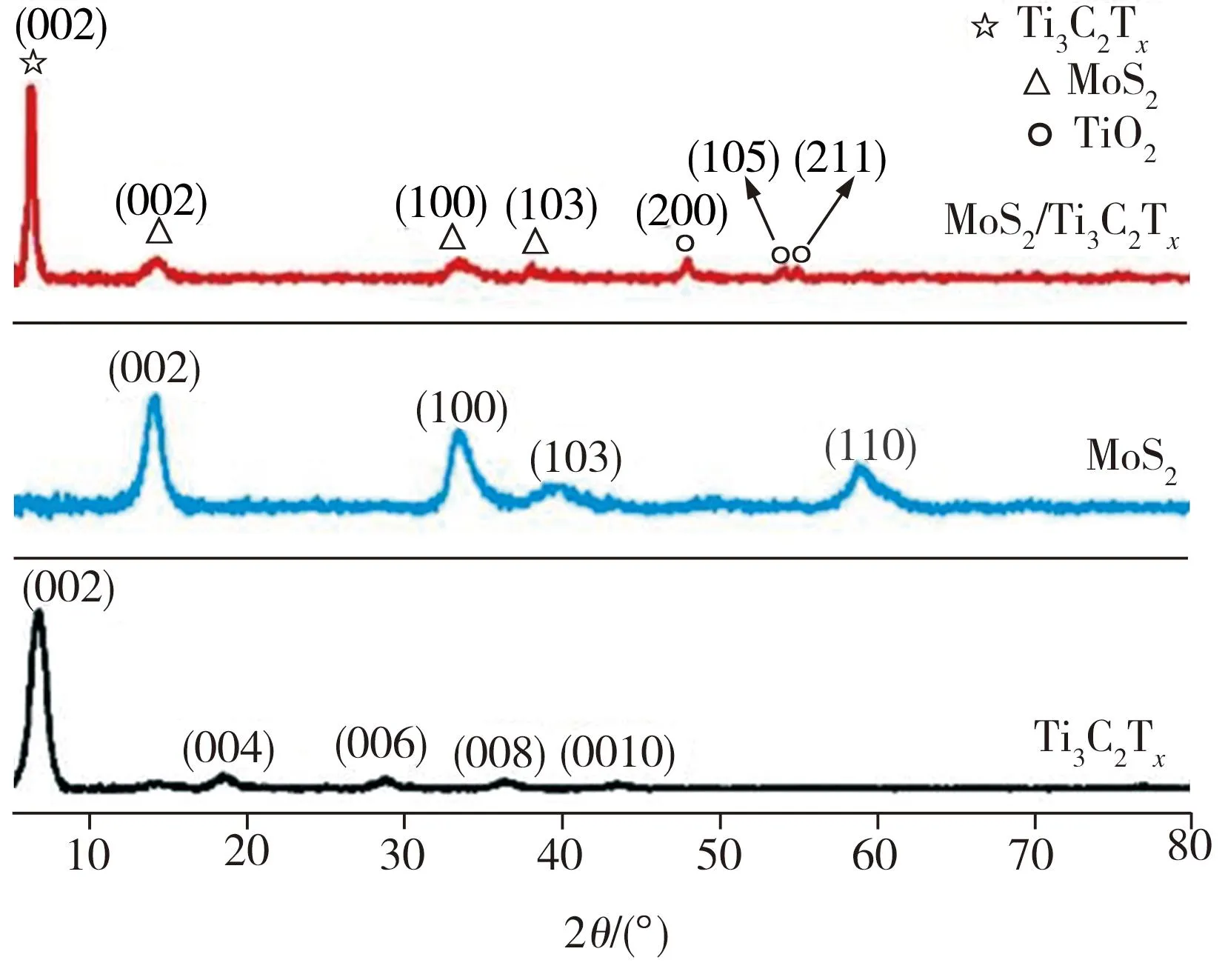
图1 Ti3C2Tx、MoS2和MoS2/Ti3C2Tx的XRD图谱
图2所示为所制Ti3C2Tx、MoS2及MoS2/Ti3C2Tx异质复合材料(S2)样品的SEM照片。由图2(a)可见,Ti3C2Tx呈薄片堆叠形貌,表面较平整且孔隙不多,薄片大小不一,可能是因刻蚀或超声处理所致。由图2(b)可见,MoS2由大量微米级不规则块状组织聚集而成,推测其为层状MoS2片的交织堆垛[12]。块状组织表面有明显的褶皱及微孔,微孔的存在有利于离子的输运。由图2(c)可见,与单一Ti3C2Tx或MoS2的微观形貌相比,MoS2/Ti3C2Tx异质复合材料中聚集的块状组织尺寸明显减小,团聚程度明显减轻,块状组织表面以及相邻块状组织间的孔隙更加丰富多样,颗粒外观更接近于所制备的MoS2。这再次证实引入Ti3C2Tx与MoS2形成异质结构能抑制MoS2的团聚,减轻单一材料的堆叠程度,有利于活性位点的暴露及电解液的进入。

(a)Ti3C2Tx (b)MoS2 (c)MoS2/Ti3C2Tx
借助EDS分析了MoS2/Ti3C2Tx异质复合材料(S2)样品的元素分布情况,结果如图3所示。由图3可以看出,复合材料样品中的Mo、S、Ti、C和O分布都很均匀,其中O的出现与水热反应造成Ti3C2Tx部分表面被氧化有关。该EDS测试结果表明复合材料中的Ti3C2Tx和 MoS2相分布均匀,进一步证实本文成功制备了MoS2/Ti3C2Tx异质复合材料。图4所示为MoS2/Ti3C2Tx异质复合材料(S2)样品的XPS测试结果,其中所有的XPS谱线均利用结合能为284.8 eV的C1s峰进行了校正。由图4(a)可见,MoS2/Ti3C2Tx异质复合材料的XPS总谱图中存在Ti、C、Mo、S及O的特征峰,这些元素组成与该样品的XRD及EDS测试结果一致。由图4(b)可见,Ti2p精细谱中459.3、465.4 eV处的特征峰分别对应Ti—O键的2p3/2和2p1/2电子态,这可能与Ti3C2Tx表面氧化产物TiO2有关,而456.24 eV处的特征峰则对应Ti—C键的2p1/2电子态。由图4(c)可见,Mo3d精细谱中229.48、232.7 eV处的特征峰分别对应MoS2中Mo4+的3d5/2和3d3/2电子态,226.3 eV处的特征峰应归属于S2s,这3个特征峰的出现是复合材料中存在MoS2的有力证据[13]。此外,MoS2/Ti3C2Tx异质结构中Mo4+的3d5/2、3d3/2和S2s的结合能均比纯MoS2相应的结合能低,表明MoS2与Ti3C2Tx存在较强的相互作用。同时注意到在Mo3d精细谱中236.11 eV处还有一个较弱的峰,该峰对应Mo6+的3d3/2电子态。Mo6+的出现应该是Mo4+在水热反应中发生了部分氧化所致,这表明Mo原子的3d轨道与Ti3C2Tx表面的氧存在相互作用[13]。由图4(d)可见,S2p精细谱中162.35、163.52 eV处的特征峰分别对应MoS2中S2-的2p3/2和2p1/2电子态。上述XPS测试结果再次证实本文利用水热法成功制备了MoS2/Ti3C2Tx异质复合材料。

(a)SEM (b)Mo (c)S
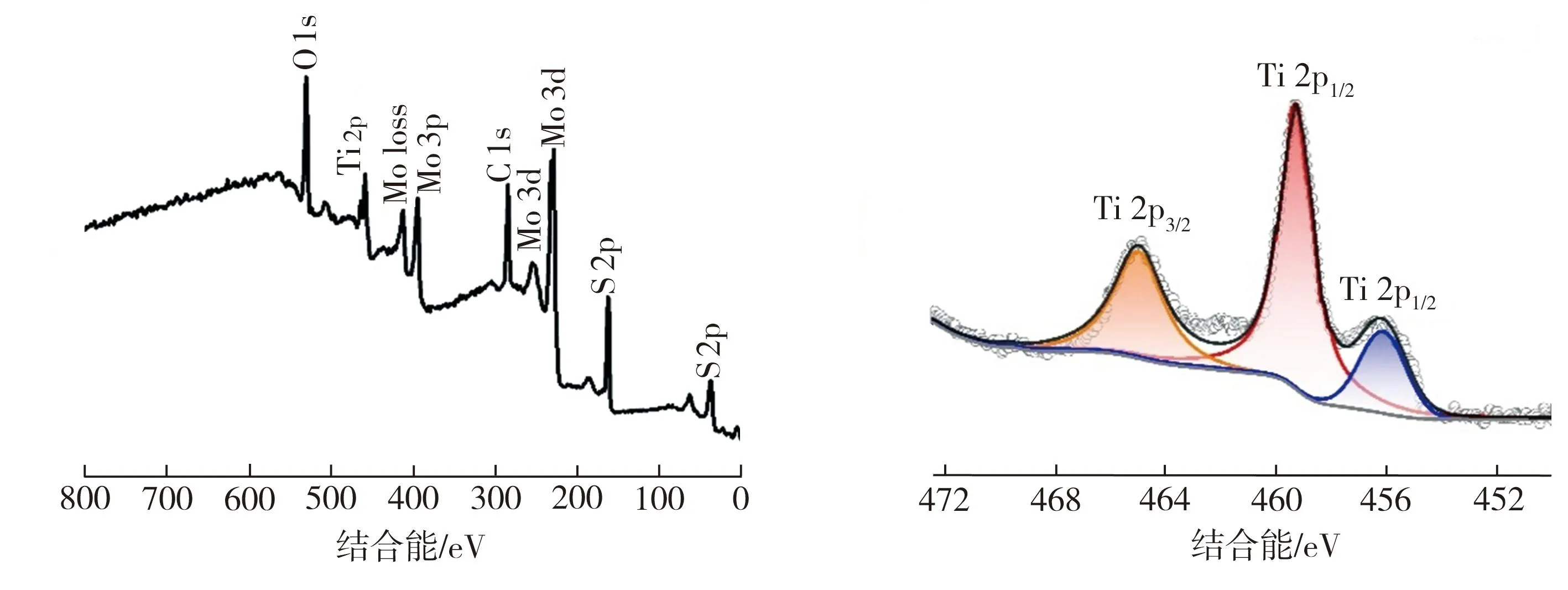
(a)XPS总谱图 (b)Ti2p精细谱
2.2 样品的电化学性能
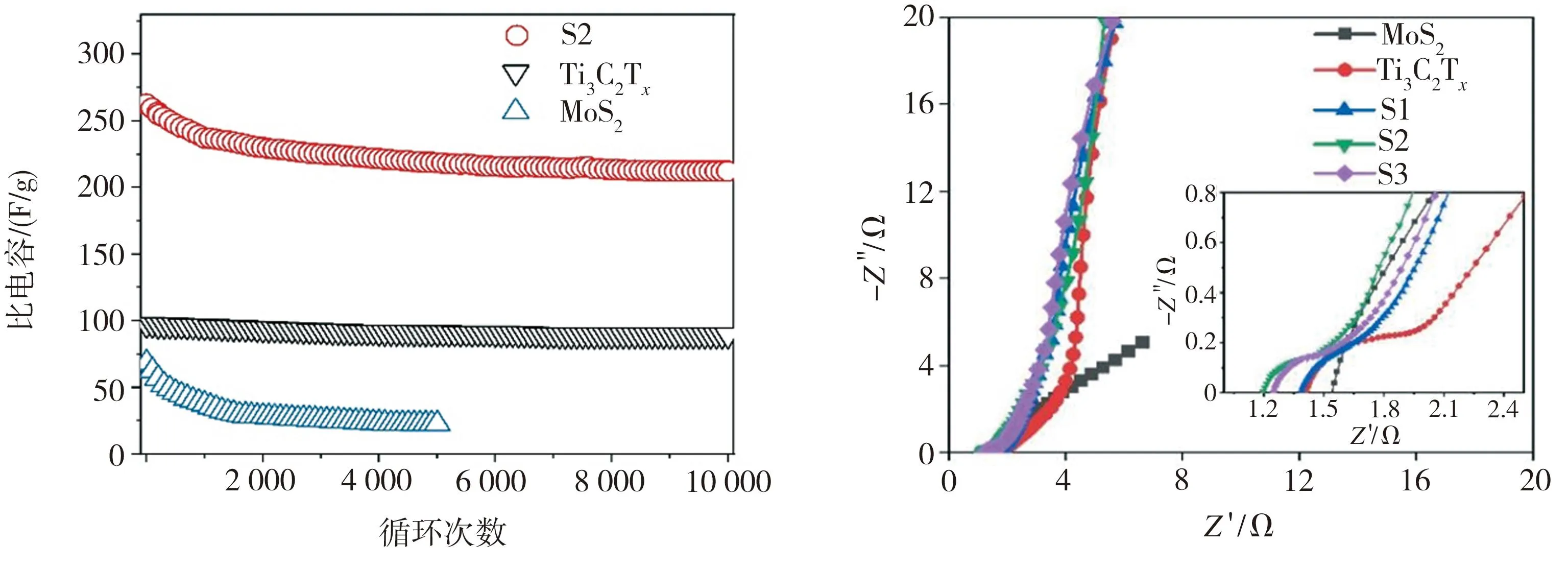
利用电化学工作站,以Ti3C2Tx、MoS2和MoS2/Ti3C2Tx(S1~S3)分别作为工作电极材料进行电化学性能测试,所得结果如图5所示。由图5(a)可见,Ti3C2Tx含量不同的3组MoS2/Ti3C2Tx电极的CV曲线积分面积均大于纯Ti3C2Tx或MoS2电极的CV曲线相应值,其中Ti3C2Tx含量为30 mg的MoS2/Ti3C2Tx(S2)电极的CV曲线积分面积最大。表明将MoS2与Ti3C2Tx复合能有效提升电极材料的比电容,并且Ti3C2Tx含量为30 mg的MoS2/Ti3C2Tx(S2)电极比电容最大。另外,电极材料CV曲线的形状也反映了其电化学作用机制。Ti3C2Tx电极CV曲线最接近矩形,表明其具有双电层电容特性。MoS2电极的CV曲线为准矩形,符合赝电容电极特征。MoS2/Ti3C2Tx复合材料电极的CV曲线为准矩形但未出现明显的氧化还原峰,表现出混合电容特性。由图5(b)可见,在电流密度为1 A/g的条件下,Ti3C2Tx含量不同的3组MoS2/Ti3C2Tx电极的GCD曲线与横轴(时间轴)所围面积均大于纯Ti3C2Tx或MoS2电极的GCD曲线与横轴所围面积,这同样表明MoS2/Ti3C2Tx复合材料电极的电化学性能较纯Ti3C2Tx或MoS2电极有明显提高。随着时间的延长,Ti3C2Tx电极的电位呈线性变化而MoS2和MoS2/Ti3C2Tx电极的电位均表现为非线性变化。表明MoS2/Ti3C2Tx复合材料电极为赝电容电极。当引入Ti3C2Tx后,电极GCD曲线的对称性增大,表明复合材料电极具有较强的电极反应可逆性。在5组测试电极中,Ti3C2Tx含量为30 mg的MoS2/Ti3C2Tx(S2)电极充放电时间最长,表明该电极具有最佳的电化学性能。由图5(c)可见,所有电极的比容量均随电流密度的增大而降低,电极材料按倍率性能由高到低依次为S2、S3、S1、Ti3C2Tx、MoS2。其中,在1 A/g电流密度下S2电极的比容量达到最大值,为262.54 F/g,分别是纯MoS2(68.2 F/g)和Ti3C2Tx(97.10 F/g)电极相应值的4倍和2.7倍。在电流密度为10 A/g时,纯MoS2电极的比电容最小,仅为20.24 F/g,而引入30 mg的Ti3C2Tx制成MoS2/Ti3C2Tx复合材料S2后,相应电极比电容达到172.33 F/g,增幅十分明显。
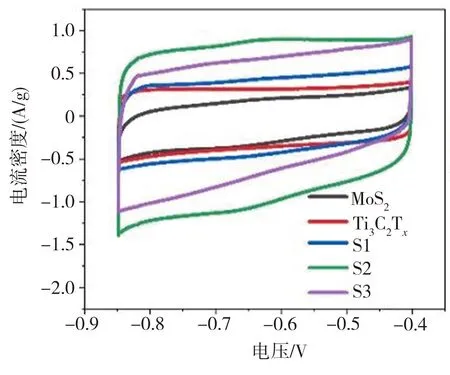
(a)CV曲线
以Ti3C2Tx含量为30 mg的MoS2/Ti3C2Tx复合材料作为工作电极,测试其在不同扫描速率下的CV曲线以及不同电流密度下的GCD曲线,结果如图6所示。由图6(a)可见,当扫描速率分别为2、5、10、20、50 mV/s时,MoS2/Ti3C2Tx复合材料电极的CV曲线形状无明显改变,均接近矩形,表明该电极倍率性能较好,并且在-0.7~-0.6 V之间出现较弱的氧化还原峰,表明所制MoS2/Ti3C2Tx异质复合材料电极同时具有赝电容和双电层电容特征。由图6(b)可见,MoS2/Ti3C2Tx复合材料电极的GCD曲线图形对称性较好且在低电流密度下没有明显的IR降,表明该电极材料具有良好的电化学反应可逆性。随着时间的延长,该GCD曲线存在线性和非线性变化。其中线性快速充电和放电过程代表双电层电容行为,结合图5(b)可知这主要源于Ti3C2Tx的贡献,而非线性部分主要表现为赝电容行为,主要源于MoS2的贡献。根据GCD曲线,可计算出该电极在1、2、4、5、10 A/g下的比电容分别为262.54、219.95、191.61、182.1、172.32 F/g。MoS2/Ti3C2Tx材料电极在大电流下仍能保持较高的比电容,应归因于复合材料的协同效应有利于电极倍率性能的改善。图7所示为不同测试电极的循环性能以及电化学阻抗谱。由图7(a)可见,在电流密度为1 A/g的条件下,初始比电容为262.54 F/g的MoS2/Ti3C2Tx(S2)电极经10000次循环充放电后仍具有215.54 F/g的比电容,电容保持率达到82.1%,其在前1000次循环中的比电容衰减较明显,这可能与电极材料未能和电解液充分接触有关。相比之下,纯MoS2电极经5000次循环后的比电容已由初始的68.20 F/g衰减至33.71 F/g,容量保持率仅为49.4%,而Ti3C2Tx电极虽然比电容保持率较高,但其在10000次循环期间的最高比电容也不过97.10 F/g,复合材料电极的循环性能明显优于单一材料电极。由图7(b)可见,所有样品电极的EIS曲线均由高、中、低频3部分组成。EIS曲线高频区出现圆弧状,表明存在部分MoS2的电荷转移阻抗。EIS曲线圆弧与实轴的交点对应电极材料的内阻(Rs),局部放大图显示,MoS2/Ti3C2Tx复合材料的内阻Rs明显低于纯Ti3C2Tx(1.42 Ω)和MoS2(1.58 Ω)的相应值。其中Ti3C2Tx含量为30 mg的MoS2/Ti3C2Tx复合材料Rs最小,仅为1.19 Ω,这可能与复合过程产生的缺陷或空位有关,较小的内阻有利于电子的快速传输。中频区MoS2/Ti3C2Tx(S2)电极EIS曲线经Zview软件拟合后可得到其电荷转移阻抗Rct为0.38 Ω,明显小于纯MoS2相应值,表明MoS2与Ti3C2Tx复合形成异质复合材料后,电荷迁移速度得到明显提升。低频区电极 EIS曲线经Zview软件拟合后的直线斜率越大,相应电极在电解液中发生反应时离子的扩散阻抗Zw就越小。图中MoS2/Ti3C2Tx(S2)电极低频区EIS曲线经拟合后的直线斜率较纯MoS2电极相应值更大,表明引入30 mg Ti3C2Tx所制MoS2/Ti3C2Tx电极具有较小的扩散阻抗Zw。在5组测试电极中,Ti3C2Tx含量为30 mg的MoS2/Ti3C2Tx复合材料电极的 Rs、Rct及 Zw 均低于其它4组电极相应值,表明该电极材料电化学性能最佳。
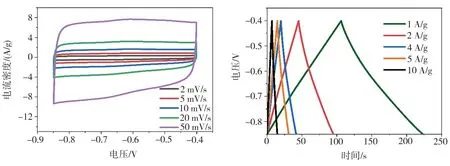
(a)CV曲线 (b)GCD曲线
(a)循环性能 (b)EIS
为了考察所制MoS2/Ti3C2Tx复合材料在电化学过程中的动力学机制,以S2样品为研究对象,对其在不同扫描速率下的CV曲线进行拟合。结果表明,CV测试的总电流由扩散电流和电容电流两部分组成。基于图6(a)所示的样品CV曲线,利用相关公式进行计算,根据计算结果可以明确电化学过程中扩散电流和电容电流对总电流的贡献,从而能进一步分析其中的动力学机制[14-15]。主要计算公式有
i=i扩散+i电容=avb
(1)
logi=loga+blogv
(2)
i=i扩散+i电容=k1v+k2v1/2
(3)
i/v1/2=k1v1/2+k2
(4)
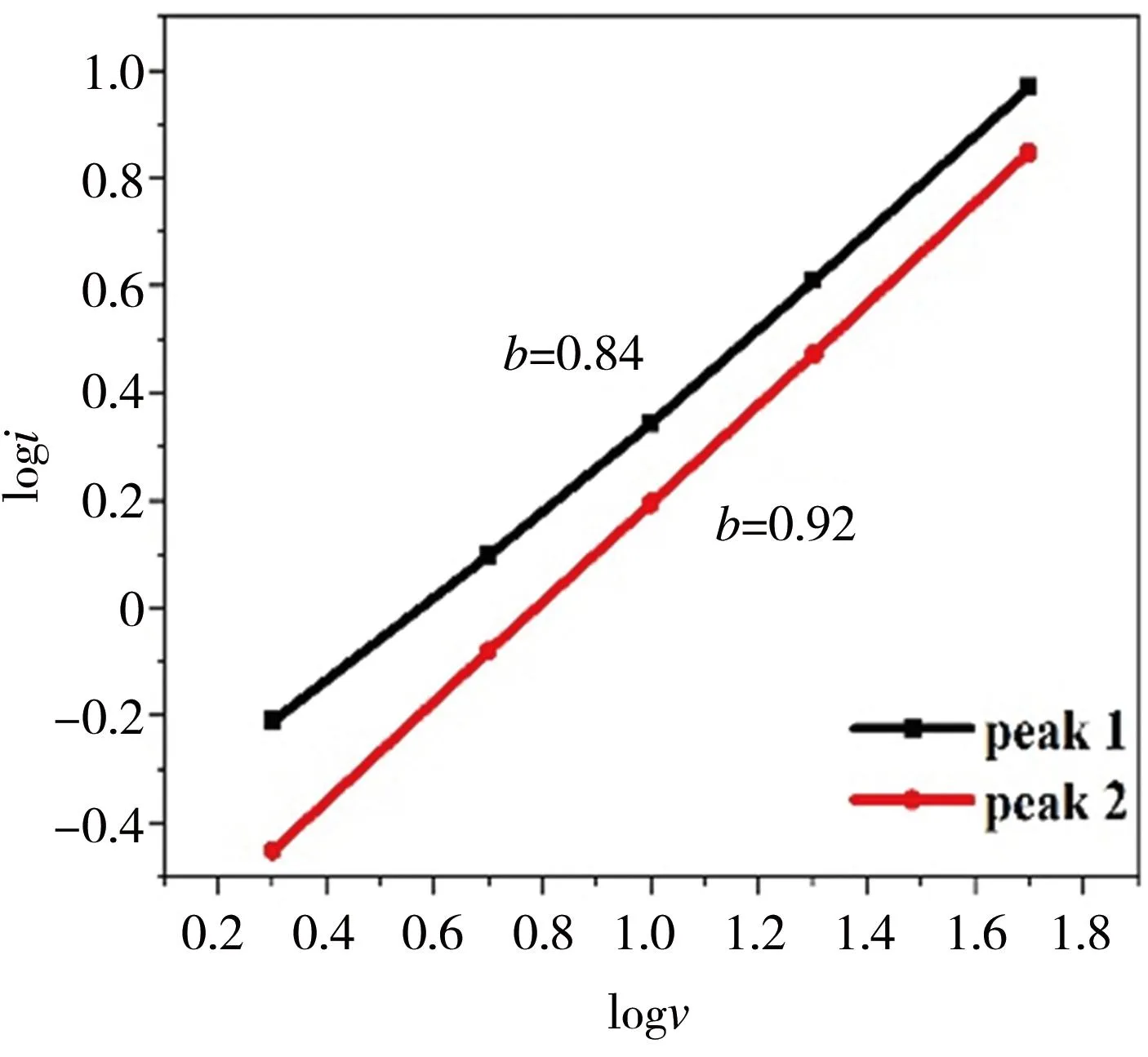
式(1)~式(4)中,i代表峰电流,i扩散和i电容分别表示扩散电流和电容电流;v代表扫描速度;a、b为可调的参数,b可根据logi与logv关系曲线的斜率确定,当b为0.5时,代表反应过程由扩散控制,当b为1时,代表反应为理想的电容行为,b值在0.5~1之间且接近1,代表反应过程以电容效应为主;k1、k2为拟合参数。基于上述公式,得到不同扫描速率下的电容电流对电极总电流的贡献分析结果如图8所示。由图8(a)可知,b分别为0.84和0.92,表明其总电流以电容电流为主、扩散电流为辅。由图8(b)可见,当扫描速率为50 mV/s时,总电流主要为电容电流。由图8(c)可知,随着扫描速率从2 mV/s增至50 mV/s,MoS2/Ti3C2Tx复合材料电极的电容贡献率由60%提升至93%。当扫描速率达到50 mV/s时,反应过程基本由电容效应控制,这有利于获得良好的循环稳定性和倍率性能。
(a)电极的b值
3 结论
1)采用水热法成功制备了异质MoS2/Ti3C2Tx复合材料。相较于单一的二维Ti3C2Tx和MoS2材料,两者复合后形成的异质结构MoS2/Ti3C2Tx复合材料的电化学性能显著提升。
2)当Ti3C2Tx的引入量为30 mg时,所制备的MoS2/Ti3C2Tx异质复合材料电极在浓度为1 mol/L的KOH电解液中具有最优的电化学性能。其中,当电流密度为1 A/g时,该电极的比电容为262.54 F/g,且径循环10000次后仍保持82.1%的初始比容量。
3)电极材料电化学性能的改善得益于所制异质复合材料的协同效应,其电极反应过程主要由电容效应控制。在MoS2中的适量引入Ti3C2Tx不仅减少了MoS2的团聚,而且降低了复合材料电极的电荷转移阻抗和离子扩散阻抗,加快了电子、离子的快速传输。
