铜基电极的改性及其在电解水制氢催化中的研究进展
2024-01-15石卢一白玮纯邓越孙金峰张少飞
石卢一,白玮纯,邓越,孙金峰,张少飞
(河北科技大学材料科学与工程学院,河北省柔性功能材料重点实验室,河北 石家庄 050018)
氢能因具有能量高、无污染、用途广泛等优点是未来可持续能源系统最具潜力的载体之一[1-2]。利用可再生电力电解水制氢可避免温室气体的参与,契合中国“碳达峰、碳中和”的发展目标。电解水反应过程包括阴极析氢反应(HER)和阳极析氧反应(OER)两个过程。其中HER是气、液、固三相界面反应,其高的反应能垒严重影响电解水制氢效率。商业化电解水制氢通常以高活性贵金属作为催化剂,如铂(Pt)、钯(Pd)等。然而,这些贵金属催化剂成本高昂,资源储备低,稳定性弱,导致其在电解水的规模化应用领域受到限制[3-4]。因此,开发具有价格低廉的高性能HER 电催化剂至关重要。
在不断寻找贵金属替代电催化剂的过程中,铜(Cu)因具有高导电性,在质子耦合电子的HER方面显示出一定潜力[5]。然而,Cu 在实际电解水反应过程中,析氢效率和催化稳定性仍不理想[6]。首先,Cu作为催化剂时,与中间态*H结合能弱(偏离火山峰曲线),导致本征催化活性差;其次,商业化电解水体系多以酸性和碱性电解液为主,在连续的电解水析氢过程中易导致Cu 在酸性介质中被腐蚀和在碱性溶液中被氧化,影响Cu 催化剂的界面稳定性。尤其在碱性电解液中,Cu与OH-发生氧化并在表面生成Cu 氧化物或氢氧化物,阻碍活性位点与电解液的接触,导致催化稳定性降低。为了提高Cu 在HER 中的催化活性和稳定性,研究人员对其进行了改性研究[7]。通过对Cu 进行改性可优化催化剂与中间态*H 结合能,而界面结构设计有利于提供更丰富的活性位点和保持界面稳定性。
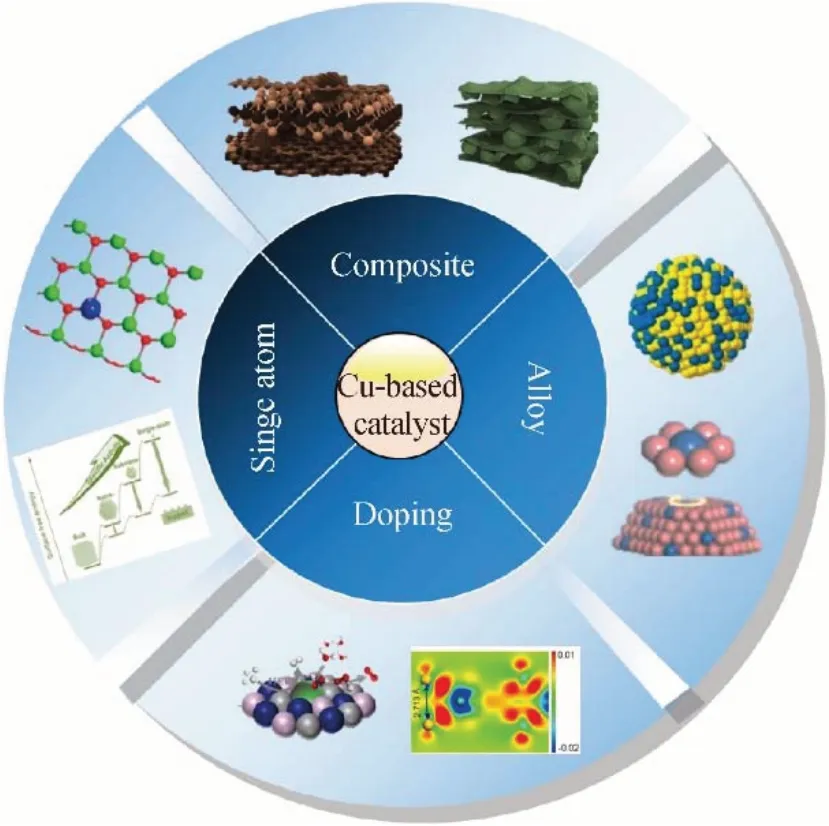
图1 Cu改性研究方案示意图Fig.1 Schematic diagram of modification strategies for Cu catalyst
1 Cu基电极析氢催化机理
电解水是利用特定电极材料作为阴极和阳极,通过电解反应将水分子分解成H2和O2。以碱性电解体系为例(图2),阳极发生OH-的氧化反应并生成O2[见式(1)],阴极发生H2O 的还原反应并生成H2[见式(2)]。
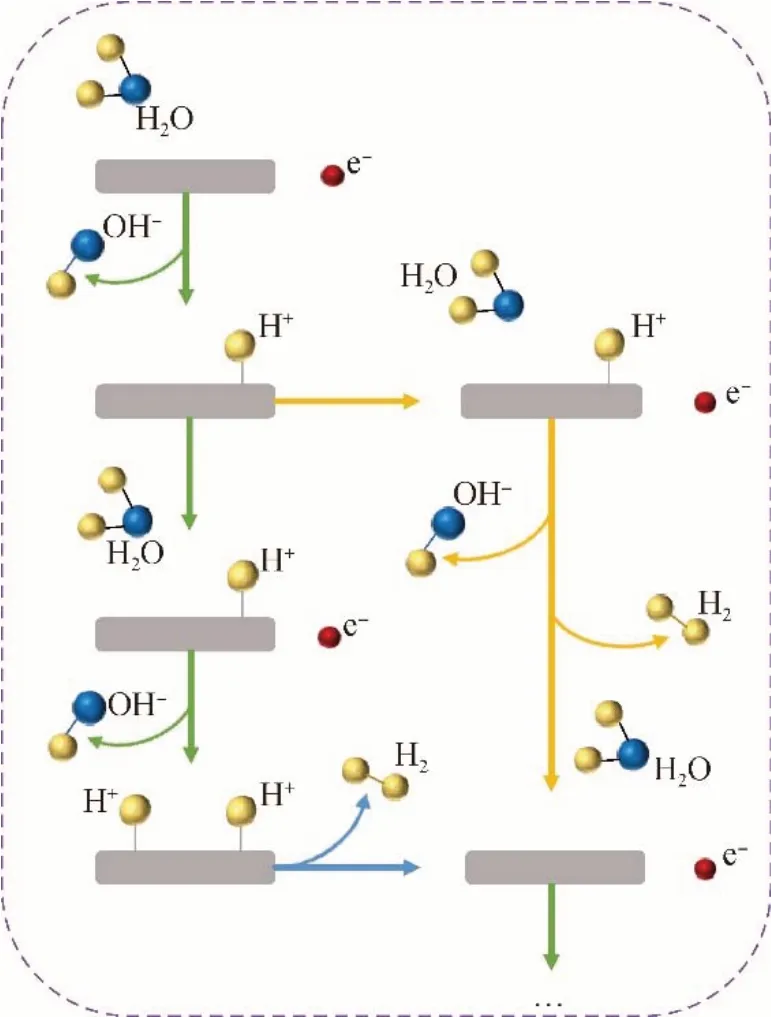
图2 电解水析氢机理图Fig.2 Mechanism diagram of hydrogen evolution reaction in electrolytic water
无论是OER 还是HER,每个半反应遵循不同的反应路径,这取决于电极表面的电化学和电子性质[8]。碱性电解液中,在Volmer 步骤中,H2O 要在电极表面解离生成*H 和OH-[式(3)],随后在生成H2过程中,*H 会和H2O 反应产生H2和OH-Heyrovsky反应骤[式(4)][9];而在Tafel反应中,吸附在电极表面的2个*H 直接结合并产生H2[式(5)][10]。具体电子转移过程如下所示:
可见,*H 的吸附和脱附都是影响电极反应速率的关键步骤。无论Volmer-Heyrovsky 过程或Volmer-Tafel 过程,主导这一过程的是催化剂的氢结合能(ΔG*H)。ΔG*H直接反映催化剂的本征活性。理论研究发现,在析氢反应中,催化剂活性位点的ΔG*H越接近零,催化剂的本征活性越好。根据火山峰曲线,纯Cu 具有低的交换电流密度和弱的ΔG*H,从而表现出较差的析氢反应活性。因此,通过调控Cu 表面*H 结合能,可提高其本征催化活性。
2 Cu基电极改性
鉴于Cu 催化活性低和界面稳定性差的缺点,通过结构和成分设计,可以将中间体*H 优先吸附在强吸附位点上,随后在电子进一步转移过程中,*H 可能会转移到弱吸附作用的Cu 活性位点,从而促进下一步氢分子的解吸[11]。本章节将从Cu 基单原子催化剂、复合材料、合金化和杂原子掺杂四方面介绍Cu 基催化剂在结构-反应路径、性能和催化等方面的主要研究进展。
2.1 Cu单原子催化剂
单原子作为催化剂虽然可以提高活性面积,但其催化活性受多方面因素影响[12]。研究表明单原子Cu 孤立位点的反应性和稳定性极大地依赖于载体的本征物化特性,单原子与载体局部环境之间的高效电荷转移可能会影响d 带中心[13]。同时,因载体的存在,Cu 单原子位点微环境以及电子几何结构会发生变化,使Cu 单原子材料表现出区别于纳米颗粒/团簇的催化特性。针对上述关键问题,诸多研究学者提出载体促进Cu 单原子协同催化概念。Liu 等[14]系统研究和阐述了Cu 在不同载体上的作用,分析发现二维载体可以有效改善电子结构以及与周围的配位环境,从而提高催化活性。
尽管Cu 单原子催化剂具有选择性高的优点[15],但是较高的表面自由能易引起催化剂在载体上的团聚,导致催化活性下降。在制备过程中,通过引入高电负性杂原子与Cu 配位,利用二者之间的键合作用防止团聚是一种有效方式。然而,配位键过强会降低配位金属原子的电子密度,从而影响它们的催化活性。基于此,Fu 等[16]通过辅助氢的光化学策略,在二维黑磷(BP)载体上制备了具有适度配位作用的Cu-P3稳定结构电极,其制备过程如图3(a)所示。其中,BP 载体可产生稳定且高负载的M-P3结构的配位单原子(M=Cu,Co)。由低电负性的P 原子与特殊富电子特征的Cu 原子构建的Cu-P3单原子催化剂ΔG*H接近于零。所制备的催化剂在10 mA/cm2电流密度下过电位仅41 mV,且Tafel 斜率低至53.4 mV/dec,催化活性超过孤立Cu 单原子和Cu 纳米团簇[图3(b)]。为进一步提高Cu 的催化活性,引入贵金属铂(Pt)制备双金属单原子催化剂成为重要研究方向。Wang 等[17]采用合成的ZIF-8-Cu 前驱体进行热解和真空蒸发,将高度分散的Cu 原子负载在氮掺杂的多孔碳上,随后负载Pt 后制备出C-ZIF-CuPt 催化剂,具体流程如图3(c)所示。Cu-Pt单原子高度分散并牢固地锚定在载体上,提高了催化剂的HER 活性和稳定性,优于商业Pt/C催化剂[图3(d)]。
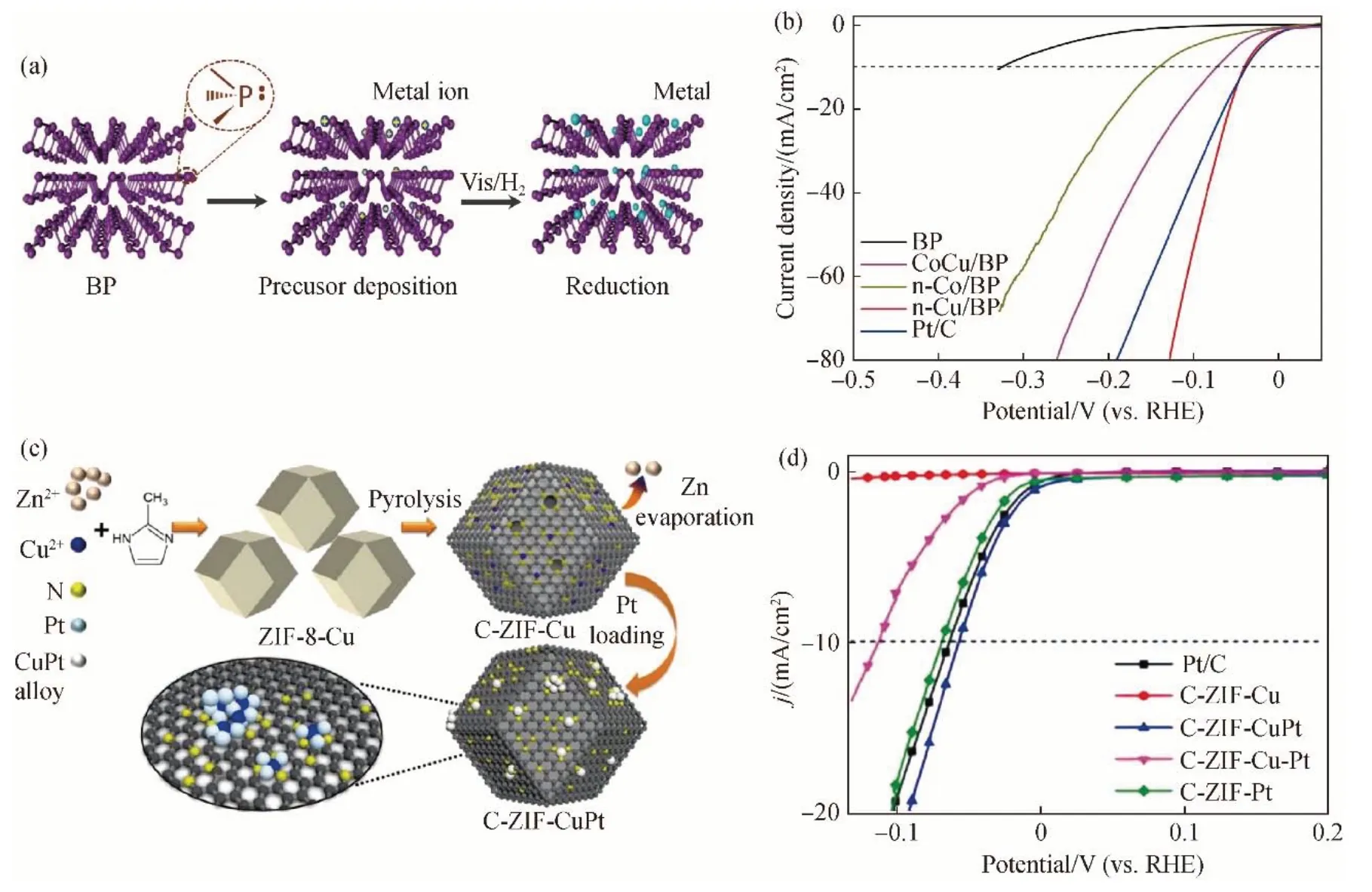
图3 (a)BP基底合成M-P3单原子催化剂示意图;(b)n-Cu/BP催化剂与对比样品的HER性能曲线;(c)C-ZIF-CuPt催化剂制备工艺图;(d)C-ZIF-CuPt催化剂与对比样品的HER性能曲线Fig.3 (a)Schematic illustration of M-P3 SAC on BP substrate[14];(b)HER polarization curves of n-Cu/BP catalysts and other samples[14];(c)Preparation process of C-ZIF-CuPt catalyst and(d)HER performance curves of C-ZIF-CuPt catalyst and comparison sample[15]
尽管在单原子Cu 催化剂的设计方面取得一定进展,然而单原子均匀分散的合成工艺仍是难点[18]。未来应充分考虑单原子与其他原子或基底间的相互作用,促进单原子催化剂在工业化大电流析氢领域中的应用。
2.2 Cu基复合催化剂
通过将高导电性的Cu 和高催化活性或高比表面积的材料复合,可产生协同作用,显著提高电极的催化活性和稳定性。目前与Cu 复合的材料主要以碳基材料、黏土材料(MXene)和过渡金属化合物为主[19]。
在中欧水资源管理对话会上,水利部黄河水利委员会副主任徐乘代表参与中欧流域管理项目实施的中方各有关单位和利益相关者,向大会报告了中欧流域管理项目在过去五年中所做的工作和取得的成就。他指出,中欧流域管理项目的主要成果包括五个部分:一是中欧水资源管理对话,二是流域综合管理,三是水资源管理工具,四是与世界银行合作开展的“长江—珠江流域恢复治理项目”,五是能力建设。
碳基材料如石墨烯、碳纳米管和多孔碳等具有微/纳米结构,有利于活性位点数量的增多[20-22]。Wei等[23]以含Cu的MOF199为原材料,通过碳化工艺成功合成了Cu 基纳米多孔碳复合材料(C-Cu-Di)。通过扫描电镜(SEM)和透射电镜(TEM)可以观察到C-Cu-Di催化剂在不规则形状的碎屑中分布着大量的纳米孔洞[图4(a,b)],可提供更多有效催化活性中心。相比于纯Cu颗粒,C-Cu-Di电极显示出更低的HER 过电位和Tafel 斜率[图4(c)],证明C-Cu-DI 催化剂中的纳米Cu 和少量Cu 氧化颗粒可协同纳米孔洞提供更有效的催化活性和催化稳定性[图4(d)]。为进一步提高复合材料的催化活性,催化剂活性位点结构的工程设计是一种行之有效的方案。已有研究表明,高度分散的催化剂具有合适的配位环境、最大的金属利用率和与载体密切的相互作用[24]。这些优势可以进一步优化HER 过程中*H 的结合能。同时,近距离的多原子Cu 中心可以实现多位点相互作用。因此,通过将单原子和多原子Cu 位点整合在一个催化剂上不仅可以调节Cu 位点的尺寸和金属负载率,还可以调节Cu 3d 轨道的局部电子密度,从而实现快速的中间体吸附/解吸。Zhang 等[25]以不同含Cu 前驱体为原材料,通过固态热解法成功地在氮掺杂生物质衍生碳(BDNC)上负载了Cu 纳米颗粒和BDNC 共存的协同催化剂(Cu1+n/BDNC)。其中,单原子Cu的引入,有效增加了Cu1+n/BDNC 的电化学表面积,而Cu 纳米颗粒显著提升了Cu1+n/BDNC 的导电性。另外,X射线光电子能谱(XPS)结果显示了Cu-N配位键的存在,表明了Cu 原子的化学配位环境。最终,该二维超薄形貌催化剂利用高密度的活性位点和精确调节的局部配位环境,实现了碱性介质中的高效HER 和全解水性能。可见,有效调控碳材料结构并创造足够数量的Cu 活性位点,将极大促进Cu/碳复合电催化剂的催化活性和催化稳定性。

图4 C-Cu-Di催化剂(a)SEM图像和(b)高分辨透射电镜(HRTEM)图像;(c)C-Cu,C-Cu-Di杂化物和Pt/C催化剂在0.5 mol/L H2SO4中的LSV曲线;(d)C-Cu和C-Cu-Di杂化材料在过电位600 mV下随时间变化的电流密度曲线Fig.4 (a)SEM image and(b)HRTEM image of C-Cu-DI catalyst;(c)HER polarization curves of C-Cu,C-Cu-DI hybrids and Pt/C catalyst in 0.5 mol/L H2SO4;(d)Time-dependent current density curves of C-Cu and C-Cu-DI hybrids under static overpotential of 600 mV[21]
除具有高比表面积的纳米碳材料外,MXene因具有层状二维结构,在与Cu 进行复合时,也可为Cu 提供丰富的可用位点。此外,当Cu 以纳米颗粒形式插入到MXene 层间,可以有效抑制MXene的堆积并扩大层间距,暴露出更多的活性位点和传质通道,从而提高电催化性能。Wang 等[26]通过刻蚀法制备了层状Ti3C2Tx,并采用NaBH4还原沉积制备出具有大比表面积的Cu/Ti3C2Tx复合催化剂。该催化剂中,Cu 在Cu/Ti3C2Tx中主要以Cu0,Cu+和Cu2+形式存在。Cu-O 和Cu-OH 可以有效提高H2O在电极表面的吸附,加速水的解离。另外,表面亲水性协同二维开放通道为气泡的脱离和输运提供了便利。电化学表征表明,在1 mol/L 的KOH 电解液中,Cu/Ti3C2Tx呈现出最好的析氢反应性能,即在10 mA/cm2电流密度下,析氢过电位为128 mV,且Tafel 斜率为 126 mV/dec,高于MXene 和Cu 纳米颗粒催化性能。
与碳化物或MXene 材料相似,过渡金属氧化物或氢氧化物也具有高效析氢催化活性。然而过渡金属氧化物或氢氧化物本征导电性差限制了其实际应用。采用Cu 作为导电增强体有望提高过渡金属氧化物或氢氧化物的催化性能。Shang等[27]构筑了一种Cu 枝晶修饰的NiFe(OH)x催化剂,其中,Cu 枝晶主要源于Cu2(OH)2CO3在析氢反应前期的原位还原。金属Cu 优异的导电性和相对较弱的氢吸附能促进了界面电荷的转移,并与周围NiFe(OH)x活性物种裂解水产生的质子结合为H2,从而避免了NiFe(OH)x失活,实现了长期高效稳定的析氢性能。尽管具有高导电性的Cu有利于HER过程中电子转移,但在近期的研究发现,Cu 全满的d轨道填充不利于水分子的吸附/解离,因此碱性析氢的本征催化活性往往较低。尽管具有离子价态的Cu 具有更好的水吸附/解离能力,但是在低的析氢过电位下,Cu 离子很容易被还原为单质Cu,导致催化失活。因此,在阴极HER 过程中,稳定Cu 离子位点有望进一步提升Cu 基催化剂的碱性析氢性能。Fang 等[28]通过电化学掺杂工艺在Cu 纳米线表面包覆了一层Cr 掺杂的非晶Cu 氧化物(CrCuO)。通过对比Cu 或Cr 与O 间的能级关系,Cr 和O 的能级更高表明Cr-O 相互作用更强,因此晶格O 因Cr 的作用会稳定在晶格内,从而使Cu 维持在较高的价态,抑制Cu 的快速失活[图5(a~c)]。图5(d)显示了Cu@A-CrCuOx与其他对比电极的极化曲线图,在100 mA/cm2的高电流密度下,Cu@A-CrCuOx仅具有247 mV的过电位,接近于商业Pt/C催化剂性能。

图5 (a)H2O 与Cu 的弱相互作用示意图(橙色、红色和白色小球分别代表Cu,O 和H 原子);(b)H2O 与CuO 的强相互作用;(c)CuO纳米线在1.0 mol/L KOH溶液中的循环伏安(CV)曲线(R代表还原,扫描速率为10 mV/s,内嵌图为CuO的还原机理);(d)Cu@A-CrCuOx在碱性介质中的LSV曲线Fig.5 (a)Weak interaction between H2O and Cu(orange,red and white balls represent Cu,O and H atoms);(b)Strong interaction between H2O and CuO;(c)CV curve of CuO nanowires in 1.0 mol/L KOH solution at scan rate of 10 mV/s(R stands for reduction,reduction mechanism of CuO is shown inset);(d)HER polarization curves of Cu@A-CrCuOx catalyst and others[26]
Cu 基复合电极中,Cu 可以改善复合基底的导电性,优化电子结构。但是复合催化剂的设计应考虑二者间的相互作用力以及Cu 的存在状态。强的Cu/载体作用可以提高稳定性,深刻理解Cu在催化过程中的真实状态,有利于对更高效催化剂的合成和机理进行探讨。
2.3 Cu基合金催化剂
由于单金属(Ni,Co,Cu 等)催化剂的电子结构单一,导致其在实际催化应用领域受限。通过金属间的合金化策略制备的合金催化剂可利用金属间的协同作用和更广泛的电子可调性,显著提高催化性能。鉴于Cu 本征催化活性弱,将其与和*H 有更高结合作用的金属进行合金化是目前析氢催化剂设计的常用策略。
贵金属钌(Ru)在碱性介质中具有强的水解离能力,被认为是高效的析氢催化剂[29]。然而,根据火山峰曲线,Ru 与*H 相互作用力强,导致氢脱附困难。另外,Ru的高昂价格限制了其大规模应用。为了调节Ru与*H 相互作用以及降低生产成本,将Cu 与Ru 合金化是一种有效方法。Wu 等[30]通过熔炼-甩带结合脱合金化策略成功制备出具有三维双连通结构的CuRu 合金催化剂,其制备流程如图6(a)所示。得益于纳米多孔结构优势以及合金原子的协同作用,纳米多孔Cu53Ru47合金催化剂(np-Cu53Ru47)在电流密度为10 mA/cm2时,碱性HER 过电位仅为15 mV[图6(b)]。为了探究CuRu 合金的催化机理,作者采用原位表征和理论模拟计算等手段对CuRu 在真实催化条件下进行了深入探究。研究发现,Ru 的引入会调节基底Cu 的电子结构,不仅加快了水分子吸附和活化的反应步骤,同时还优化了Cu 位点及Ru 位点对氢中间体的吸附-解吸能垒(增强Cu-H 相互作用,削弱Ru-H 相互作用)。另外,钯(Pd)、铱(Ir)等贵金属与Ru 相似,都会与*H 产生强相互作用而限制其HER 催化活性[31]。将Pd,Ir 等与过渡金属Cu 合金化,然后通过协同效应和配体效应来调节电子结构和吸附自由能亦可以提高催化活性。
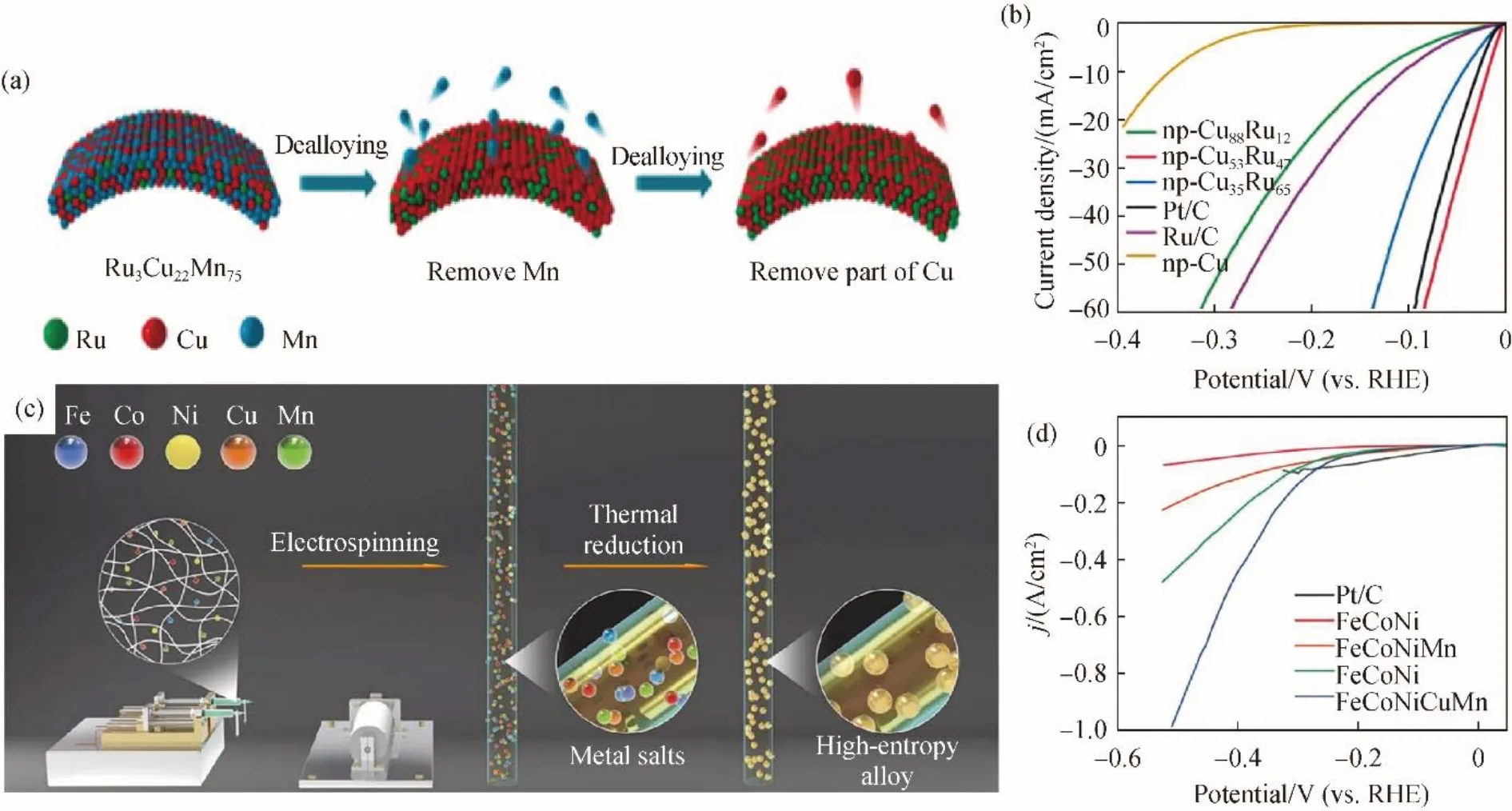
图6 纳米多孔铜钌合金催化剂(a)制备流程图以及(b)HER极化曲线;(c)聚合物纤维纳米反应器合成HEA/CNF杂化纳米材料以及(d)不同HEA/CNF杂化纳米催化剂在1 mol/L KOH水性电解质中的HER极化曲线Fig.6 (a)Schematic illustration of preparation and(b)polarization curves for HER process of nanoporous CuRu alloy[28];(c)Synthesis procedure of HEA/CNF hybrid nanomaterials through a polymer fiber nanoreactor;(d)HER polarization curves of different HEA/CNF hybrid catalysts in 1 mol/L KOH aqueous electrolyte[33]
过渡金属(TM)因为价格低廉,可完全取代贵金属,形成TM-Cu 合金催化剂[32]。然而不同金属合金化的催化效果往往因金属属性不同而具有差异。Wang 等[33]通过对一系列Ni-M 双金属合金(M=Ti,V,Cr,Mn,Fe,Co,Cu,Zn,Mo,W)的ΔG*H进行理论计算,发现双金属M-H 化学键的协同作用能够改善d带中心,并依据此结果筛选出ΔG*H最优的NiCu 双金属合金催化剂。随后采用实验设计进行验证分析,发现微量O 的注入所获得的NiCu 合金在100 mA/cm2的大电流密度下,过电位仅为69 mV,优于其他Ni-M 合金体系催化剂。另外,Gan 等[34]采用水热合成法和原位低温还原法在泡沫镍外延制备出铜镍双金属多级结构析氢催化剂(CuxNi4-xN/NF),并经过物理化学表征和电化学测试验证了Cu与Ni协同作用对提高催化活性和催化稳定性的作用。CuxNi4-xN/NF 电极在电流密度为10 mA/cm2时,过电位为58 mV,表现出良好的HER活性。
为了便于科研学者在Cu 基合金基催化剂方面优化设计,通过筛选策略不仅可以提高计算效率,而且有助于发现更有前景的合金电催化材料。基于此,Mao等[35]开发并设计了一种基于密度泛函理论的高通量计算和筛选的新方法,即从7924 个Cu基合金团簇中解析热力学平衡相的结构特征,并进一步对稳定的Cu 基合金团簇的表面析氢活性进行高通量模拟,成功预测了复杂合金团簇的析氢反应活性规律,并提出兼具高催化活性和高稳定性的CuNi合金在电催化反应中的潜在应用。
除双金属合金体系外,目前含Cu 高熵合金由于其巨大的多元素组成空间和独特的高熵混合结构而备受关注。与双金属Cu 合金相比,高熵合金可通过多元成分设计和元素调控,实现高活性、高选择性、高稳定性和低成本催化剂的构建。通过分析各金属元素与*H 结合能的关系,组合调制高熵合金是目前遵循的设计原则之一。Zhu等[36]提出了一种高熵原子环境调节策略,将低电负性Mn 和高电负性Cu 与Fe,Co,Ni 结合,形成FeCoNiCuMn高熵合金纳米粒子(NPs),具体制备流程如图6(c)所示。结果表明,通过电负性差异引起的强局域电子相互作用,将无活性Cu 激活成富集电子的活性位点,从而有效降低反应物、中间体和产物的吸附能,进而增强该高熵合金的HER 活性。该高熵合金纳米粒子涂覆的电极在100 mA/cm2条件下过电位为281 mV[图6(d)],且在该电流密度下表现出优异的循环稳定性。
Yao等[37]结合高熵效应和纳米多孔的高比表面积优势,通过熔炼-甩带和后续脱合金化工艺,制备出由不同的Cu,Ni,Mo 和Fe 原子组成的体心立方表面高熵合金双功能催化剂。其中,多金属元素协同促进水离解并促进*H 吸附/解吸,而分层的纳米多孔Cu 骨架充当快速电子的支架促进离子气体分子迁移。另外,Cu 在高熵效应下,催化活性被显著提高,且高熵合金层中Cu 也起到作为电子供体的作用。电化学结果表明,纳米多孔CuNi-MoFe电极具有优良的非酸性HER电催化性能。
综上所述,Cu 基合金催化剂因合金化后Cu 金属原子的几何环境被改变而使得表面吸附能连续分布,为微调结合能调节反应性质提供了基础。合金中元素的选择和比例会影响活性位点的数量和活性位点的局部组成,进而影响催化剂的本征活性。而高熵合金中多组分的选择性可以最大化多位点间的协同作用,更有效地优化合金材料的电子结构,进而优化电催化过程中的能量势垒,提高催化反应性能。
2.4 杂原子掺杂催化剂
电子调控策略可实现催化剂电子态、能带结构及氢吸附能的精准调控,从而提升金属基催化剂的析氢性能。特别是,异质原子掺杂对于催化剂电子结构的调控及本征活性的优化具有显著作用。近年来,异质原子(包括金属原子、非金属原子)掺杂金属基催化剂在电催化析氢领域的应用成为催化领域的研究重点。本节主要介绍以Cu 为杂原子掺杂到金属基催化剂和以其他原子为杂原子掺杂到Cu 或Cu 氧化物基催化剂中的相关工作及掺杂机理。
Cu 作为高导电性元素,在掺杂过程中会明显改善被掺杂材料(尤其是半导体材料)的电子结构。另外,掺杂可能会创造更多的氧空位或缺陷位,从而使反应物容易吸附和解离。如以二维金属碳化物Ti2CO2为基体,Wang 等[38]通过Cu,W 等系列原子的掺杂调控发现,掺杂不仅优化了氢吸附的吉布斯自由能,而且有效提高了Ti2CO2的电子导电性。理论计算结果表明,杂原子与C和O原子之间的p-d 轨道杂化导致费米能级附近的电子重排,促进了HER活性的提升。为了进一步研究Cu原子含量对HER 的催化机理,Kwon 等[39]采用溶剂热反应合成了不同过渡金属(Mn,Fe,Co,Ni 和Cu)原子掺杂的ReSe 纳米片电极。研究发现,随着Cu 原子掺杂的摩尔分数由25%提高到100%时,Cu更倾向于聚集形成具有氧化表面的团簇,且电子密度显著增加。合适的Cu 原子含量有利于中间能隙杂化态的产生,从而提高Cu-ReSe 的HER 催化活性。尽管诸多研究已经证实了Cu 掺杂可以改变电子结构,但是对掺杂元素的分布状态研究较少。另外,掺杂元素的富集仍是急需解决的一大关键问题。为此,Shen 等[40]通过油浴条件下加入Cu(acac)2并经处理后,成功制备出Cu 原子均匀掺杂的复合催化剂(Cu-RuS2NSs/C),其制备流程如图7(a)所示。TEM 分析发现Cu 原子在基体内呈现均匀分布,有利于电子结构的连续调节。相比于未掺杂电极,Cu 掺杂的Cu-RuS2NSs/C 催化剂在10 mA/cm2下的过电位仅为67 mV,远低于RuS2/Ru[图7(b)]和Cu-RuS2[图7(c)],且Tafel斜率为120 mV/dec,表现出良好的析氢催化活性和快速动力学过程。理论计算表明,在RuS2中引入Cu 原子可以有效加速水的解离,优化碱性析氢过程中的氢键结合能力。同时,Cu 与Ru 的异质结构进一步改善了电极导电性,增加了活性位点数。
Cu 基氧化物导电性差,且催化活性低。通过引入杂原子掺杂对Cu 基氧化物进行改性是最直接有效的方法之一。Xu 等[41]以泡沫Cu 为基底利用阳离子交换策略,在CuO 纳米线阵列上分别制备了贵金属铑(Rh)掺杂的CuO 纳米复合催化剂(Rh SAC-CuO NAs/CF)[图7(d)]。由高倍SEM[图7(e)]和球差高角环形暗场扫描透射(AC-HAADF-STEM)[图7(f)]可以看出,制备出的Rh SAC-CuO NAs/CF 具有纳米线结构,且掺杂的贵金属均以单原子的形式存在于CuO 晶格中(红色圆圈标记为单个Rh原子),最大限度发挥了贵金属的掺杂效果。另外,用Rh 单原子部分取代Cu 原子,可以有效降低反应中间体的吸附能,提高CuONAs 迟滞的HER 动力学。电化学性能测试表明,Rh SAC-CuO NAs/CF 电极在10 mA/cm2电流密度下过电位仅为44 mV,与CuO NAs/CF(323 mV)相比明显降低[图7(g)]。
尽管已有大量文献报道了掺杂调控过渡金属化合物的工作,但是掺杂产生的催化机理并不明确。无论是Cu 掺杂还是杂原子在Cu 基材料中的掺杂,应充分考虑催化剂的物理特性、电子特征以及反应路径。
3 总结与展望
电解水制氢过程中,催化剂起到能量转换的作用,是决定制氢效率的关键因素之一。从经济角度考虑,廉价过渡金属Cu 可取代商业化贵金属,是最有前景的HER 催化剂之一。然而,Cu 本征催化活性低和稳定性差限制了电解水制氢的产业化应用。本综述首先以碱性电解水为例,介绍了析氢反应机理以及导致Cu 催化剂活性低的关键因素(ΔG*H不理想),然后通过Cu 单原子结构设计、Cu 基复合材料、Cu 基合金以及杂原子掺杂四个方面详细介绍了Cu 基催化电极的改性策略及研究进展,并着重讨论了不同改性方法对析氢催化的增强机制。尽管Cu 的改性研究已经取得丰硕成果,然而在工业化电解水领域仍存在诸多问题未解决,包括:1)Cu基催化剂制备工艺复杂和成本高昂;2)大电流密度下的析氢催化活性低,影响实际应用;3)结构-析氢催化构效关系仍不明确。总之,探索和开发同时具备高催化活性、高稳定性和低成本的Cu基HER催化剂对进一步发展新能源相关技术具有重要意义。我们也相信,随着研究的深入,Cu 基材料在催化反应中的应用前景将变得更加广阔。
