超微粉碎联合超声波辅助提取鸭屎香单枞茶多糖工艺及活性研究
2024-01-15丁莫胡蕾刘谋泉王忠合林婉玲王锦旭
丁莫 胡蕾 刘谋泉 王忠合 林婉玲 王锦旭







摘要 [目的]提高茶多糖的提取得率。[方法]采用超微粉碎技術对鸭屎香单枞茶进行前处理,利用超声波辅助结合正交试验对其多糖提取工艺进行优化,并考察鸭屎香单枞茶多糖的抗氧化和抑菌活性。[结果]最优提取条件为提取时间150 min、提取温度70 ℃、提取2次和料液比(g/mL)1∶30,在该提取条件下,鸭屎香单枞茶多糖的平均提取得率达到6.72%。体外抗氧化结果得出,鸭屎香单枞茶多糖对ABTS+和DPPH自由基均具有较强的清除作用,其清除率变化趋势与茶多糖浓度呈正相关;体外抑菌活性研究表明,茶多糖对4种菌株均具有抑制作用,且对大肠杆菌表现出较好的抑制效果,其最低抑菌浓度为3.125 mg/mL。[结论]茶多糖的提取工艺简单,得率高,抗氧化活性好,为鸭屎香单枞茶多糖的进一步研究及新产品开发提供理论依据和重要参考。
关键词 鸭屎香单枞茶;超微粉碎;多糖;抗氧化活性;抑菌活性
中图分类号 TS272.7 文献标识码 A 文章编号 0517-6611(2024)01-0159-05
doi:10.3969/j.issn.0517-6611.2024.01.035
开放科学(资源服务)标识码(OSID):
Study on Superfine Pulverization and Ultrasonic-assisted Extraction Process and Activity of Yashixiang Dancong Tea Polysaccharide
DING Mo1,2, HU Lei1, LIU Mou-quan1,2 et al
(1.College of Life Science and Food Engineering, Hanshan Normal University, Chaozhou, Guangdong 521041; 2.Guangdong Key Laboratory for Functional Substances in Medicinal Edible Resources and Healthcare Products, Chaozhou, Guangdong 521041)
Abstract [Objective]In order to improve the extraction yield of tea polysaccharide. [Method]The superfine pulverization technology was used to pretreat Yashixiang Dancong tea, the ultrasonic-assisted and orthogonal experiment method was used to optimize the extraction conditions of tea polysaccharide, and then the antioxidant and antibacterial activity was investigated. [Result]The optimized extraction conditions of superfine pulverization Yashixiang Dancong tea polysaccharide were the following: extraction time 150 min; extraction temperature 70 ℃; repetition of the extracting procedure 2 times and solid-liquid ration 1∶30 (g/mL). Under such conditions, polysaccharide yield was 6.72%. The results of in vitro antioxidant results showed that tea polysaccharide from Yashixiang Dancong had strong scavenging effect on ABTS+ and DPPH free radicals, the trend of its scavenging activity changed was basically positively correlated with the concentration of tea polysaccharide; the in vitro antibacterial activity studies showed that Yashixiang Dancong tea polysaccharide had inhibitory effects on 4 bacterial strains, which the inhibitory activity was the strongest against Staphylococcus aureus, the value of MIC was 3.125 mg/mL. [Conclusion]The extraction process of tea polysaccharide in this experiment is simple, with high yield and good antioxidant activity, which provides a theoretical basis and important reference for further research and new product development of Yashixiang Dancong tea polysaccharide.
Key words Yashixiang Dancong tea;Superfine pulverization;Polysaccharide;Antioxidant activity;Antibacterial activity
基金项目 韩山师范学院博士启动项目(QD202124);2021年韩山师范学院大学生创新创业训练计划项目(2021242)。
作者简介 丁莫(1990—),男,安徽安庆人,实验师,硕士,从事农产品加工与贮藏研究。*通信作者,讲师,博士,从事天然活性多糖研究。
收稿日期 2023-02-16;修回日期 2023-03-14
凤凰单枞是我国传统名茶,属于乌龙茶,产于广东省潮州市凤凰山。单枞茶种植历史悠久,茶树大多生长在海拔1 000 m以上的山区,地区土壤肥沃且富含有机质和多种微量元素,孕育出凤凰单枞茶品种资源丰富,成茶品质优异,具有“形美、味甘、色翠、香郁”的特点[1-2],其中代表香型有鸭屎香、蜜兰香和桂花香等。因其独特的生长环境和自然的发酵工艺,单枞茶除含有大量茶多酚、氨基酸等活性物质外,还含有多糖类活性物质。茶多糖是茶叶细胞壁中一类由葡萄糖、木糖、鼠李糖、甘露糖等单糖通过β-(1,3)糖苷键连接组成糖链,同时结合糖醛酸、蛋白质和中性糖等物质的酸性多糖或酸性糖蛋白[3],具有抗氧化[4-5]、降血糖[6]、降血脂[7]、免疫调节[8-10]等功能,可作为天然食品提高免疫力及发挥保健功能的物质基础之一[11-12]。Scoparo等[13]以脓毒症小鼠为研究对象,将红茶多糖和绿茶多糖分别作用于脓毒症小鼠,发现与对照组相比致死率明显降低,其作用机制与其糖醛酸含量有关;Chen等[14]对粗茶多糖提取分离后多糖的抗氧化性进行研究,得出茶多糖具有抗氧化、清除自由基等作用,在调节人体机能方面具有重要的药理活性。
超微粉碎技术是利用超细化的机械加工手段使颗粒固体克服内部凝聚力,破坏植物细胞壁使之粉碎至10~25 μm新型物料破碎技术,与传统粉碎技术相比,超微粉碎得到的物料粒度更小,超微粉体具有界面活性,且能明显提高物料的分散性、溶解性和活性物质的溶出性等[15-16],因此超微粉碎技术广泛应用于食品、中药等加工领域。目前有关茶多糖的研究主要集中于绿茶、红茶、白茶等茶类,如尚进等[17]研究表明,铁观音茶梗多糖提取工艺发现,在最优条件下(温度100 ℃、时间2 h、料液比1∶40)茶多糖提取率为2.97%;宋珊珊等[18]通过正交试验,确定湄潭白茶茶多糖最佳提取工艺条件,进而对茶多糖的抑菌性做了研究,但对潮州鸭屎香单枞茶多糖提取和活性研究尚鲜见报道。笔者以潮州鸭屎香单枞茶为原料,利用球磨仪对茶叶颗粒进行超微粉碎并结合超声波辅助提取茶多糖,采用热水-乙醇沉淀法提取茶多糖,通過正交试验设计对提取工艺进行优化,研究茶多糖的抗氧化活性和抑菌性能,以期为鸭屎香单枞茶作为高附加值产品及茶资源开发利用提供参考,从而提高茶叶的经济价值。
1 材料与方法
1.1 材料与试剂
浓硫酸(分析纯)、三氯乙酸,购于西陇化工股份有限公司;蒽酮(分析纯),购于上海展云化工有限公司;无水葡萄糖(分析纯)、1,1-二苯基-2-三硝基苯肼(DPPH),购于天津市北辰方正试剂;其他化学试剂均为分析纯,购于西陇化工股份有限公司。
1.2 仪器与设备
TG-16WS高速台式离心机,湖南湘仪实验室仪器开发有限公司;ML204/02精密电子天平,梅特勒-托利多仪器(上海)有限公司;HWS-24电热恒温水浴锅,上海—恒科学仪器有限公司;V110Pro型可见分光光度计,翱艺仪器(上海)有限公司;TU-1901双光束紫外可见分光光度计;北京普析通用仪器有限责任公司;GZX-9146MBE电热鼓风干燥箱,上海博讯实业有限公司医疗设备厂;JJ-2组织捣碎机,金坛区白塔新宝仪器厂;XW-80A微型旋涡混合仪,上海沪西分析仪器厂有限公司;XQM-8行星球磨仪,长沙天创粉末技术有限公司;FDU-2110冷冻干燥机,上海爱朗仪器有限公司;N-1001旋转蒸发仪,上海爱朗仪器有限公司;KQ-500DE型数显超声波清洗器,昆山市超声仪器有限公司;鸭屎香单枞茶,购于潮州市益缘茶业。
1.3 试验方法
1.3.1 超微粉碎的茶粉制备。
取鸭屎香单枞茶叶在50 ℃条件下烘至恒重,用高速粉碎机粉碎后过筛(60目),再将茶叶粉末经行星球磨仪粉碎得到鸭屎香单枞茶超微茶粉(粒径<100 μm),置于干燥皿内保存备用。
1.3.2 茶多糖提取工艺。
准确称取10.0 g鸭屎香单枞茶超微茶粉于锥形瓶中,加入一定比例的蒸馏水,在一定的温度、提取时间和提取次数的条件下进行超声波辅助提取[19],提取液放置冷却并进行离心(8 000 r/min,5 min),取上清液得到粗多糖提取液;向粗多糖提取液中加入等体积Sevage试剂(氯仿∶正丁醇=4∶1,mL/mL),充分振荡混匀,静置20 min,收集上清液[20-21],向上清液中加入4倍体积无水乙醇进行充分混匀,在4 ℃温度下醇沉12 h以上,离心(8 000 r/min,5 min)取沉淀物,经真空冷冻干燥6 h制得脱蛋白茶多糖样品,备用。
1.3.3 茶多糖提取率测定。
1.3.3.1 葡萄糖标准曲线绘制。
采用苯酚-硫酸法测定[22],取干燥并恒重的葡萄糖,分别配制浓度为0.02、0.04、0.06、0.08和0.10 mg/mL葡萄糖溶液各1.0 mL,分别加入4.0 mL配制好的蒽酮-硫酸试剂,充分混匀后在100 ℃条件下水浴加热6 min,充分反应并迅速冷却后在波长490 nm 处测定吸光值。以标准溶液浓度(X)为横坐标,吸光值(Y)为纵坐标绘制标准曲线,得出回归方程为Y =0.011 9X-0.003 5,R2=0.999 3,说明葡萄糖标准品在0.02~0.10 mg/mL呈良好的线性关系。
1.3.3.2 茶多糖提取率测定。
取1 mL稀释后的茶多糖上清液放入具塞试管中,按照“1.3.3.1”方法测定茶多糖样品吸光值,代入标准曲线计算得到样品溶液中多糖浓度,然后按下式(1)计算得到多糖的得率。
茶多糖得率(%)=C×V×NW×103×100(1)
式中:C为葡萄糖浓度(mg/mL);V为样品浸提后上清液体积(mL);N为样品浸提后上清液稀释倍数;W为茶粉称取量(g)。
1.3.4 单因素试验设计。
1.3.4.1 提取时间对茶多糖提取得率的影响。
分别称取10.0 g鸭屎香单枞茶超微茶粉,在料液比为1∶20、提取温度为60 ℃固定条件下,提取时间分别为30、60、90、120和150 min时按照“1.3.2”中的方法进行多糖提取1次,测定多糖含量,确定最佳浸提时间。
1.3.4.2 提取温度对茶多糖提取得率的影响。
分别称取10.0 g鸭屎香单枞茶超微茶粉,在料液比为1∶20、提取时间为60 min固定条件下,提取温度分别为50、60、70、80和90 ℃时按照“1.3.2”中的方法进行多糖提取1次,测定多糖含量,确定最佳提取温度。
1.3.4.3 提取次数对茶多糖提取得率的影响。
分别称取10.0 g鸭屎香单枞茶超微茶粉,在料液比为1∶20、水浴温度为60 ℃、提取时间为60 min固定条件下,按照“1.3.2”中的方法进行多糖提取1、2、3、4和5次,测定多糖含量,确定最佳提取次数。
1.3.4.4 料液比对茶多糖提取得率的影响。
分别称取10.0 g鸭屎香单枞茶超微茶粉,在提取时间为60 min、提取温度为60 ℃固定条件下,料液比分别1∶15、1∶20、1∶25、1∶30和1∶35时按照“1.3.2”中的方法进行多糖提取1次,测定多糖含量,确定最佳料液比。
1.3.5 正交试验设计。
基于单因素试验结果,选取提取时间(A)、提取温度(B)、提取次数(C)和料液比(D)为考察因素,将茶多糖的提取得率作为考察指标,采用4因素3水平L9(34)(表1)进行正交试验优化鸭屎香单枞茶多糖提取工艺,筛选不同提取方法中各因素对提取茶多糖的贡献率及得率较高的试验组。
1.3.6 ABTS+自由基清除能力。
参考Shen等[23]的测定方法并略加修改,ABTS母液制备:分别制备浓度为2.45 mmol/L K2S2O8溶液与浓度为7.00 mmol/L的ABTS并等体积混匀,在室温避光反应12~16 h,制成ABTS母液。再将10 mmol/L、pH为7.4的磷酸盐缓冲液缓慢加到ABTS母液中,使得混合溶液在波长734 nm處的吸光度稳定在1.100±0.020范围内即可得到ABTS工作液。
分别准确吸取100、200、300、400、500和600 μL待测的茶多糖样品溶液,用蒸馏水定容至1 mL,然后分别加入4 mL ABTS工作液,充分均匀摇晃30 s孵育6 min后,记录734 nm处的吸光度A1;按照相同方法,测定茶多糖样品溶液和蒸馏水的吸光度为A2;ABTS工作液与蒸馏水的吸光度为A0。以VC溶液作为阳性对照。按式(2)计算:
ABTS+自由基清除率=(1-A1-A2A0)×100%(2)
1.3.7 DPPH自由基清除能力[24]。
用无水乙醇配制浓度为0.5 mg/mL的DPPH-乙醇溶液,备用。然后分别吸取100、200、300、400、500和600 μL浓度为1.0 mg/mL的茶多糖样品溶液,用蒸馏水稀释到1.0 mL后加4.0 mL DPPH-乙醇溶液,混匀静置反应30 min,于波长517 nm处测定吸光值,按式(3)计算。相同的方法,以VC溶液作为阳性对照。
DPPH自由基清除率=(1-Aa-AbAc)×100%(3)
式(3)中:Aa为茶多糖和DPPH混合溶液吸光度;Ab为茶多糖溶液和无水乙醇吸光度,Ac为样品空白对照组吸光度。
1.3.8 抑菌活性研究。
1.3.8.1 供试菌株抑菌活性测定。
茶多糖对供试菌株抑菌活性测定参照冯筱巍等[25]的方法,吸取50 μL供试菌液(密度为105 CFU/mL)均匀涂布于营养琼脂平板,将已高压灭菌的牛津杯放置其上,加入最佳工艺方案提取且过滤除菌的50 μL 100 mg/mL茶多糖溶液;阳性对照为50 μL 10 μg/mL抗生素环丙沙星溶液;阴性对照为50 μL无菌蒸馏水。以上试验组均置于37 ℃培养18~24 h。
1.3.8.2 供试菌株最低抑菌浓度(MIC)测定。
分别吸取最佳工艺方案提取且过滤除菌的100 μL不同浓度的茶多糖溶液(50、25、12.5、6.25、3.125、1.563、0.781、0.391、0.195)与供试菌液等体积混合;阳性对照组为200 μL供试菌液;阴性对照组为200 μL营养肉汤。以上试验组均置于37 ℃培养18~24 h,观察并记录结果,以肉眼观察未见细菌生长的最低浓度为MIC。
1.4 数据处理
每组试验随机重复3次,结果以平均值±标准偏差表示,用Excel 2016软件作图。
2 结果与分析
2.1 单因素试验结果
2.1.1 提取时间对鸭屎香单枞茶多糖提取率的影响。
由图1可知,提取时间在30~120 min,随着提取时间的延长,鸭屎香茶多糖得率也逐渐增大,在提取时间为120 min时,得率为5.41%,达到最高,随着提取时间继续延长,得率有下降趋势,发现提取时间和得率并不是呈正相关关系。分析可能是由于提取时间延长,增加其他溶解性杂质,茶多糖在两相中的浓度差减小,使得多糖溶解度随之减小并不再析出,另外,持续加热使多糖水解及发生氧化反应,共同导致多糖提取率下降[26],因此提取时间为120 min为最佳。
2.1.2 提取温度对鸭屎香单枞茶多糖提取率的影响。
从图2可以看出,提取温度对鸭屎香茶多糖的提取得率有明显的影响,提取温度在50~70 ℃,多糖得率随着温度的升高而增大,原因是经过超微粉碎的茶粉细胞壁有一定程度的破坏,随着提取温度升高细胞壁的破坏程度进一步加剧,而细胞壁的破坏有利于多糖的溶出。提取温度为70 ℃时,多糖得率达到最大值,为5.44%,提取温度超过70 ℃,多糖提取得率呈下降趋势,分析原因可能是温度过高,提取液中多糖分子受到破坏分解,使多糖得率下降[27]。因此,初步确定提取温度在70 ℃比较适合。
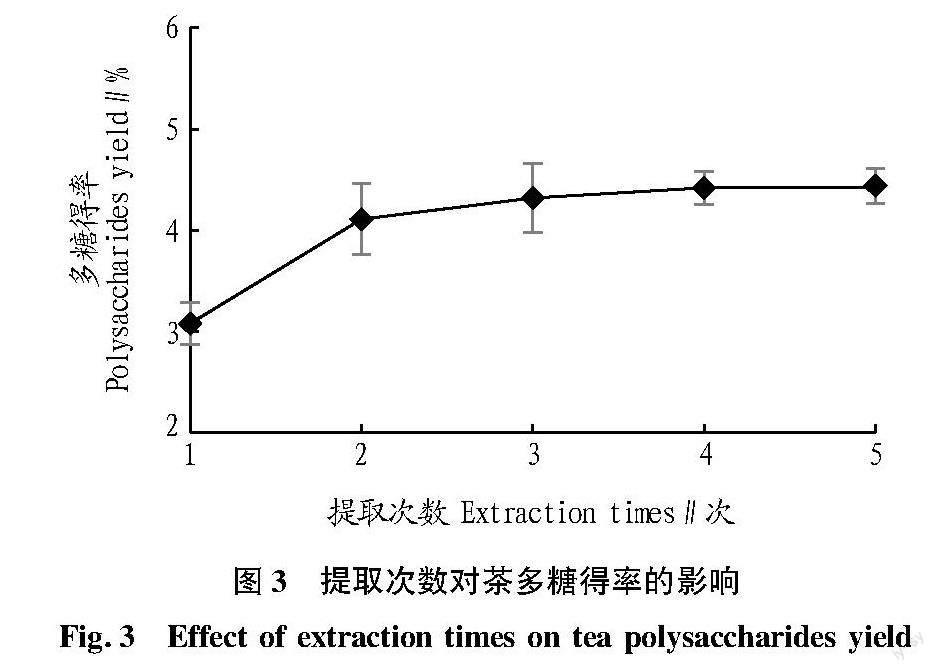
2.1.3 提取次数对鸭屎香单枞茶多糖提取率的影响。
从图3可见,当提取次数为2次时,茶多糖提取得率增加了1.03百分点,随着提取次数增加,多糖得率没有明显变化,原因是多糖的提取量已到达最高值,继续增加提取次数并不会显著提高得率。从节约成本和时间方面考虑,选择提取2次为后续正交试验工艺优化的中心值。
2.1.4 料液比对鸭屎香单枞茶多糖提取率的影响。
多糖提取与料液比有密切关系,充足的溶剂量可保证样品充分浸没和溶质的溶出。从图4可见,随着料液比的增加,多糖得率呈先上升后下降的趋势,并在1∶30时达到最大值(5.42%)。分析原因:在热量一定情况下,当料液比较低时,固相与液相之间浓度差较小,导致多糖不易浸出;随溶剂量增多,细胞内外的多糖浓度梯度就越大,多糖扩散到溶剂里的含量就随之增加;但随着溶剂量继续增大,吸附作用增强而导致多糖得率略有下降[28]。因此,多糖提取料液比为1∶30最佳。
2.2 正交试验结果
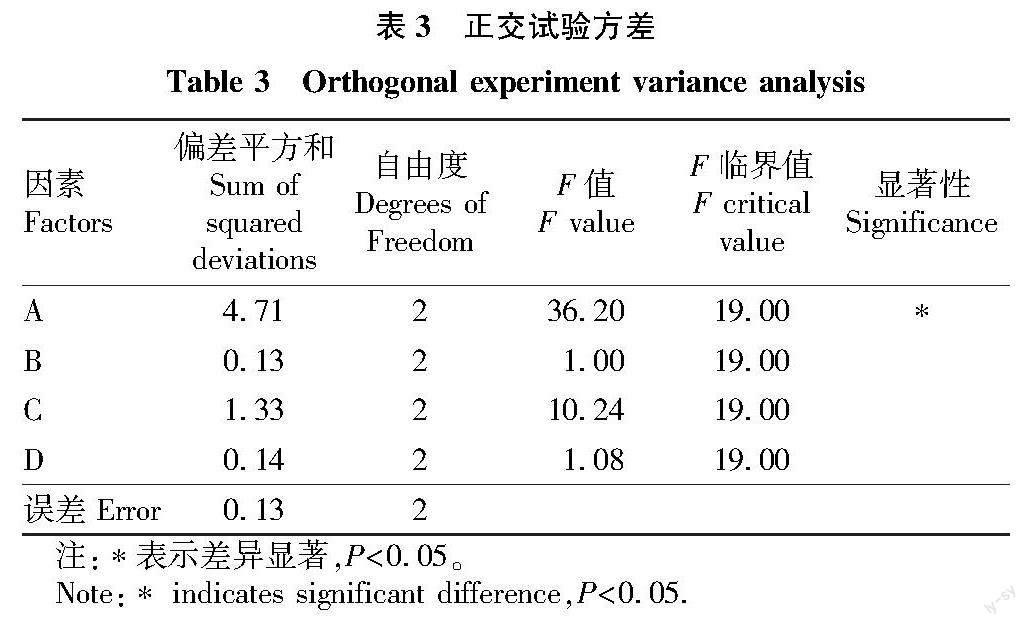
根据单因素试验结果,以鸭屎香单枞茶多糖的提取得率为标准,选取提取温度、提取时间、提取次数和液料比4个因素进行正交试验,结果见表2。由表2可知,影响茶多糖得率的因素主次顺序为:A(提取时间)>C(提取次数)>D(料液比)>B(提取温度)。结合表3可知,提取时间对茶多糖的提取得率影响最为显著,提取温度、提取次数和料液比对茶多糖的影响较小,茶多糖提取的最佳工艺条件为A3B2C2D3,即提取时间为150 min、提取温度为70 ℃、提取次数为2次和料液比1∶30。在该工艺条件下进行验证试验,重复3次试验,得到茶多糖提取得率平均值为(6.72±0.21)%。
2.3 多糖活性
2.3.1 抗氧化活性。
由图5a可知,在浓度为100~600 μg/mL,茶多糖和VC对ABTS+自由基均具有很好的清除作用,其中茶多糖的清除能力随着浓度的升高而增强,清除率由8.04%升高至 82.85%,呈正相关线性关系。相同浓度时,VC溶液清除ABTS+自由基的能力明显优于鸭屎香单枞茶多糖,但随浓度增加,茶多糖清除ABTS+自由基的能力增加趋势远高于VC溶液。从增长趋势来看,当茶多糖浓度增加到某一值时,其清除ABTS+自由基的能力可能会超过VC溶液,受试验浓度梯度选取限制这一结论并未得到验证。茶多糖对ABTS+自由基的IC50为252.03 μg/mL,表明对ABTS+自由基有较好的清除活性。
茶多糖对DPPH的清除率如图5b所示,鸭屎香单枞茶多糖对DPPH有一定的清除作用,在2~12 mg/mL,随着浓度的升高,茶多糖对DPPH自由基的清除活性增强,清除率从17.98%上升至82.27%,表现出明显的浓度依赖关系。低浓度时,茶多糖对DPPH自由基的清除能力明显弱于VC溶液,但随着茶多糖浓度升高,对DPPH自由基的清除能力增长率更大。IC50为6.52 mg/mL时,对DPPH自由基有较好的清除活性。
2.3.2 抑菌活性。
采用滤纸片法将不同浓度的茶多糖对4种供试菌株进行抑制试验,判定供试菌株对茶多糖的敏感性。以讯数-抑菌圈(抗生素效价)测量仪(CzoneG67)对抑菌圈直径进行测量,以抑菌圈直径的大小作为评价指标。如图6a所示,50 μL 100 mg/mL茶多糖溶液对4种供试菌种均表现出抑制效果,抑菌圈直径大小均在11.25~15.36 mm,抑菌圈直径由大到小表现为金黄色葡萄球菌>白色念珠菌>铜绿假单胞菌>大肠杆菌,得出茶多糖对金黄色葡萄球菌的抑制效果最为明显,抑菌圈直径为15.36 mm。茶多糖对4种供试菌株抑制效果均低于抗生素。由于茶多糖对4种供试菌株抑菌圈大小的考察是在同一固定浓度下进行的,而茶多糖对于不同菌株最适的抑菌浓度也有所差异,考虑到试验的严谨性,因此该试验进一步对供试菌株最低抑菌浓度进行测定。如图6b所示,对4种菌株的最低抑制浓度分别为3.125~25.000 mg/mL,其中茶多糖对金黄色葡萄球菌的抑菌效果强于另外3种菌株,与抑菌活性结果一致,最低抑菌濃度为3.125 mg/mL。
3 结论与讨论
该研究通过单因素试验和正交试验优化得到鸭屎香单枞茶多糖提取工艺,得出提取温度对多糖得率有显著影响,最佳提取工艺条件:提取时间150 min、提取温度70 ℃、提取次数为2次和料液比1∶30,在该提取条件下,鸭屎香单枞茶多糖的平均得率达到6.72%。在一定浓度范围内,鸭屎香茶多糖对ABTS+自由基和DPPH自由基的清除能力与浓度呈正相关,其IC50值分别为252.03 μg/mL和6.52 mg/mL,说明鸭屎香单枞茶多糖具有较好的体外抗氧化活性。抑菌活性试验得出,鸭屎香单枞茶多糖对大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌和白色念珠菌均有抑制作用,且对金黄色葡萄球菌的抑制效果最佳,对各菌株的最低抑菌浓度测定也验证了这一结论。该研究为鸭屎香单枞茶多糖的综合利用及资源开发提供相关理论参考和科学依据,使鸭屎香单枞茶多糖在功能性食品中的应用具有较高的可行性,为地方茶类资源的精深加工及高值利用奠定基础。
參考文献
[1]王桔红,庄东红,马瑞君,等.广东凤凰单枞茶树品种(系)叶片主要性状的种间差异和地域变异研究[J].茶叶科学,2014,34(5):525-530.
[2]严赞开,李跃林,庄东红,等.凤凰单枞香气成分的分析[J].食品研究与开发,2015,36(10):78-81.
[3]CHEN H X,QU Z S,FU L L,et al.Physicochemical properties and antioxidant capacity of 3 polysaccharides from green tea,oolong tea,and black tea[J].Journal of food science,2009,74(6):C469-C474.
[4]LU X S,ZHAO Y,SUN Y F,et al.Characterisation of polysaccharides from green tea of Huangshan Maofeng with antioxidant and hepatoprotective effects[J].Food chemistry,2013,141(4):3415-3423.
[5]SUN Y F,YANG X B,LU X S,et al.Protective effects of Keemun black tea polysaccharides on acute carbon tetrachloride-caused oxidative hepatotoxicity in mice[J].Food and chemical toxicology,2013,58:184-192.
[6]WANG Y F,PENG Y H,WEI X L,et al.Sulfation of tea polysaccharides:Synthesis,characterization and hypoglycemic activity[J].International journal of biological macromolecules,2010,46(2):270-274.
[7]WU T,GUO Y,LIU R,et al.Black tea polyphenols and polysaccharides improve body composition,increase fecal fatty acid,and regulate fat metabolism in high-fat diet-induced obese rats[J].Food & function,2016,7(5):2469-2478.
[8]MONOBE M,EMA K,KATO F,et al.Immunostimulating activity of a crude polysaccharide derived from green tea(Camellia sinensis)extract[J].Journal of agricultural and food chemistry,2008,56(4):1423-1427.
[9]MONOBE M,EMA K,TOKUDA Y,et al.Enhancement of phagocytic activity of macrophage-like cells by pyrogallol-type green tea polyphenols through caspase signaling pathways[J].Cytotechnology,2010,62(3):201-203.
[10]YUAN C F,LI Z H,PENG F,et al.Combination of selenium-enriched green tea polysaccharides and Huo-ji polysaccharides synergistically enhances antioxidant and immune activity in mice[J].Journal of the science of food & agriculture,2015,95(15):3211-3217.
[11]边亮,陈华国,周欣.植物多糖的抗肿瘤活性研究进展[J].食品科学,2020,41(7):275-282.
[12]冯优,王凤山,张天民,等.多糖类药物的研究进展[J].中国生化药物杂志,2008,29(2):129-133,139.
[13]SCOPARO C T,DE SOUZA L M,RATTMANN Y D,et al.Polysaccharides from green and black teas and their protective effect against murine sepsis[J].Food research international,2013,53(2):780-785.
[14]CHEN X Q,WANG Y F,WU Y L,et al.Green tea polysaccharide-conjugates protect human umbilical vein endothelial cells against impairments triggered by high glucose[J].International journal of biological macromolecules,2011,49(1):50-54.
[15]ZHU F M,DU B,LI J.Effect of ultrafine grinding on physicochemical and antioxidant properties of dietary fiber from wine grape pomace[J].Food science and technology international,2014,20(1):55-62.
[16]ZHU K X,HUANG S,PENG W,et al.Effect of ultrafine grinding on hydration and antioxidant properties of wheat bran dietary fiber[J].Food research international,2010,43(4):943-948.
[17]尚进,江波,张燕,等.响应面法优化铁观音茶梗中茶多糖提取工艺[J].基因组学与应用生物学,2017,36(11):4811-4817.
[18]宋姍姗,杨艾华,王微微,等.湄潭白茶多糖提取工艺优化及其抑菌活性研究[J].食品工业科技,2021,42(13):230-234.
[19]秦令祥,崔胜文,周婧琦,等.超微粉碎前处理协同超声波辅助提取香菇多糖工艺研究[J].食品研究与开发,2018,39(15):67-70.
[20]廖玲燕,帅良,罗焘,等.槟榔芋多糖提取工艺及其抗氧化活性的研究[J].食品科技,2018,43(7):181-188.
[21]郭华,刁全平,张博,等.杨树口蘑多糖的超声波辅助提取工艺及其抗氧化活性[J].食品工业科技,2018,39(5):180-184.
[22]赵仕花,卢明顺,巫楚军,等.芒果果皮多糖酶法提取及其体外抗氧化活性[J].食品研究与开发,2018,39(23):54-60.
[23]SHEN Y B,ZHANG H,CHENG L L,et al.In vitro and in vivo antioxidant activity of polyphenols extracted from black highland barley[J].Food chemistry,2016,194:1003-1012.
[24]韦献雅,殷丽琴,钟成,等.DPPH法评价抗氧化活性研究进展[J].食品科学,2014,35(9):317-322.
[25]冯筱巍,左国营,王根春,等.28种云南中草药体外抗菌活性筛选[J].西南国防医药,2011,21(7):719-722.
[26]ZHAO B T,ZHANG J,GUO X,et al.Microwave-assisted extraction,chemical characterization of polysaccharides from Lilium davidii var.unicolor Salisb and its antioxidant activities evaluation[J].Food hydrocolloids,2013,31(2):346-356.
[27]ZHAO Z Y,XU X J,YE Q W,et al.Ultrasound extraction optimization of Acanthopanax senticosus polysaccharides and its antioxidant activity[J].International journal of biological macromolecules,2013,59:290-294.
[28]帅良,廖玲燕,段振华,等.百香果果皮多糖提取工艺优化及其抗氧化活性研究[J].食品工业科技,2020,41(18):150-156.
