人教版必修第一册第三章研究与实践 检验食品中的铁元素
2024-01-14张萍
张萍
【研究目的】
铁是人体必需的微量元素。食用富含铁元素的食品,可以补充人体所需的铁元素。通过化学实验的方法检验食品中的铁元素,体验实验研究的一般过程和化学知识在实际中的应用。
【阅读材料】
一、铁元素在人体中的作用
成年人体内含有4~5克铁,根据在体内的功能状态可分成功能性铁和储存铁两部分。功能性铁存在于血红蛋白、肌红蛋白和一些酶中,约占体内总铁量的70%。其余30%为储存铁,主要储存在肝、脾和骨髓中。
铁是合成血红蛋白的主要原料之一。血红蛋白的主要功能是把新鲜氧气运送到各组织。铁缺乏时不能合成足够的血红蛋白,造成缺铁性贫血。铁还是体内参与氧化还原反应的一些酶和电子傳递体的组成部分,如过氧化氢酶和细胞色素都含有铁。
二、人体铁元素的来源
动物内脏(特别是肝脏)、血液、鱼、肉类都是富含血红素铁的食品。深绿叶蔬菜所含铁虽不是血红素铁,但摄入量多,所以仍是我国人民膳食铁的重要来源。
三、常用的三价铁离子的检验方法
(一)苯酚检验法。铁离子与苯酚反应,可生成显紫色的络离子(络合物)。
(二)硫氰化物鉴别法。取溶液各少量,滴入可溶性硫氰化物(如KSCN、NaSCN等)溶液,变红色的是铁离子溶液,因为生成了显红色的络合物 。
(三)碱鉴别法。加入氢氧化钠、氨水或氢氧化钾等碱性溶液后,有红褐色沉淀生成,并检测开始沉淀和沉淀完全时的pH,发现从开始沉淀到沉淀完全时溶液的pH(常温下)为2.7~3.7的是铁离子。
(四)亚铁氰化钾溶液法(黄血盐溶液)。铁离子在酸性溶液中与亚铁氰化钾溶液生成蓝色沉淀,称为普鲁士蓝。
【实验仪器】
研钵、烧杯、剪刀、漏斗、玻璃棒、试管、滴管、滤纸。
【实验药品】
菠菜、蒸馏水、稀硝酸、KSCN溶液。
【实验步骤】
一、取新鲜的菠菜10 g,将菠菜剪碎后放在研钵中研磨,然后倒入烧杯中,加入30 mL蒸馏水,搅拌。将上述浊液过滤,得到的滤液作为试验样品。
二、取少许试验样品加入试管中,然后加入少量稀硝酸(稀硝酸具有氧化性),再滴加几滴KSCN溶液,振荡,观察到溶液变红色。
结论:菠菜中含有铁元素。
【思考与讨论】
一、在实验中由于菠菜汁颜色,所以对于实验现象的观察有一定的影响,想一想可以怎么改进这个实验。
提示:可以先将菠菜燃烧成灰,再溶解、过滤进行实验。
二、实验中加入稀硝酸的目的是什么?
提示:将菠菜汁里的铁元素变成三价铁离子,从而进行检验。
【理解应用】
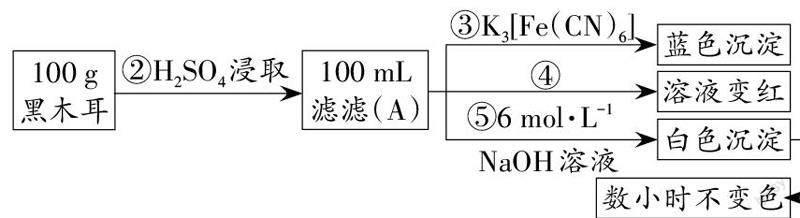
1.(2019·北京东城区高一期末)某兴趣小组同学为探究黑木耳中含铁量,进行如下实验。
已知:ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素C)等,每100 g黑木耳含铁量高达185 mg;
ⅱ.紫色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。
Ⅰ.为确定黑木耳中含有铁元素,甲同学设计实验方案如下。
(1)步骤②得到滤液A的操作是_________。
(2)步骤④检验Fe3+所用试剂是_________溶液。
(3)下列有关上述实验得出的结论是_________(填字母)。
a. 黑木耳中一定含Fe2+和Fe3+
b. 滤液A中一定含Fe2+和Fe3+
c. 白色沉淀中一定含Fe(OH)2
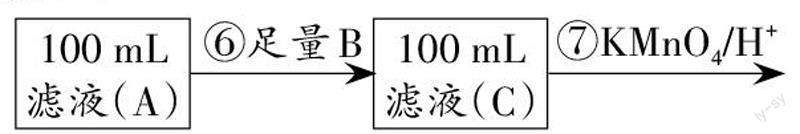
Ⅱ. 为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
(4)可选做试剂B的物质是 (填序号)。
a.Na b.Zn c.Fe d.Cu
(5)步骤⑦中观察到的实验现象是_________,反应的离子方程式是___________________________。
(6)若乙同学实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是__________________。
答案:(1)过滤 (2)KSCN (3)bc (4)d (5)酸性高锰酸钾溶液紫色褪去 5Fe2++MnO-
4+8H+=5Fe3++Mn2++4H2O
(6)黑木耳中还含有其他还原性物质(或黑木耳中还含有维生素C)
解析 (1)不溶性固体和液体的分离可采用过滤的方法,因此步骤②得到滤液A的操作是过滤。
(2)一般用KSCN溶液检验铁离子,实验现象是溶液显红色,则步骤④检验Fe3+所用试剂是KSCN溶液。
(3)根据步骤③中产生蓝色沉淀可知滤液A中含有亚铁离子,则白色沉淀中含有Fe(OH)2;根据步骤④可知滤液A中含有铁离子,由于在灼烧过程中亚铁离子可能被氧化为铁离子,所以黑木耳中不一定含有铁离子,所以a错误,b、c正确。
(4)滤液A中含有铁离子,需要利用还原剂将其转化为亚铁离子,且不能再引入铁元素,也不能干扰亚铁离子与高锰酸钾的反应。金属钠在溶液中反应生成NaOH,NaOH与铁离子反应生成沉淀,得不到亚铁离子,a错误;金属锌与铁离子、亚铁离子和高锰酸钾均反应,b错误;金属铁和铁离子反应生成亚铁离子,但引入了铁元素,c错误;金属铜与铁离子反应生成亚铁离子和铜离子,且不会影响亚铁离子与高锰酸钾的反应,d正确。
(5)酸性高锰酸钾溶液与亚铁离子反应生成铁离子、锰离子和水,则步骤⑦中观察到的实验现象是酸性高锰酸钾溶液紫色褪去,反应的离子方程式是5Fe2++MnO-
4+8H+=5Fe3++Mn2++4H2O。
(6)由于黑木耳中含有其他还原性物质,如维生素C,导致消耗高锰酸钾溶液的体积增加,所以测得含铁量远大于实际的含量。
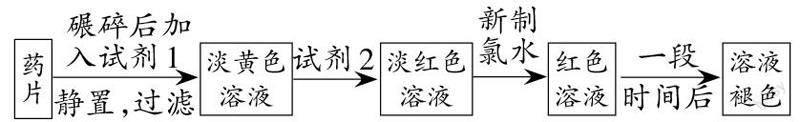
2.(2020·辽宁滨海实验中学期末)铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
试回答下列问题。
(1)试剂1是_________,试剂2是_________,加入新制氯水后溶液中发生反应的离子方程式是_________、_________ 。
(2)加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为_________,写出+2价Fe在空气中转化为+3价Fe的化学方程式:__________________。
(3)该同学猜想红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗?_________。若你认为合理,请说明理由(若你认为不合理,该空不作答)_________;若你認为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不作答)_________。
答案:(1)稀盐酸 KSCN溶液 2Fe2++Cl2=2Fe3++2Cl- Fe3++3SCN-=Fe(SCN)3
(2)少量的Fe2+转化为Fe3+ 4FeCl2+O2+4HCl=4FeCl3+2H2O (3)不合理 猜想:Fe(SCN)3中的SCN-被过量的氯水氧化;设计的实验为在褪色后的溶液中加入FeCl3溶液,不变红色(或在褪色后的溶液中加入KSCN溶液,变红色)
解析 (1)该药品不溶于水但能溶于人体中的胃酸,试剂1用于溶解样品,可以选用稀盐酸;试剂2用于检验三价铁离子,可以选用KSCN溶液;氯气氧化亚铁离子生成铁离子,离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;铁离子与硫氰根离子结合生成硫氰化铁,离子方程式为:Fe3++3SCN-=Fe(SCN)3。
(2)Fe3+遇KSCN溶液变红色,溶液由淡黄色变为浅红色,说明少量Fe2+被氧化成Fe3+;亚铁离子被空气中的氧气氧化为铁离子,化学方程式为4FeCl2+4HCl+O2=4FeCl3+2H2O。
(3)因为氯水氧化性强,不会还原Fe3+,该同学的猜想不合理;可能是SCN-被过量的氯水氧化,可取少量褪色后的溶液,加入FeCl3溶液,不变红色(或取少量褪色后的溶液,加入KSCN溶液,变红色)。
