NAC类转录因子在‘砀山酥梨’黄化叶复绿过程中的表达分析
2024-01-13郭国凌汤小美叶振风
郭国凌 ,余 桃 ,汤小美 ,刘 伦 ,叶振风 ,贾 兵*
(1 安徽农业大学 园艺学院园艺作物品质生物学安徽省重点实验室,合肥 230036;2 贵阳市农业试验中心,贵阳 550018)
中国梨树栽培面积和总产量分别约为98.64万hm2和1 923万t,分别占世界梨栽培总面积和总产量的69.32%和71.45%(https://www.fao.org/faostat/en/#data/QCL,FAQ,2021)。黄河故道地区是中国梨主产区之一,主栽品种为‘砀山酥梨’,近年来,由于肥水管理不当,造成当地土壤碱化严重,导致并加剧了梨叶黄化现象的发生,且已逐渐发展为其主要的生理性病害之一,严重威胁产业发展[1]。
铁是梨树生长发育过程中必不可少的微量元素之一,参与植物叶绿素合成在内的多种生物过程[2]。虽然土壤中铁较为丰富,但多以植物难吸收的Fe3+形式存在,易造成植物缺铁[3]。缺铁会导致叶绿体瓦解而抑制叶绿素合成,并扰乱一系列生化反应,表现为幼叶失绿[4]。为获取足量铁以供自身所需,植物形成了以拟南芥、玉米为代表的铁还原策略Ⅰ和以烟草、水稻为代表的铁螯合策略Ⅱ 2种铁吸收系统[5]。而梨属于铁吸收机制Ⅰ,其铁吸收能力主要取决于根系酸化基因AHA2(PM H+-ATPases2)、铁离子螯合还原酶基因FRO2(ferric-chelate reductase oxidase2)和铁转运蛋白基因IRT1(iron regulated transporter)的表达[6],而该基因表达受多种转录因子的调控,其中bHLH(basic-helix-loop-helix)是目前研究最为广泛,且与植物缺铁黄化密切相关的关键调控因子[7]。研究表明,Ⅰb 和Ⅳc类bHLH 可直接或间接促进AHA2、FRO2和IRT1的表达,增强植物抗缺铁能力[8-10];但Ⅳa和Ⅳb类bHLH 因子则功能相反,其可抑制Ⅰb 和Ⅳc 类bHLH基因的表达或影响其蛋白稳定性,进而抑制植物缺铁响应[11-13]。
作为另一种广泛分布于植物内,且与低/高温[14-15]、干旱[16-17]和盐害[17-18]等多种非生物胁迫响应相关的转录因子,NAC(NAM、ATAF1/2 和CUC2)对于维持植物内铁稳态平衡也具有重要意义。研究发现,苹果中受缺铁胁迫显著诱导的Md-NAC1可通过促进AHA2/12和FRO2等基因的表达,增强根系酸化能力,促进植株对铁的吸收[19];受缺铁胁迫显著诱导的AtNAC5则可以FIT(ferlike iron deficiency-induced transcription factor)和PYE(POPEYE)非依赖性途径正向调控拟南芥的缺铁胁迫应答[20];水稻中NAC 转录因子IDEF2则可直接增强水稻中促铁吸收基因IDE2(iron deficiency-responsive cis-acting elements 2)的表达,促进铁充足条件下的水稻叶片和根中的铁积累[21]。
前期研究结果表明:‘砀山酥梨’黄化叶内Fe2+含量显著低于正常叶,而以0.2% FeSO4溶液喷施生长期梨树的黄化叶,可诱导其复绿,并促进其叶内Fe2+的积累[22]。前转录组数据显示,梨叶黄化伴随着多个NAC 转录因子的差异表达[1]。因此,试验推测NAC类转录因子的表达可能与梨树缺铁黄化叶的复绿相关。目前关于PbrNAC在梨叶缺铁胁迫应答和黄化叶复绿中的研究鲜见报道。试验以生长期‘砀山酥梨’正常叶和黄化叶为试材,于黄化叶叶面喷施0.2%FeSO4溶液,验证FeSO4处理对黄化叶内Fe2+含量的影响;基于前转录组数据,鉴定在梨正常叶和黄化叶内显著差异表达的PbrNAC基因;采用生物信息学方法分析相关PbrNAC 蛋白的基本结构和理化性质等,结合qRT-PCR 技术分析其组织特异性表达模式和在梨缺铁黄化叶复绿过程中的表达规律。以Pearson相关性分析,探讨该过程中PbrNAC表达量与叶内Fe2+积累的关系;最后再以qRT-PCR,探讨与叶内Fe2+积累相关的PbrNAC在地上部叶片和地下部根中的协同表达特性,以期为分析和丰富梨缺铁黄化调控网络奠定了基础,为缺铁胁迫敏感梨品种的分子改良提供方向。
1 材料和方法
1.1 试验材料与处理
试验于2020年5月在安徽省砀山县园艺场二分场开展,所用试材为场内呈开心形的15年生‘砀山酥梨’缺铁黄化梨树(C)和正常梨树(N),其栽植密度适中,立地条件和栽培管理水平一致。于梨树生长期以0.2% FeSO4溶液全面喷施梨树缺铁黄化叶叶面,施用量为10 L/株,并以等量清水处理后的梨树正常叶(CN)和黄化叶(CC)作为对照。单次试验处理含3个生物学重复,每次重复设3棵梨树,共计9棵。于FeSO4处理后的第0天收集对照组叶片,并分别于处理后的第3,6,9,12天(T3、T6、T9和T12)收集叶样保存于-80 ℃待用。Fe2+含量测定采用稀盐酸-邻菲啰啉比色法[23]。
为分析PbrNAC基因的组织表达特异性,收集该场区‘砀山酥梨’嫁接砧木‘杜梨’的幼嫩根毛、距离地面30 cm 以上的地上部茎段、正常梨树新叶、盛花期花瓣和盛花后75 d的果实这5种组织,均保存于-80 ℃待用。
1.2 PbrNAC 基因筛选与鉴定
基于华大基因交互式报告平台(https://report.bgi.com/ps/login/login.html)所提供的RNA-seq数据中N 和C 内各基因的注释信息和FPKM 值(基因表达水平)[1],以P<0.05、|log2αFC|≥1为标准(αFC,差异表达倍数值,即各基因的FPKMN与FPKMC的比值),筛选N 和C 内显著差异表达的PbrNAC基因,并将其作为参与梨树缺铁黄化叶复绿的候选基因。候选PbrNAC基因和蛋白序列均下载自南京农业大学梨基因组数据库(http://peargenome.njau.edu.cn/);同时为分析其在正常和黄化梨树根系(杜梨)中的表达,参考在线平台GDR(https://www.rosaceae.org/species/pyrus/all)所提供的杜梨基因组数据,以Bioedit(Version 7.0.9)软件进行Blast 序列查询和分析,获取PbrNAC在‘杜梨’中的同源PbeNAC基因序列,并以DNAMAN(Version 9.0)进行序列比对分析和验证。
分析候选PbrNAC在CC、CN以及T3、T6、T9和T12中的表达趋势,以期分析其与梨树缺铁黄化叶复绿的关系,筛选出核心候选基因,基因命名参照Gong等的研究进行[24]。
1.3 候选PbrNAC 基因的生物信息学分析
使用在线工具Pfam(http://pfam.xfam.org/)和CDD(https://www.ncbi.nlm.nih.gov/cdd)对获取的梨PbrNAC候选基因进行蛋白质结构域的验证;参照NCBI(https://www.ncbi.nlm.nih.gov/)梨基因组注释文件,以TB tools(Version 1.119)进行候选PbrNACs基因结构的可视化;使用在线工具ProtParam(https://web.expasy.org/protparam/)对其蛋白的理化性质进行分析,主要包括其氨基酸数、分子量、等电位点、脂肪族氨基酸数和蛋白质疏水性等;于在线网站MEME(http://meme-suite.org/)进行motif基序分析,并以TB tools软件进行可视化;以在线工具WoLF Psorf(https://www.genscript.com/wolf-psort.html/)开展亚细胞定位预测;以MEGA7.0软件构建拟南芥AtNAC 蛋白与梨候选PbrNAC蛋白的系统进化树,并以Clustal W 进行蛋白的多序列比对,进化树构建方法为邻接法,其中自展值的初始值设置为1 000次,其他参数均设置为默认值。系统进化树的可视化和美化均于EvolView (https://www.evolgenius.info/evolview-v2/)进行。拟南芥AtNAC 蛋白序列均下载自TAIR(https://www.arabidopsis.org/)拟南芥数据库,分类标准以Zhang等的研究[25]为参照。
1.4 RNA提取与实时荧光定量PCR分析
各样本总RNA 的提取参照植物多糖多酚RNA 快速提取试剂盒(RN53-EASYspin Plus,北京艾德莱生物科技有限公司)操作方法;cDNA 第一链的合成参照其反转录试剂盒PC54-TRUEscript RT kit(+gDNA Eraser)说明进行。基于查询得到的候选PbrNAC基因序列,使用Premier 5.0软件设计其实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)引物(表1),扩增反应于ABI STEP-ONE(Thermal)荧光定量PCR 仪上进行。反应总体积为20 μL。其体系为Hieff®qPCR SYBR Green Master Mix with No Rox(11201ES08,翌圣生物科技上海股份有限公司)10 μL,模板cDNA 2 μL、正向和反向引物各0.8 μL、DEPC 水 6.4 μL。PCR 反应程序为:95 ℃预变性5 min,95 ℃变性10 s,60 ℃退火30 s,共计40个循环,每个样品3次重复。以梨Actin基因作为内参,使用2-ΔΔCT 法计算PbrNAC基因的相对表达水平[26],在各组织中的表达水平以最大-最小归一化处理后的数据展示。

表1 实时荧光PCR 引物序列Table 1 The primer pairs used for qRT-PCR
1.5 数据分析
数据运用Graphprism7 以单因素方差分析(ANOVA)法和Duncan多重极差法检验各处理的平均值,运用SPSS 23软件在P<0.05水平上,以最小显著性差异法(least-significant difference,LSD)进行各样本间的差异显著性比较;相关性分析于Origin 2023上进行,采用Pearson相关系数法和双变量分析方法,对组间均值和标准差进行双侧检验(P<0.05),并以热图形式呈现。
2 结果与分析
2.1 梨候选PbrNAC 的筛选与序列分析
试验于N 和C中共鉴定出136个PbrNAC基因,且以P<0.05、|log2αFC|≥1的标准,筛选得到21个在N和C内显著差异表达的PbrNAC(表2)。通过对这些基因的理化性质进行分析,发现其蛋白序列差异较大,所编码的氨基酸数从167(Pbr004500.1)~829(Pbr038615.1)不等,相对分子量介于19 091.99(Pbr004500.1)~91 841.88 D(Pbr021393.1)之间,差异明显;其等电点位于4.74~9.34之间,其中10个候选PbrNAC成员属于碱性蛋白(pI≥7),11个成员为酸性蛋白(pI<7)(表2)。在这21 个候选PbrNAC蛋白中,蛋白不稳定系数低于40的蛋白占比仅为4.21%,说明大多数属于不稳定蛋白,且亲水性分析结果表明,所有候选PbrNAC 蛋白的亲水性值均为负值,表明其均为亲水性蛋白;亚细胞定位预测结果显示,除Pbr004500.1、Pbr029956.1、Pbr040028.1 这3 个PbrNAC 预测定位于细胞质外,其他候选基因均被预测定位于细胞核(表2)。

表2 梨候选PbrNAC 基因家族成员理化性质信息Table 2 The basic information of the candidate NAC genes of pear (Pyrus bretschneideri Rehd.)
2.2 梨候选PbrNAC 基因的保守结构域和保守基序分析
为验证上述筛选结果的准确性,试验分析了该候选基因的结构域和基序(motif)。结果显示,该21个候选PbrNAC基因均含有1个高度保守的NAM结构域,且结构类似,均位于该基因的N 端(图1,A)。说明筛选得到的PbNAC基因均属于NAC转录因子。Motif 分析结果表明,该21 个候选PbrNAC基因所持有的motif数从4~9不等,其中Pbr026635.1基因上的motif数最多,为9 个,而Pbr032231.1基因的motif种类最为丰富,为8种。在所有motif中,motif 2,3,4普遍存在于各个基因(Pbr019212.1除外)(图1,B),且80%以上的PbrNAC基因均含有motif 1和motif 5(图1,B)。该21个PbrNAC的基因结构分析结果显示,其内含子数总体较少,结构相对类似。其中11个基因的内含子数为2个,而Pbr004500.1、Pbr029956.1、Pbr019663.1、Pbr026635.1这4 个基因和Pbr002372.1、Pbr019212.1、Pbr032231.1、Pbr040028.1这4个基因的内含子数则分别为3个和5个,且Pbr004500.1和Pbr032231.1的内含子跨度较大(图1,C)。除此之外,Pbr020079.1和Pbr038615.1结构相对复杂,各包含了6个和7个内含子(图1,C)。

图1 梨候选PbrNAC 的保守结构域(A)、保守基序(B)和基因结构(C)Fig.1 Conserved domain (A),motif (B) and gene structure (C) of PbrNAC members in pear
2.3 梨候选PbrNAC 基因的结构和系统进化树分析
为进一步了解候选PbrNAC功能,试验分析了其与拟南芥AtNAC成员之间的进化关系,发现该21 个PbrNAC成员主要分布于NAC2、TIP、ONAC022、NAM、ATAF、AtNAC3、NAP和SEU5这8个亚族,其中ONAC022和SEU5亚族中该成员最多,为3个;而NAP 和ANAC 亚族中最少,仅为1个(图2)。除此之外,梨PbrNAC成员还存在3个独立分支,包括Pbr020079.1、Pbr019663.1、Pbr019210.3和Pbr032231.1(图2)。

图2 梨候选PbrNAC 和拟南芥AtNAC成员间的系统进化分析The candidate PbrNAC and AtNAC members involved in abiotic stresses are marked with cyan stars and red rectangles,respectively.The outer ring lines and the letters above represent the gene members and names of the corresponding subfamily,respectively.Fig.2 Phylogenetic analysis of candidate PbrNACs in pear and AtNACs in Arabidopsis
2.4 梨候选PbrNAC 基因的组织表达特异性分析
试验分析了PbrNAC基因在梨根、茎、叶、花和果实这5 种组织中的表达,结果表明:大多数PbrNAC基因在不同组织中均有所表达(图3)。但各基因在不同组织中的表达也存在明显差异。整体而言,各基因在果实中的表达量较低,而在根中的表达量偏高(图3)。

图3 梨候选PbrNAC 基因在不同组织中的表达量热图 最大-最小归一化Values in the boxes indicate the max-min normalized relative expressions of genes,and ‘×’ in the boxes imply that the expressions of the genes are not detected in this tissue.Blue indicates a low gene expression,while red indicates a high gene expression.Fig.3 Heatmap of the expressions for the candidate PbrNAC genes in different tissues of pear (max-min normalized values)
2.5 梨候选PbrNAC 基因在梨缺铁黄化叶复绿过程中的表达分析
为验证FeSO4对C 内Fe2+含量的影响,以外源0.2% FeSO4对其进行处理,发现CN内Fe2+含量显著高于CC,而T3、T6、T9和T12内Fe2+含量均较CC显著升高,达到与CN无显著差异水平(图4)。

图4 不同处理梨叶内Fe2+含量CN,Cc.Normal and chlorotic leavesi n control group treated with distilled water,respectively,T3,T6,T9,and T12.Chlorotic leaves at 3rd,6th,9th and 12th days after 0.2%FeSO4 application,respectively.Different lowercases above the column indicate a significant difference at the level of P<0.05.The same as below.Fig.4 Fe2+ content in pear leaves with different treatments
为探究NAC转录因子在该复绿过程中的功能,分析了该21个候选PbrNAC基因在CN、CC、T3、T6、T9和T12叶内的相对表达量。结果表明,CC内Pbr022332.1、Pbr026949.2、Pbr007284.1、Pbr041562.1、Pbr004500.1、Pbr016205.1、Pbr016932.1、Pbr027956.1、Pbr029956.1、Pbr019663.1、Pbr040028.1、Pbr020079.1、Pbr007673.1、Pbr020642.1这14个基因的相对表达量显著高于CN,且 除Pbr022332.1、Pbr007284.1、Pbr019663.1这3个基因在T12的表达量与CC无显著差异外,其他各基因在T3、T6、T9和T12的表达量和这3个基因在T3、T6和T9的表达量均较CC显著下降(图5,A、B);而与之完全相反,Pbr032231.1、Pbr021393.1、Pbr026635.1、Pbr038615.1、Pbr019210.3、Pbr019212.1、Pbr002372.1这7个基因在CC中的表达量则显著低于CN,而FeSO4处理可显著诱导该基因的表达并使其水平显著高于CC。其中,Pbr032231.1、Pbr026635.1、Pbr038615.1、Pbr019210.3、Pbr019212.1这5个基因在T9或T12的表达量与CN无显著差异(图5,C)。
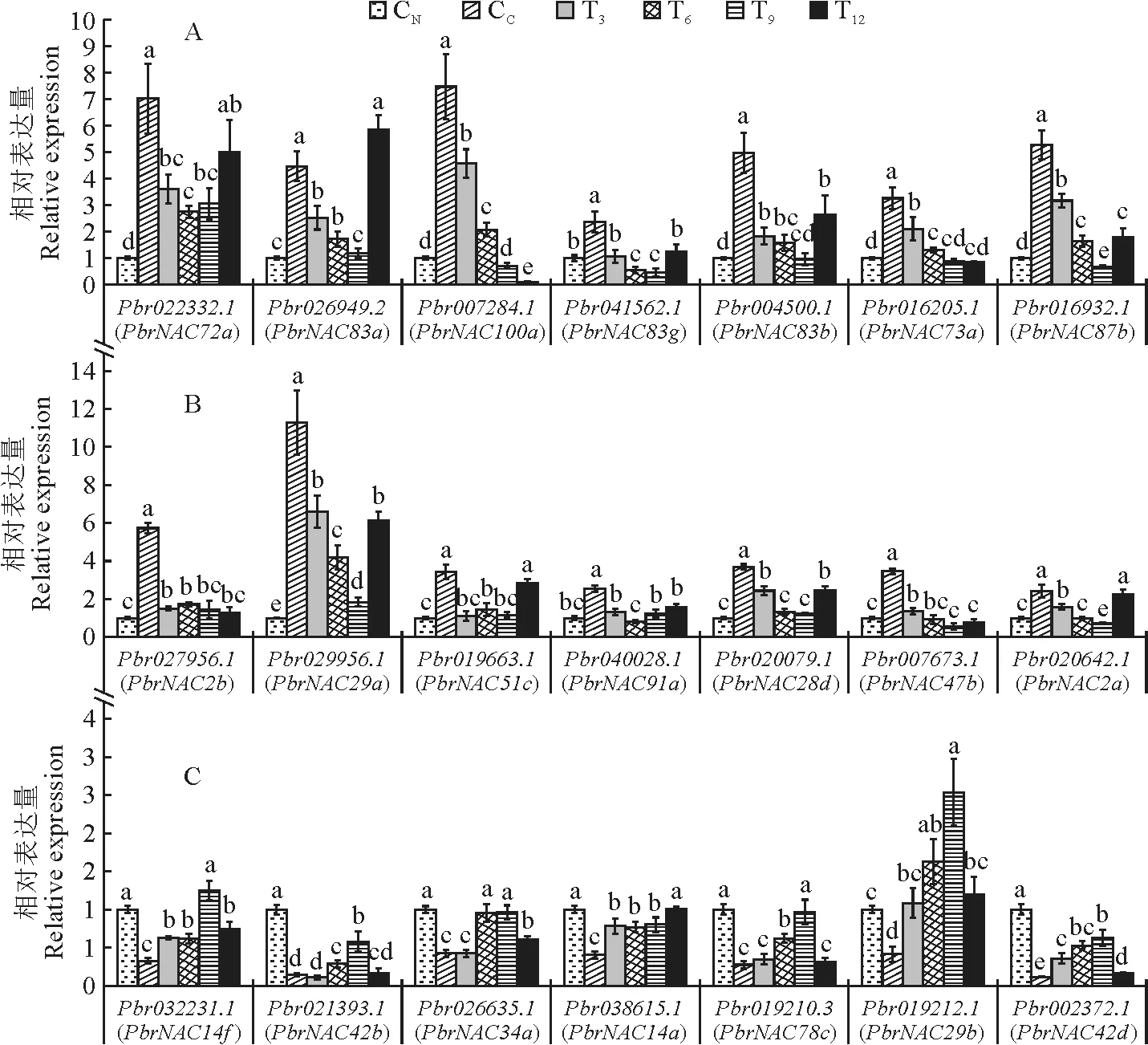
图5 不同处理梨叶内候选PbrNAC 基因的表达量Fig.5 Expression pattern of the candidate PbrNAC in pear leaves with different treatments
结合系统进化关系可知,同处于SEU5亚族的Pbr026949.2、Pbr041562.1、Pbr004500.1这3个基因在复绿过程中的表达趋势基本一致,与之趋势类似的还包括ONAC022 亚族的Pbr021393.1、Pbr026635.1和Pbr002372.1(图5,A、B)。但同处于TIP亚族的Pbr040028.1和Pbr038615.1以及同处于NAC2亚族的Pbr019212.1和Pbr029956.1在响应该复绿过程中,表达模式则截然相反(图5)。
2.6 梨候选PbrNAC 基因与复绿过程中Fe2+积累的相关性分析
为进一步探讨PbrNAC与梨缺铁黄化叶复绿的关系,试验分析不同处理条件下的各叶样内Fe2+含量与候选PbrNAC基因表达量之间的的相关性,并根据最终分析结果,将这21个候选PbrNAC基因划分为Ⅰ、Ⅱ、Ⅲ三大类(图6)。其中仅有第Ⅰ类中的Pbr007284.1、Pbr016205.1和Pbr007673.1这3个基因的表达量与各叶样内Fe2+含量呈显著负相关(图6)。

图6 不同处理梨叶内候选PbrNAC 基因表达量与Fe2+含量的相关性分析A.The numbers in the box mean the correlation coefficient between the two elements,green and red means a negative and positive correlation,respectively,and ‘*’ indicates a significant differences at the level of P<0.05;B.Boxes in yellow(Ⅰ) and green background (Ⅱ) indicate gene sets that are significantly negatively and positively correlated with the previous clustered gene sets,respectively.and boxes in gray background (Ⅲ) only represent gene sets that are significantly correlated with the previous clustered gene sets,the same gene is highlighted in the same color.Fig.6 Correlation analysis between the expression of the candidate PbrNAC genes and Fe2+ content in pear with different treatments
虽然第Ⅱ、Ⅲ类中各PbrNAC基因的表达与各叶样内Fe2+积累无显著关联(图6),但第Ⅱ类中各基因的表达均与第Ⅰ类中3个基因的表达显著相关,如Pbr016932.1、Pbr027956.1、Pbr029956.1等;而第Ⅲ类中各基因的表达量又均与第Ⅱ类中多个基因的表达量存在显著关联性,如Pbr020642.1、Pbr022332.1等(图6)。
2.7 梨关键PbrNAC 基因在正常梨树根系和黄化梨树根系中的表达分析
为进一步分析PbrNAC与梨树黄化复绿的关系,探讨PbrNAC在梨地上部与地下部的表达是否存在一定关联,试验选择10个与梨叶内Fe2+积累相关的基因,并鉴定出其在嫁接砧木——‘杜梨’中的同源基因,进而分析其在正常梨树根系(NR)和黄化梨树根系中(CR)的表达,结果显示:杜梨内,3个与叶内Fe2+积累显著负相关的Pbr007284.1、Pbr016205.1和Pbr007673.1的同源基因在CR的表达量显著高于NR(图7),且CC叶内显著高表达的Pbr027956.1和Pbr029956.1的同源基因在CR内的表达量也较NR 显著升高;而CC叶内显著低表达的Pbr026635.1同源基因在CR 内的表达量则较NR 显著降低(图7)。但CC叶内显著高表达的Pbr004500.1和Pbr020079.1的同源基因在杜梨CR 和NR 内的表达量并无显著变化(图7)。

图7 正常与黄化梨树根系内PbeNAC 基因相对表达量NR.Roots of normal pear trees,CR.Roots of Fe-deficiency chlorotic pear trees.The genes in the figures are associated with the accession numbers of ‘Duli’ and ‘Dangshansuli’,respectively.‘*’ indicates a significant difference at the level of P<0.05.Fig.7 The relative expression levels of PbeNAC genes in normal and chlorotic pear root
3 讨论
NAC基因作为植物中存在最广泛的重要转录因子之一,参与植物生长发育,病原菌抵御以及干旱、高盐和冷胁迫等在内的非生物胁迫等多种生物过程[27-29]。虽然近年来已逐渐在拟南芥[20]、水稻[21]和苹果[19]中初步研究了NAC在其缺铁胁迫中的作用,但其在梨树缺铁胁迫中的功能鲜见报道。该试验共鉴定到21个在梨正常叶和黄化叶内显著差异表达的PbrNAC基因,共涉及8个亚族,其中TIP、ATAF、AtNAC3、NAP这4个亚族中分布着多个已被报道的与植物非生物胁迫响应相关的AtNAC成员[30-32],而基因聚类分析是了解未知功能基因的重要途径和依据[33],其中同处一分支的基因可能参与调控相同的生物过程,如番茄中bHLH Ⅰb类缺铁胁迫正调控因子SlbHLH068[34]和苹果中bHLH Ⅳc类抗缺铁因子MdbHLH104[35]。因此,PbrNAC基因可能与梨树非生物胁迫响应相关,如缺铁胁迫等。而与之相符,多数PbrNAC基因也均响应了FeSO4处理所诱导的缺铁黄化叶复绿,并呈现一定的变化规律,说明该基因可能与苹果MdNAC1[19]、拟南芥AtNAC5[20]、和水稻IDEF2[21]功能类似,参与调控了梨缺铁胁迫应答。植物叶片黄化是其质外体高pH 所引起的铁分布不均和其内低三价铁还原酶活所致[36]。因此,虽然本研究未分析该复绿过程中叶内总铁含量的变化,但鉴于已有研究[36],以及Fe-SO4处理后黄化叶内显著提升的Fe2+水平,推测PbrNAC可能与叶内三价铁的还原和再分配相关。
研究表明,该21个候选PbrNAC基因中的多个基因的内含子数整体偏少,而内含子的剪切、修饰需要的时间往往大于其转录时间,相对而言,基因的内含子数量越多,其同一时间内转录生成蛋白质的量就越少,发挥的功能也就越弱[37]。因此,这些内含子相对较少的PbrNAC基因可能在梨树遭遇缺铁胁迫在内的非生物胁迫时被快速、强烈地诱导或抑制,从而迫使梨树更迅速做出反应;同时,试验也发现多个内含子存在于Pbr020079.1和Pbr038615.1基因中,而多个内含子的存在会增大可变剪接和外显子重排的发生频率,从而塑造基因的多种形式,丰度其功能[37]。因此,相较其他PbrNAC基因而言,Pbr020079.1和Pbr038615.1的功能可能更加多样化。本试验发现同处SEU5和ONAC022亚族的PbrNAC基因在FeSO4处理前后的表达模式类似,而同处TIP和NAC2亚族的PbrNAC基因表达模式相反,说明同一亚族的PbrNAC基因具有功能多样性,其可能协同或拮抗调控着同一生物反应,如缺铁黄化叶的复绿。与之相符,试验还发现部分同处一个亚族的PbrNAC基因在地下部根系的表达和地上部叶内的表达模式相一致或相反,再次说明了PbrNAC基因的功能冗杂性和多样性。
NAC因子可直接作用于下游基因,或以同源二聚体的形式参与由另一NAC 因子所介导的生物功能[38]。如水稻中ONAC020和ONAC023可通过与ONAC60因子互作而影响ONAC60 活性,从而参与调控水稻的种子发育[39];与此同时,该蛋白互作也可能会造成NAC 蛋白定位的改变,从而影响其活性。如非生物活性的细胞质定位PYE 因子可在bHLH104/105/115等因子的作用下而向细胞核移动,从而使其转变成具有生物活性的核定位PYE因子[13]。因此,NAC-NAC 复合物的形成也是NAC因子行使调控功能的重要途径。本试验相关性分析结果表明,Pbr007284.1、Pbr016205.1和Pbr007673.1这3个基因在调控‘砀山酥梨’缺铁黄化叶内Fe2+积累中可能直接起负调控作用,其高表达可能直接抑制梨树铁代谢相关生物过程中的基因表达,从而造成叶片缺铁黄化,而外源FeSO4处理则可能以解除该抑制作用的方式,从而造成叶内Fe2+的积累;另一方面,虽然多数PbrNAC基因在不同处理条件下叶内的表达与黄化复绿叶内的Fe2+积累无显著关联,但其与这3个与黄化复绿叶内的Fe2+积累显著相关的PbrNAC基因的表达呈显著相关,说明该类PbrNAC成员可能以Pbr007284.1、Pbr016205.1和Pbr007673.1所调控的途径间接参与了梨树缺铁黄化叶的复绿,如通过与这3位成员的互作造成后者转录活性抑制/促进,从而间接参与黄化叶复绿过程的调控;同时,这种互作可能会造成各自在细胞核-细胞质等组织中的移动,从而影响其活性,间接影响着黄化叶片的复绿。除此之外,试验还利用qRT-PCR 分析了21 个PbrNAC基因在‘砀山酥梨’不同组织(根、茎、叶、花、盛花后75 d的果实)的表达模式,发现在各组织中均可不同程度地检测到绝大多数PbrNAC的表达,但存在一定差异,说明该成员不同程度地参与梨树的营养生长和生殖生长,且多数PbrNAC具有根表达的倾向性。根系是植物最先感知缺铁等非生物胁迫的重要组织,可通过分泌相关化学物质应对缺铁等不良环境,并可向上传递胁迫信号,使植株于第一时间做出反应来适应环境改变[40]。因此,PbrNAC也可能通过调控梨树的根系生理状态影响其化学物质的分泌以及信号分子的传递等,从而参与缺铁等非生物胁迫应答。
4 结论
研究共得到21个可响应‘砀山酥梨’缺铁黄化的PbrNAC基因,说明其与叶内Fe2+积累的关系,并初步明确了Pbr007284.1、Pbr016205.1和Pbr007673.1这3个基因和其他PbrNAC基因在该过程的负调控和间接调控作用,但其功能及具体作用机制仍有待进一步研究。
