杨树KT、HAK、KUP基因家族鉴定及钾肥处理对杨树生长的影响1)
2024-01-13安伟张玲玲
安伟 张玲玲
(西北农林科技大学,杨凌,712100)
钾元素是植物生长发育过程中必不可少的矿质元素之一,在植物生长发育过程起着重大作用。钾参与植物体内许多重要的生理生化过程,如促进植物基础生理代谢、调节气孔运动,促进光合作用、维持阴阳离子平衡、调节渗透压等[1],对植物整个生命周期至关重要。此外,钾元素在植物盐胁迫适应、耐干旱胁迫、有机酸物质长距离运输、氮素利用、糖分累积方面都发挥了重要作用[2-3]。钾缺乏则会导致植物老叶加速黄化,根系短小且易倒伏[4]。植物吸收钾离子主要依靠钾转运蛋白和钾离子通道。目前研究表明,参与植物体内K+吸收及转运的蛋白或通道共有5类:KT、HAK、KUP家族转运蛋白、HKT家族转运蛋白、CPAs家族转运蛋白、Shaker通道和TPK通道[5]。其中,KT、HAK、KUP家族是一类数量众多的基因家族,广泛分布于细菌、真菌和植物中[6]。目前从拟南芥(Arabidopsisthaliana)鉴定出13个KT、HAK、KUP相关家族基因[7],水稻(Oryzasativa)中27个基因[8],紫柳(Salixpurpurea)中22个基因[9],玉米(Zeamays)27个基因[10],番茄(Solanumlycopersicum)19个基因[11],茶树(Camelliasinensis)21个[12],钾转运蛋白在不同物种中有较为广泛的分布,但也存在较大的功能分异。
KT、HAK、KUP家族分为5个亚族,亚族Ⅰ主要包括拟南芥AtHAK5、水稻OsHAK5等;亚族Ⅱ主要包括拟南芥AtKUP1、AtKUP2等;亚族Ⅲ主要包括拟南芥AtKUP9、AtKUP10等;亚族Ⅳ主要包括水稻OsHAK4和OsHAK17;亚族Ⅴ主要包括AtKUP5、AtKUP7等[13]。亚族Ⅱ和亚族Ⅲ的成员在双子叶和单子叶植物中的分布相似,表现出很强的保守性。亚族Ⅰ和Ⅳ的成员则与之相反,在多种双子叶植物如拟南芥(Arabidopsisthaliana)、葡萄(Vitisvinifera)、蒺藜苜蓿(Medicagotruncatula)和单子叶植物如水稻、玉米和短柄草(Brachypodiumsylvaticum)中都有所体现[14-16]。KT、HAK、KUP转运体家族成员定位在植物不同细胞器的膜上,如质膜、液泡膜和类囊体膜[17-18]。同一簇的家族成员细胞定位也并不相同,因而可能发挥不同的细胞生物学功能。如簇Ⅱ成员AtKUP4定位于液泡膜,OsHAK2定位于细胞质膜,而OsHAK10定位于液泡膜等。在盐胁迫条件下,水稻中的高亲和性K+转运体OsHAK1、OsHAK5和OsHAK21在转运K+方面表现出不同的能力。这种差异不仅与它们所处的细胞位置有关,还与它们在不同组织中的表达特异性以及根细胞膜电位的变化相关。目前K+转运蛋白功能研究主要集中在拟南芥、水稻中,杨树中的研究还有待进一步深入。
杨树分布广泛,速生、抗逆性强,是我国最为重要的用材树种,西北杨2号(Populusalba×P.tomentosa‘Xibeiyang 2’)为西北农林科技大学新培育的杨树速生优质新品种,可广泛应用于北方杨树造林。在杨树优质大径材培育中钾元素的缺乏是影响其速生丰产的关键因素之一。KT、HAK、KUP家族是植物吸收和转运钾的关键蛋白家族,影响植物生长发育和抗逆能力,对杨树产量性状形成起到重要的调控作用。基于此,本研究以毛果杨的基因组数据库为基础,结合生物信息学方法鉴定杨树KT、HAK、KUP基因,同时对该家族成员开展理化性质分析,构建系统进化树、染色体定位,开展基因结构、保守基序分析;结合实时荧光定量PCR方法分析杨树KT、HAK、KUP基因在不同钾肥(KCl)浓度处理下表达情况。研究KT、HAK、KUP基因家族在杨树中的分类与表达不仅可以帮助我们更好地了解这些基因在杨树生长发育调控中的功能和作用,而且可以为今后杨树改良和高效钾吸收的杨树品种筛选鉴定提供理论基础。
1 材料与方法
试验所用杨树材料为西北农林科技大学渭河实验站西北杨2号无性系。于西北农林科技大学科研温室利用水培法培养1年生扦插苗,选取长势均匀一致的扦插苗分成4组,分别使用含有0.1、0.5、1.0、3.0 mmol/L KCl的Hoagland溶液浇灌,每4 d更换1次营养液,45 d后测定各处理杨树株高。
杨树KT、HAK、KUP基因家族的全基因组鉴定。Phytozome(https://phytozome-next.jgi.doe.gov/)在线数据库下载毛果杨基因组fa文件,注释gff文件及蛋白质protein文件,利用TBlools工具提取杨树基因组的CDS序列,参数设置为Parent。从Pfam(http://pfam.xfam.org/)数据库下载HAK蛋白特征结构域K-Trans(PF02705)的隐马尔可夫模型[19],利用HMMER软件在比对的假阳性预期值E<1×10-5条件下进行杨树KT、HAK、KUP基因家族成员初步筛选。将筛选得到的数据在CD-HIT中进一步处理。去除重复成员。最后使用CCD(https://www.ncbi.nlm.nih.gov/cdd)进行蛋白结构域验证。
杨树KT、HAK、KUP基因家族理化性质。使用ExPASy在线网站(http://www.expasy.org)查找获得杨树KT、HAK、KUP基因的相对分子质量、氨基酸数量、不稳定系数等理化性质。通过WoLF PSORT网站(https://wolfpsort.hgc.jp/)对杨树KT、HAK、KUP基因进行亚细胞定位预测。
杨树KT、HAK、KUP基因系统进化树。在拟南芥数据库(https://www.arabidopsis.org/)获取KT、HAK、KUP基因家族成员信息。利用ClustalX2对杨树和拟南芥KT、HAK、KUP蛋白进行氨基酸多序列比对。使用MEGA11软件运用比邻法获得最优进化模型,构建系统发育进化树,默认参数为1 000次Bootstrap重复。利用ITOL(https://itol.embl.de/)对进化树进行美化。
杨树KT、HAK、KUP基因家族染色体定位及共线性。利用TBtools工具对鉴定筛选出的杨树KT、HAK、KUP家族基因进行染色体定位,并根据各基因在染色体上位置顺序的比较结果,对预测的KT、HAK、KUP基因进行命名。利用多重共线性扫描工具包(MCseanx)分析杨树与簸箕柳之间共线性关系。
杨树KT、HAK、KUP基因家族基因结构与保守基序。采用在线软件GSDS(http://gsds.cbi.pku.edu.cn/)、MEME(http://meme-suite.org/tools/meme)分别分析该家族成员基因结构和编码蛋白保守基序[20](基数参数为15,其余为默认),并用TBtools进行展示。
杨树KT、HAK、KUP基因家族顺式作用元件。提取鉴定筛选出的杨树KT、HAK、KUP基因上游2 000 bp的CDS序列提交至PlantCARE在线网站进行顺式元件作用分析[21]。
1.1 光响应曲线测定
在杨树不同K+浓度处理15 d时,于09:00-12:00,使用便携式光合仪LI-6400XT(LI-COR,美国)采用自动可调人工光源,分别测定自然CO2摩尔分数(380 μmol·mol-1)下,光合有效辐射为0、20、50、100、200、400、600、800、1 000、1 200、1 400、1 600、1 800 μmol/(m2·s)时杨树叶的光强-光合响应曲线。利用光合响应曲线分析计算光饱和时最大净光合速率(Pnmax)、暗呼吸速率(Rd)。
1.2 根叶RNA提取与反转录
采集不同K+浓度处理后1、5、15 d时的叶、根样品,采用Omega RNA提取试剂盒提取根叶的RNA。采用EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒反转录RNA获得cDNA用于qRT-PCR。
1.3 荧光定量分析
使用软件Primer Primer 5对杨树PTHAKs基因进行cDNA特异性引物设计,设计扩增产物长度150~250 bp,退火温度Tm值为55 ℃,引物信息如表1。以Actin为内参基因,2×Sybr Green qPCR Mix荧光定量试剂进行荧光定量试验。qRT-PCR反应体系25 μL,包括2×Sybr Green qPCR Mix12.5 μL、cDNA模板1.0 μL、正反向引物各0.5 μL、双蒸水10.5 μL。PCR程序:94 ℃预变性2 min、90 ℃变性20 s、55 ℃退火20 s、72 ℃延伸30 s、40个循环。使用2-ΔΔCt法[22]计算PTHAKs相对表达量。
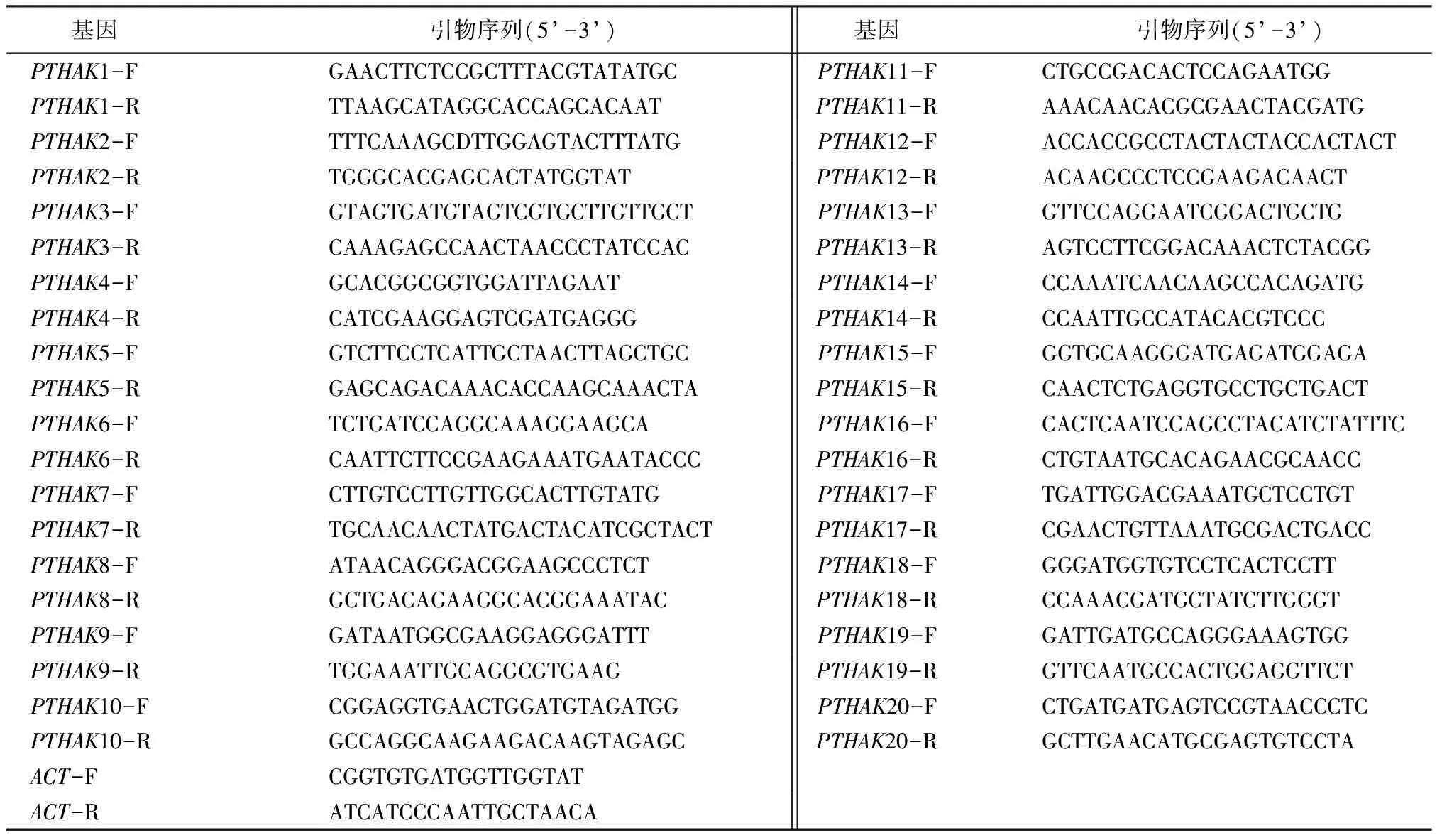
表1 PTHAKs实时荧光定量引物信息
2 结果与分析
2.1 杨树KT、HAK、KUP基因家族
通过对毛果杨基因组的筛选与鉴定,共获得20个PTHAK家族成员,根据基因在染色体上的位置信息依次命名为PTHAK1~PTHAK20。蛋白基本理化性质分析结果表明(表2):PTHAKs长度介于610~860个氨基酸,蛋白分子质量介于67 065.88~95 442.98 u,平均分子质量为86 424.98 u。等电点介于5.30~9.16,75%成员的等电点处于碱性区间,表明大部分PTHAK蛋白含碱性氨基酸数量多。不稳定系数介于32.59~45.49,其中14个PTHAKs成员为稳定性蛋白,6个成员为不稳定性蛋白。所有PTHAKs蛋白成员都属于疏水性蛋白。根据亚细胞定位预测结果显示,PTHAKs主要位于细胞质膜上,这和PTHAKs负责钾元素转运的作用密切相关。
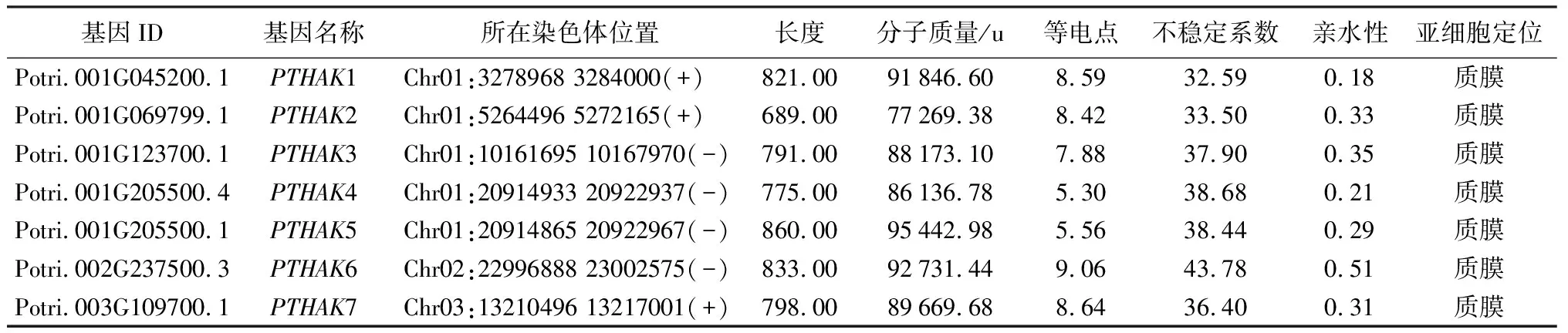
表2 杨树PTHAKs成员理化性质
2.2 杨树KT、HAK、KUP蛋白序列系统进化树
将13个拟南芥AtHAKs、20个杨树PTHAKs成员蛋白序列进行多重序列比对和系统进化树构建。结果(图1)显示杨树20个HAKs家族成员被分为5个亚家族,其中PTHAK1、PTHAK2、PTHAK18属于第Ⅰ家族,PTHAK17、PTHAK19、PTHAK20、PTHAK15分属于第Ⅱ亚家族,PTHAK8、PTHAK3、PTHAK7分属第Ⅲ亚家族,PTHAK12、PTHAK10、PTHAK11等6个成员分属第Ⅳ亚家族,其余4个成员分属第Ⅴ亚族。
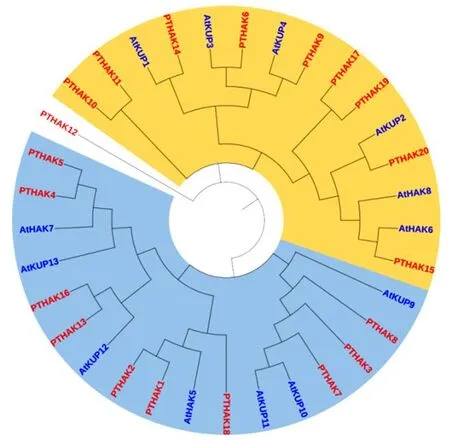
图1 拟南芥和杨树KT、HAK、KUP基因家族系统进化树
2.3 杨树KT、HAK、KUP基因家族染色体定位及共线性
杨树PTHAKs基因家族成员的染色体定位结果(图2)表明:20个PTHAKs基因成员不均匀分布在1、2、3、5号等10条毛果杨染色体上。其中:5号染色体上分布最多,有5个成员;3号染色体有4个成员;8、10号染色体上均有2个PTHAKs成员;2、5、9、12、14、15、19号染色体均只有1个PTHAK成员。利用簸箕柳和杨树进一步分析种间共线性关系(图3),杨树与簸箕柳构成20对共线性关系,分别位于1、2、3、8、9、10、12、14、15、19号染色体上。

图2 杨树PTHAKs基因家族染色体分布
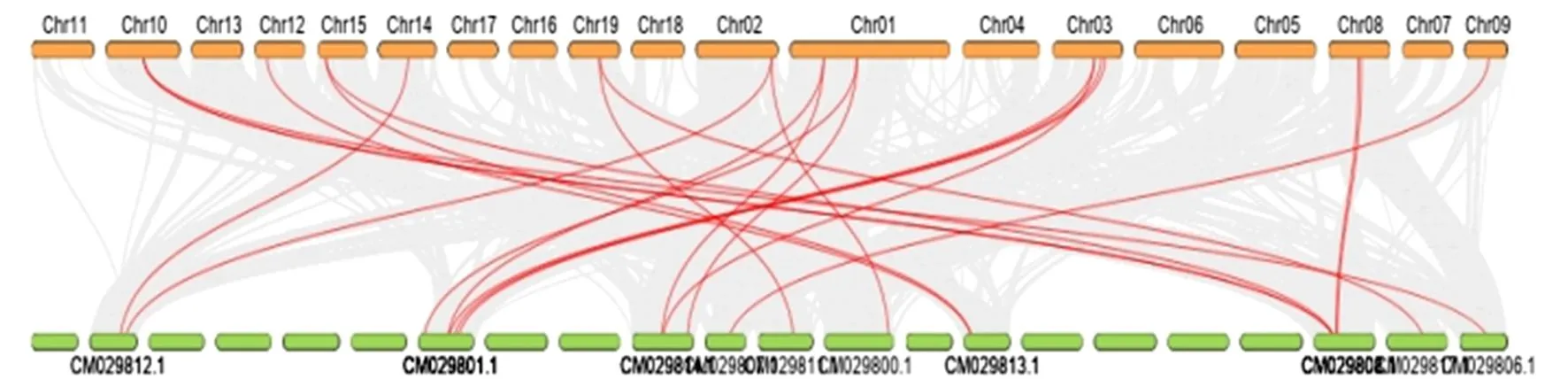
灰色区域是毛果杨与簸箕柳基因组间共线性,红色区域代表HAKs基因位置。
2.4 杨树KT、HAK、KUP基因家族基因结构与保守基序
根据基因结构分析(图4):PTHAKs外显子数7~10个不等,以8个居多。其中第Ⅳ、Ⅱ亚家族PTHAK11和PTHAK19具有9个外显子,PTHAK15和PTHAK20具有7个外显子;第Ⅴ亚家族PTHAK5具有10个外显子,PTHAK4、PTHAK16、PTHAK13具有9个外显子。
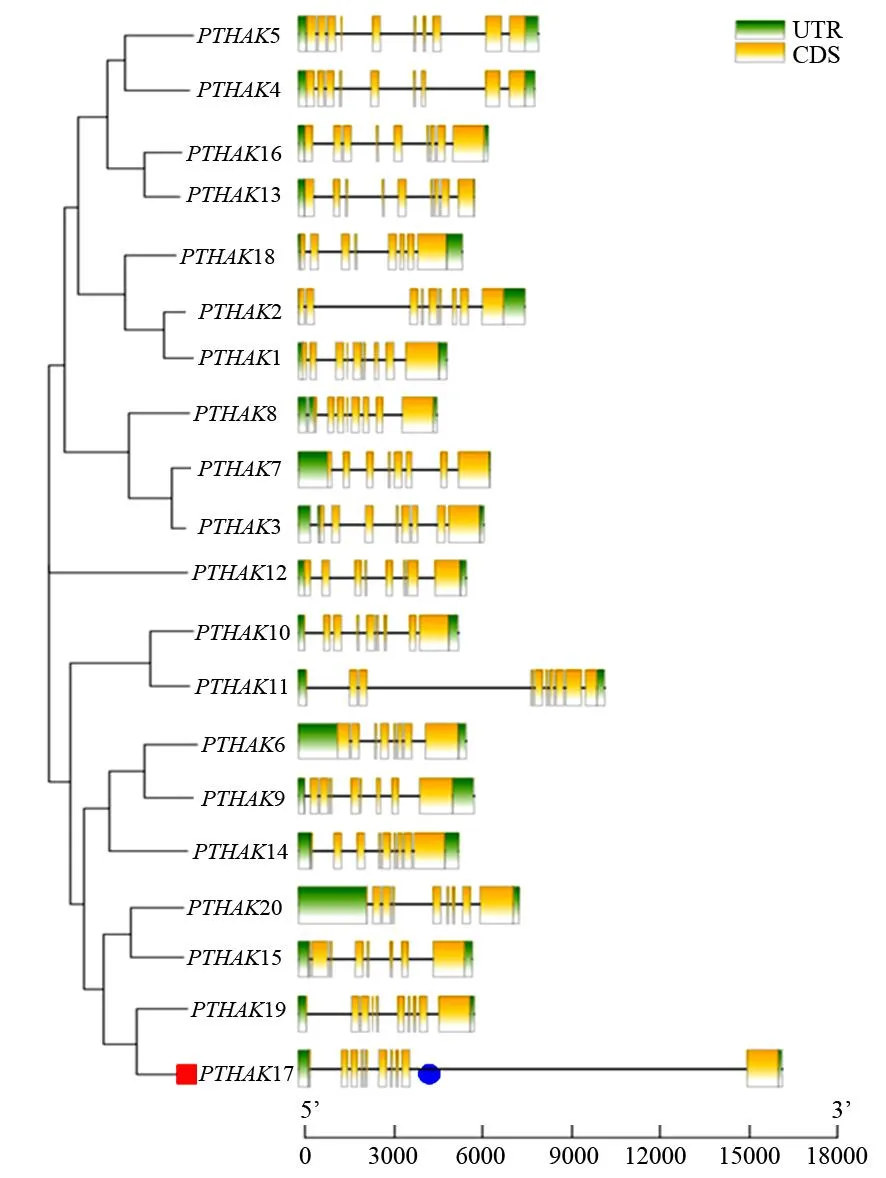
图4 PTHAKs基因结构
使用MEME对PTHAKs家族保守基序分析(图5),获得15种基序(motif),命名为motif1~motif15。其中PTHAK12无motif14、motif15,PTHAK11无motif14,PTHAK19无motif13;PTHAK4无motif13、motif1,PTHAK13无motif14、motif7、motif15、motif12、motif11,PTHAK2无motif12、motif11,其余成员均有15种基序。
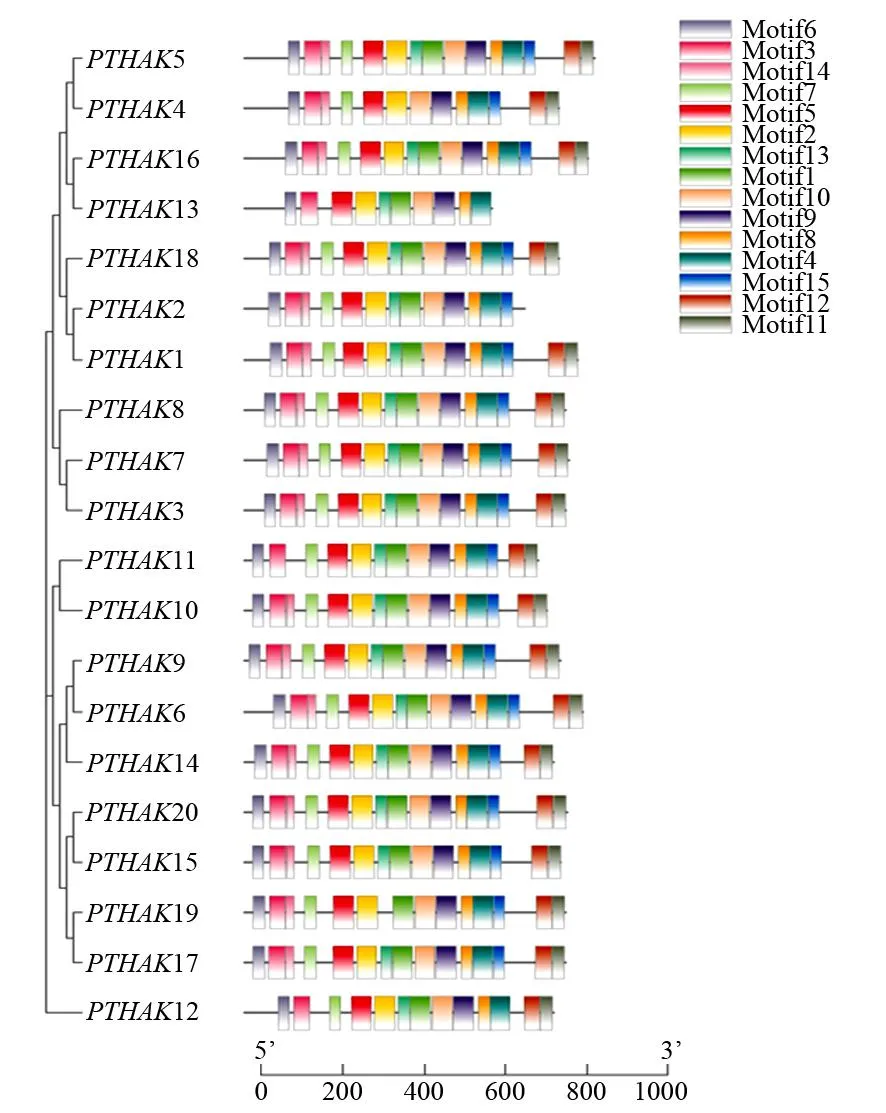
图5 PTHAKs保守基序
2.5 杨树KT、HAK、KUP基因家族顺式作用元件
获取杨树KT、HAK、KUP基因家族启动子上游2 000 bp区域,分析启动子区域发现杨树KT、HAK、KUP基因家族均存在TATA-box、CAAT-box、厌氧诱导、光信号响应的顺式元件。此外,80%的成员包含赤霉素响应元件,70%的成员有脱落酸响应元件,75%的成员包含干旱诱导的MYB结合元件,45%的成员包含生长素响应等元件(图6)。
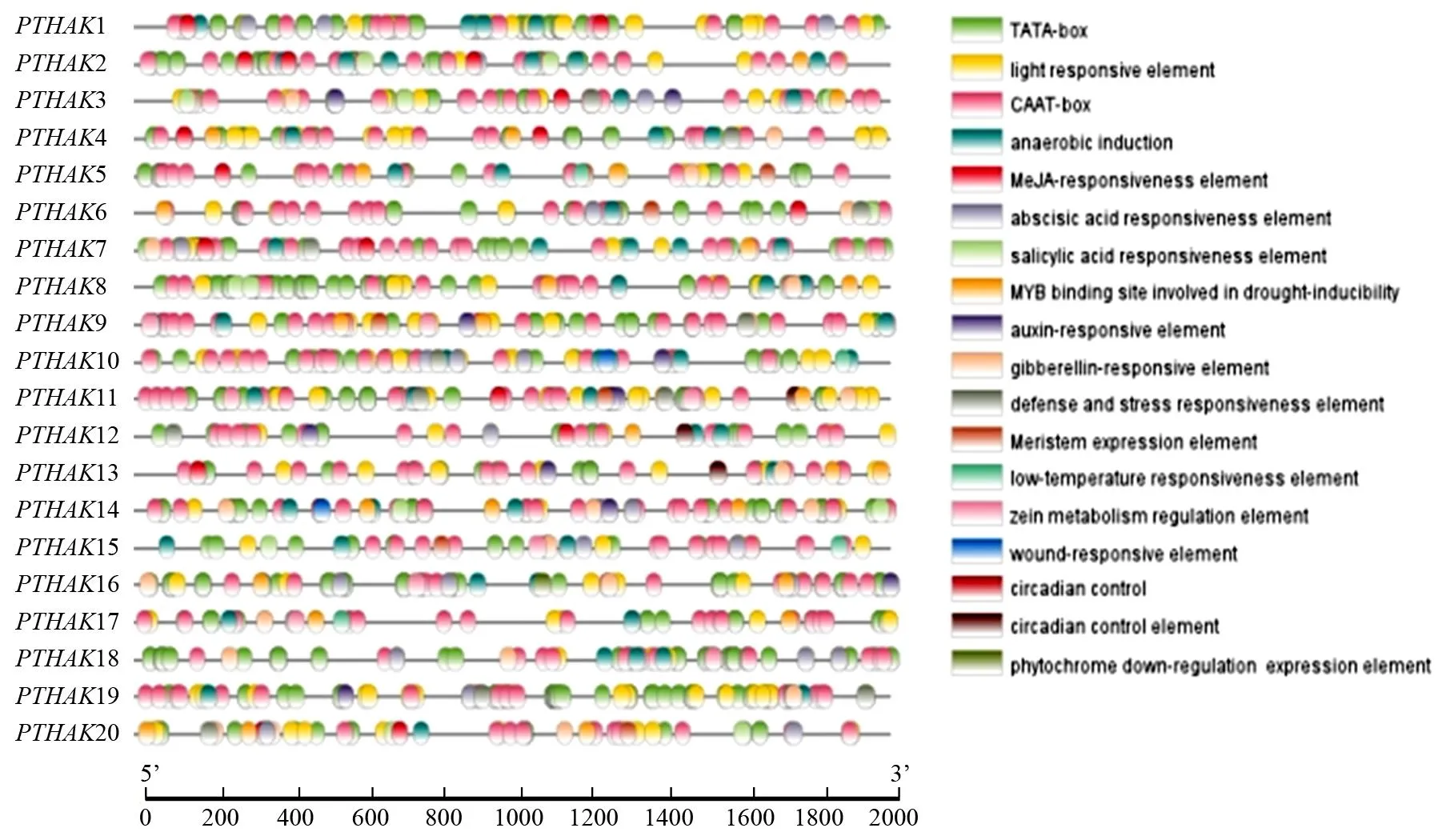
图6 PTHAKs成员启动子区顺式元件种类
2.6 杨树植株高生长测定
为了探究K+对杨树生长的影响,使用不同钾素浓度处理西北杨2号无性系,测定植株高生长状况。表3中记录了在0.1、0.5、1.0、3.0 mmol/L KCl处理下杨树的净生长数据,4个浓度钾素处理下树高生长斜率分别是2.04、2.82、3.03、2.91,表明K+是影响杨树生长的限制因素。缺钾(0.1 mmol/L KCl)条件下,杨树的生长显著低于正常和高钾处理,表明钾素合理施用能够有效提高杨树的高生长。

表3 不同钾素浓度时杨树净生长值
2.7 光响应曲线
由图7可知4个不同钾素浓度处理下,净光合速率随光合有效辐射增加的变化趋势是相似的,在光合有效辐射(RPA)为0~1 000 μmol/(m2·s),净光合速率(Pn)随RPA增加而快速增加,在1 000 μmol/(m2·s)以上,净光合速率增长趋于平缓。1.0和3.0 mmol/L KCl处理下,净光合速率最大值高于其他处理,说明不同K+浓度处理对植物的光合作用有重大影响。

图7 杨树4种钾浓度处理光响应特征
2.8 KT、HAK、KUP基因相对表达
通过对杨树KT、HAK、KUP基因家族表达模式分析(图8)发现,在叶片中PTHAK3、PTHAK15在所有钾浓度处理中都有相对较高的表达丰度。PTHAK10、PTHAK13、PTHAK19在低钾(0.1、0.5 mmol/L KCl)处理下出现相对较高表达情况。PTHAK5、PTHAK6、PTHAK7则是在高浓度钾(1.0、3.0 mmol/L KCl)处理中有相对较高丰度表达。在根系组织中PTHAK3、PTHAK6、PTHAK15在所有钾浓度中均有较高的表达丰度。PTHAK3、PTHAK5、PTHAK7、PTHAK13、PTHAK19等成员在低钾胁迫下相对表达量最高。PTHAK6、PTHAK5、PTHAK7、PTHAK12、PTHAK15则是在高浓度钾(1.0、3.0 mmol/L KCl)处理中存在较高丰度表达。以上结果表明不同PTHAKs家族成员在叶片和根系中的响应存在表达特异性。

图8 杨树KT、HAK、KUP家族成员不同钾素浓度处理下表达模式
3 讨论与结论
杨树生长速度快,材积产出高,抗逆性较强是我国重要的防护林和工业用材林。培育大径级杨树是目前我国杨树生产的重要目标。钾元素是植物生长发育过程中必不可少的矿质元素,能够促进植物基础生理代谢,促进光合作用,增强植物逆境抗性等,对杨树大径级材生产起着关键作用。开展杨树钾响应以及钾转运调控研究对今后杨树开展丰产栽培、杨树遗传改良具有重要意义。本研究从毛果杨全基因组数据为基础,利用生物信息学方法对杨树KT、HAK、KUP家族进行了全基因组学鉴定与生物信息学分析,同时以国审新品种西北杨2号为材料分析了杨树对钾素的生长响应。
研究在毛果杨全基因组中鉴定出来20个KT、HAK、KUP家族成员。预测分析其理化性质发现,KT、HAK、KUP基因蛋白序列长度在610~860个氨基酸,平均蛋白序列长度为775个氨基酸;等电点在5.30~9.16,75%成员都属于碱性蛋白;亲水性显示该家族成员都为疏水性蛋白;预测亚细胞定位集中在细胞质膜上,研究结果印证家族基因钾转运蛋白基本特征。构建拟南芥和杨树KT、HAK、KUP基因家族的系统进化树,通过分析可知和拟南芥不同,杨树KT、HAK、KUP基因家族可分为5个亚家族,这与多数HAK家族被划分为5个系统进化簇类似。基因结构及motif的分析表明,KT、HAK、KUP基因进化过程相对保守,几乎所有成员都包含motif1-motif15,这与前人的研究结果一致[23]。顺式作用元件分析结果显示,KT、HAK、KUP基因家族成员含有许多与激素、逆境胁迫的响应元件,表明其还可能受到环境胁迫以及植物激素的调控与响应[24]。
设置了0.1、0.5、1.0、3.0 mmol/L 4个钾肥(KCl)施用浓度处理来分析杨树的生长情况。在对杨树扦插苗净生长测定分析发现,低钾浓度处理显著抑制了杨树无性苗的高生长,说明钾元素直接影响杨树的高生长;同时对不同钾素浓度处理的杨树进行了光响应测定,分析可知在正常(1.0 mmol/L)和高钾(3.0 mmol/L)处理下,净光合速率最大值均高于低钾处理,说明不同K+浓度处理对杨树的光合作用有重大影响,而提高光合速率是实现杨树大径材培育的重要方式。
使用实时荧光定量技术检测部分KT、HAK、KUP家族基因在杨树根和叶中的表达情况。研究表明在低钾胁迫下PTHAK10、PTHAK13、PTHAK15等成员在叶片中有较高表达;PTHAK5、PTHAK6、PTHAK7等成员在根系中有较高表达。在拟南芥的研究发现,缺钾可以诱导AtHAK5的表达,在钾离子浓度小于50 μmol·L-1时AtHAK5突变体种子萌发缓慢,根生长受抑制,钾离子吸收能力降低[25]。另外在拟南芥中发现AtKUP4在根尖表达,通过改变生长素运输来影响根尖的生长[26]。同样在水稻中OsHAK5受缺钾和干旱胁迫诱导[27]。马铃薯在低钾胁迫下,多数HAK基因表达量呈上调[28],表明马铃薯HAK基因具有低钾响应特征,可能和低钾环境下钾素高效转运相关。杨树中多个低钾高表达基因可能在杨树低钾条件下钾素的高效转运相关。另外,本研究中使用不同浓度KCl溶液进行钾元素含量的控制,不能忽略的是随着K+浓度的改变,Cl-浓度也随之变化。氯作为植物生长必须的营养元素,Cl-也是细胞维持渗透压的主要离子,对细胞延长,维持细胞液缓冲体系、水分平衡、提高植物抗旱性具有重要意义[29],而具体Cl-的作用还有待今后深入探讨。
本研究在毛果杨全基因组中鉴定出20个KT、HAK、KUP家族成员。随后对家族成员进行理化性质与亚细胞定位预测分析,构建系统进化树,开展了顺式作用元件分析,最后对4个K+浓度处理杨树扦插苗的净生长与组织基因表达进行分析。研究为更好地了解杨树KT、HAK、KUP基因家族的功能提供了前期基础,同时也为研究和选育高效钾吸收的杨树品种提供了参考信息。
