模型辅助AN-HEA自由基共聚过程的调控:动力学、组成漂移及其抑制①
2024-01-12王小波胡笑晨郑东升黄志萍
李 娓,王小波,胡笑晨,郑东升,黄志萍,姚 俊*
(1.湖北航天化学新材料科技有限公司,襄阳 441057;2.湖北航天化学技术研究所,襄阳 441003)
0 引言
硝酸酯增塑的聚醚推进剂(NEPE)具有能量高、力学性能好等优点[1-2]。作为改善NEPE推进剂力学性能的一种关键组分,中性聚合物键合剂(Neutral Polymer Bonding Agent,NPBA)中强极性的氰基可很好地吸附在硝铵填料表面,羟基通过固化反应与粘合剂连接,发挥其优良的键合效果;典型的NPBA是以丙烯腈(AN)、丙烯酸羟乙酯(HEA)为单体,通过自由基无规共聚制备的[3-12]。但因为AN和HEA两种单体反应活性和竞聚率r1、r2相差较大,采用传统的一次投料合成方法会导致得到的NPBA组成不均匀,从而无法研究NPBA的构效关系,也影响了NPBA的使用效果[13-14]。
从自由基共聚机理出发解释NPBA组成不均匀的原因,是由于两种单体反应活性不同,会造成共聚过程中两种单体摩尔配比的变化;而自由基聚合的“快增长”机理又决定了瞬时生成的共聚物的组成只与此刻单体的配比有关,所以两种反应活性不同的单体在自由基共聚反应中极易产生前期生成的共聚物与后期的生成的共聚物组成不一的现象,即组成漂移[13]。国外科研人员对组成漂移现象及其抑制措施做了大量研究[15-18]。4-乙烯基苯磺酸钠盐(VB)与丙烯酰胺(Am)共聚过程中,两种单体的反应活性相差较大,rVB=2.14,rAm=0.18,采取半连续进料策略可抑制组成漂移现象的发生[17]。国内科研人员也研究了丙烯腈与衣康酸铵[19]、丙烯腈与衣康酸[20]、甲基丙烯酸甲酯与马来酸酐[21]等自由基共聚过程中组成漂移现象及其抑制措施。对于制备NPBA的AN与HEA自由基共聚体系,通过Q-e经验公式计算得到AN和HEA的竞聚率,r1=0.365,r2=2.003[22],属于r1×r2<1,而r1<1,r2>1的非理想共聚[13]。此外,有研究证明通过匀速滴加部分HEA单体的半连续共聚工艺,可得到组成较为均匀的AN-HEA共聚物[14,23]。但共聚过程中自由基浓度、单体组成和转化率、共聚物瞬时和平均组成的变化未见讨论,而且半连续滴加工艺中HEA的滴加策略仍有改进的空间。
综上所述,为解决NPBA组成不均匀的问题,本文先分析AN和HEA自由基无规共聚过程中共聚物瞬时组成与单体组成的关系;然后建立动力学模型,研究共聚过程中引发剂、自由基浓度、单体转化率、共聚物瞬时和平均组成的变化,揭示组成漂移现象;此外,本研究证明为得到单体组成均匀AN-HEA共聚物,应采用半连续变速滴加HEA的策略,并通过模型确定HEA的滴加速率。
1 AN-HEA间歇共聚
1.1 共聚物瞬时组成与单体组成的关系
二元共聚中,共聚物中单体1(AN)的瞬时摩尔分数F1与该时刻单体混合物中单体1的摩尔分数f1以及竞聚率r1如式(1)所示[13]。根据r1=0.365和r2=2.003[22],可以计算得到F1与f1(注意,f2=1-f1)的关系式,如图1所示。

图1 HTPB固化物网链局部结构示意图

图1 F1和f1的关系
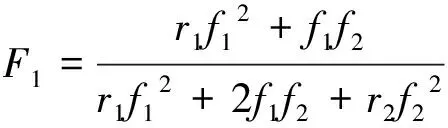
(1)
为更好地说明问题,图1中加入y=x的曲线。从竞聚率数值(r1=0.365,r2=2.003)上可以看出,AN的反应活性低于HEA;从图1可以看出,为得到瞬时组成为A点的共聚物,需使得f1在C点,而非B点,即单体中AN摩尔分数要大于其在共聚物中的摩尔分数。
1.2 AN-HEA间歇自由基共聚模型推导
考虑到共聚体系中部分参数无现成数据,并为了简化模型做如下假设:
(1)模型中的参数不随反应转化率的变化而变化,即不考虑扩散限制对反应的影响[24-25];
(2)只考虑初级自由基与单体AN的加成反应,生成单体自由基,且引发剂引发效率f=1;
(3)链终止反应中所有双基终止速率均等于 AN·终止速率;
(4)链转移反应对共聚物组成无影响,可不考虑;
(5)共聚物在反应溶剂中溶解良好,且忽略共聚过程中溶液体积的变化。
共聚过程中引发剂、自由基浓度和单体组成、共聚物组成与链引发、链增长和链终止等基元反应息息相关。具体如下:
(1)链引发反应
引发剂分解成初级自由基。
初级自由基与单体AN加成形成单体自由基。
(2)链增长反应
AN·与单体AN反应。
AN·与单体HEA反应。
HEA·与单体AN反应。
HEA·与单体HEA反应。
(3)链终止反应

双基终止,X和Y为AN或HEA。
共聚过程中引发剂、自由基浓度和单体组成、共聚物组成的变化如式(2)~式(17)所示。
对于引发剂:
(2)
式中kd为引发剂分解消耗速率。
对于自由基总浓度[M·]:
(3)
即自由基浓度与引发剂浓度及其分解速率、引发效率以及自由基双基终止速率有关,且满足:
[M·]=[AN·]+[HEA·]
(4)
k12[AN·][HEA]=k21[HEA·][AN]
(5)
式中f为引发剂引发效率;V为共聚反应中溶液体积;[M·]、[AN·]、[HEA·]分别为自由基总浓度、端基为AN的自由基和端基为HEA的自由基浓度。
对于单体摩尔数:
(6)
(7)
式中 [AN]、[HEA]分别为AN和HEA的摩尔数。
此刻单体1的摩尔分数f1:
(8)
此刻生成的共聚物中AN的摩尔分数F1(瞬时组成)通过式(1)计算。
单体总和转化率C:
(9)
AN转化率C1:
(10)
HEA转化率C2:
(11)
式中 [M0]、[M10]、[M20]分别为起始投料中总单体摩尔数、AN摩尔数和HEA摩尔数;[M]、[M1]、[M2]分别为共聚过程中总单体摩尔数、AN摩尔数和HEA摩尔数。
间歇自由基二元共聚过程中,单体总和转化率C也可通过Meyer公式[13]计算:
(12)
其中,
(13)
(14)
(15)
(16)
(17)
1.3 案例分析
下面分析一个典型的AN-HEA在60 ℃恒温间歇自由基共聚过程中各变量的变化,共聚反应配方[26]如表1所示,动力学参数及其数值如表2所示。

表1 Ⅰ型HTPB标准(GJB 1327A—2021)关键指标

表1 AN-HEA间歇自由基共聚反应配方[26]

表2 不同样品中各官能度组分摩尔数
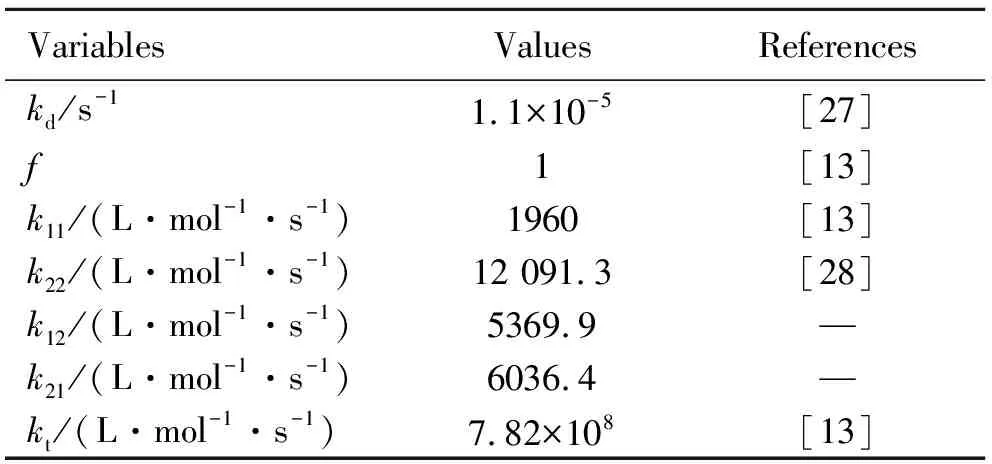
表2 动力学参数及数值
k12和k21通过竞聚率的定义计算得到[22]:
(18)
(19)
联立式(2)、式(3)、式(6)、式(7),得到常微分方程组(ordinary differential equations,ODEs),通过MATLAB 2022a求解,求解器为ode23s,时间步长为1 s,结果如图2~图6所示。
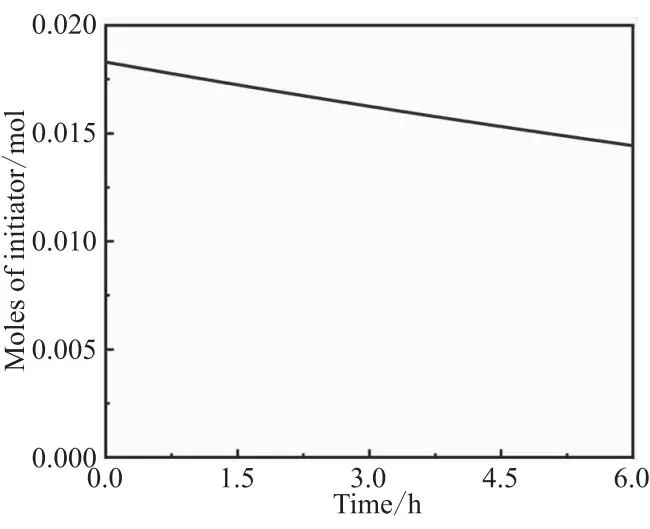
图2 引发剂摩尔数的变化
随着引发剂的分解产生自由基,引发剂摩尔数逐渐降低,如图2所示。起始引发剂摩尔数为0.018 3 mol,6 h后共聚反应体系中剩余的引发剂摩尔数为 0.014 4 mol,分解率为21.3%,仍有大量引发剂未反应。
自由基聚合反应中自由基浓度非常低,一般难以测量,而模型可以很好地分析体系中自由基浓度及其变化。共聚反应体系中自由基总浓度、[AN·]和[HEA·]浓度如图3所示,随着引发剂摩尔数的减少,自由基总浓度[M·]减少;[HEA·]浓度也一直降低。值得注意的是,[AN·]先升高后降低,最后基本与自由基总浓度相等,这可以用图4中AN和HEA摩尔数的变化来解释。图4中AN和HEA摩尔数随着反应的进行均一直降低。HEA反应活性较高(表2),共聚反应进行3 h后体系中HEA的摩尔数已经非常低了。AN在共聚反应体系中所占比例越来越大,相应的[AN·]占自由基总浓度[M·]的比例越来越大;[AN·]所占比例的增加与自由基总浓度[M·]逐渐降低的趋势共同使得图3中[AN·]浓度先升高后降低。
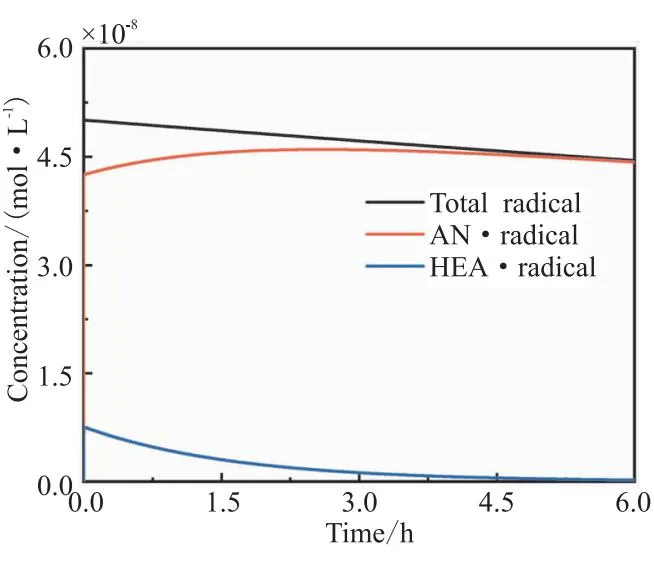
图3 自由基总浓度、[AN·]和[HEA·]浓度的变化
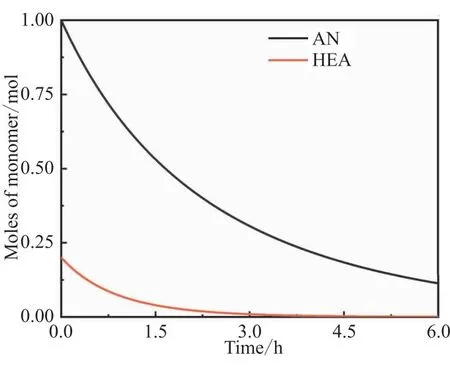
图4 AN和HEA摩尔数的变化
AN和HEA以及总单体的转化率如图5所示,高活性的HEA转化率始终高于AN。4.5 h时,HEA转化率几乎已达100%,体系中HEA的摩尔分数非常低。单体总转化率介于HEA转化率和AN转化率之间,通过定义计算的单体总转化率(式(9))与Meyer积分计算的单体总转化率(式(12))一致。
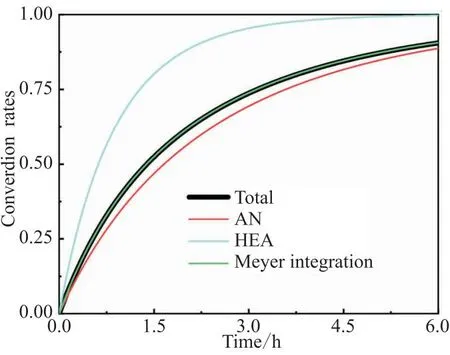
图5 AN和HEA转化率的变化
2 AN-HEA半连续共聚
为得到组成均匀的共聚物,聚合工艺可采用连续滴加高活性单体的方法[13]。本文的模拟采用一次性投入全部AN(摩尔数为[M10])和部分HEA(摩尔数为[M20])、连续滴加剩余HEA的投料方法,该方法可以维持反应体系中AN的摩尔分数f1不变,所以单体摩尔比[AN]/[HEA]([M1]/[M2])比值也不变,如式(20)所示。因此,自由基浓度之比[AN·]/[HEA·]也为定值,如式(5)所示。
(20)
对HEA做物料衡算时,应当考虑滴加的部分,所以式(7)改为式(21),其中D代表滴加速率(dosing rate)。
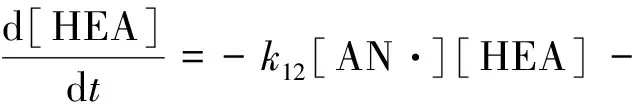
k22[HEA·][HEA]+D
(21)
对D积分可得滴加的HEA摩尔量Q,加上起始投入的HEA摩尔量[M20],即可得HEA总投料量,如果得知此时HEA摩尔量[M2]即可得HEA的转化率C2,如式(22):
(22)
AN的转化率(式(10))和物料衡算(式(6))不变。单体总转化率C,如式(23):
(23)
求解联立式(2)、式(3)、式(6)得到的常微分方程组ODEs,即可得到AN摩尔数[M1]随时间的变化,即可通过式(20)得到[M2]([HEA])随时间的变化,再通过式(21)得到滴加速率D,后续可计算HEA总投料量、单体转化率等。
以表1所示的投料(AN,起始投料量[M10]= 1 mol;HEA,分两部分加入,即先加入一部分,另一部分连续滴加;其他物质均一次性全部加入)、得到共聚物中AN含量为0.833(1/1.2)的共聚物、反应时间仍是6 h为例,计算滴加速率。当F1=0.833时,求解式(1)得f1=0.929,所以[M20]=0.076 5 mol。常微分方程组ODEs仍通过MATLAB 2022a求解,求解器为ode23s,时间步长为1 s,结果如图7~图13所示。如图7所示,引发剂摩尔数一直降低,这与图2相同。

图7 引发剂摩尔数的变化
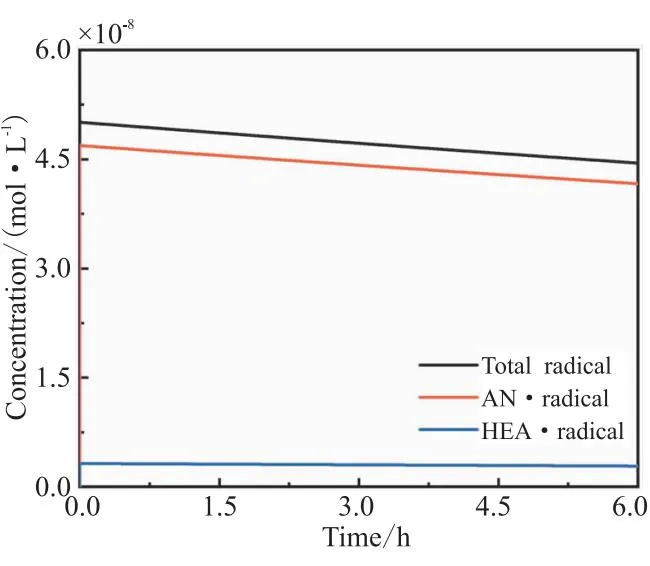
图8 总自由基浓度、[AN·]和[HEA·]浓度的变化
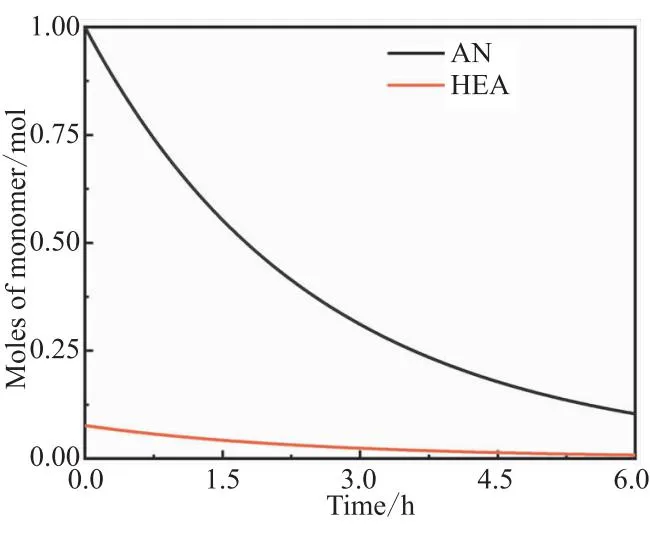
图9 AN和HEA摩尔数的变化
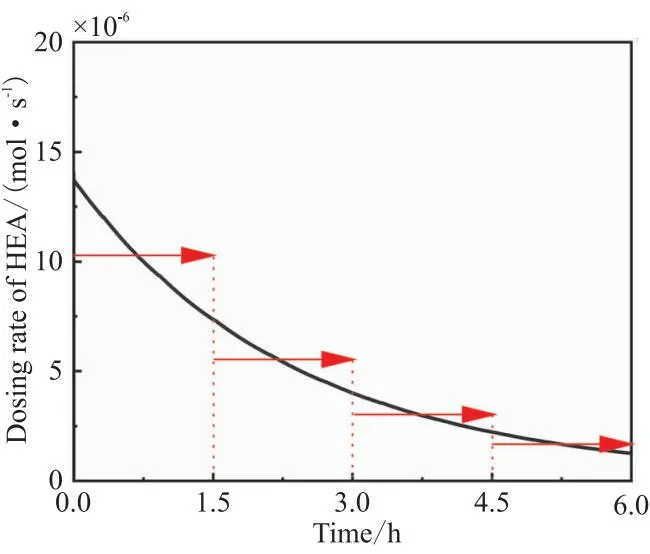
图10 HEA滴加速率的变化

图11 HEA投料总量的变化
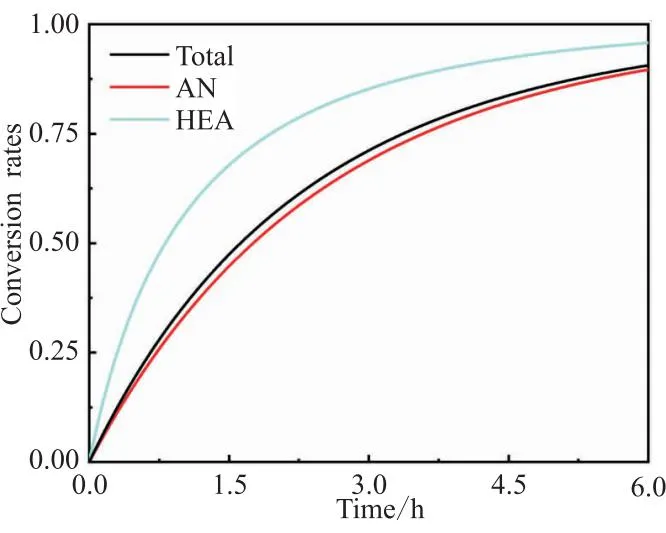
图12 AN和HEA转化率的变化
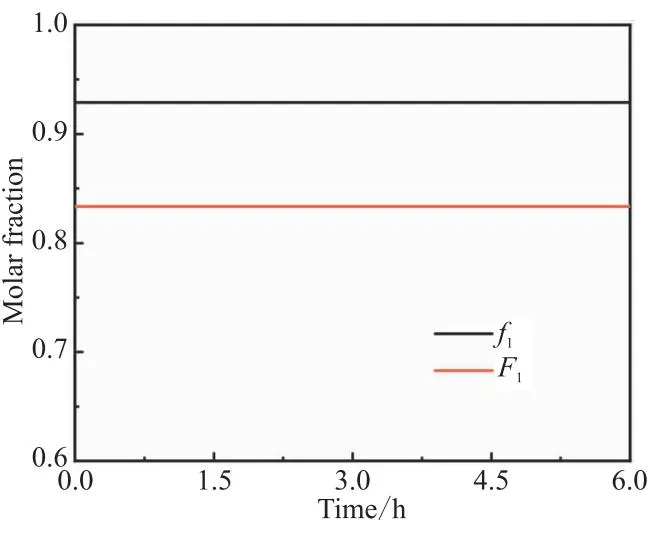
图13 单体混合物中AN摩尔分数f1、共聚物瞬时组成F1的变化
总自由基浓度也随时间一直降低,如图8所示,但与图3不同的是,[AN·]和[HEA·]浓度均一直降低,虽然[HEA·]浓度较低,但并不是0,这是由于式(5)决定了[AN·]和[HEA·]浓度之比为定值。
AN和HEA摩尔数[M1]和[M2]随时间的变化如图9所示,均随时间降低。
计算可到HEA的滴加速率,如图10所示,滴加速率应当随反应时间进行而降低,而非全程匀速滴加[14]。图10中HEA理想的滴加速率一直在变低,具体实施起来有一定的难度,可通过分段匀速滴加的方法使得近似接近图10中的理想滴加速率曲线。显然,段数越多,越接近理想的滴加速率曲线。滴加速率通过某时刻的HEA的累计量减去上个时刻的HEA的累计量除以时间间隔来确定。
如图10中红色箭头和虚线所示,以分为4段为例来计算每段HEA的滴加速率。结果如表3所示,0~1.5 h滴加速率为10.28×10-6mol·s-1,1.5~3 h滴加速率为5.37×10-6mol·s-1,3~4.5 h滴加速率为3.15×10-6mol·s-1,4.5~6 h滴加速率为1.67×10-6mol·s-1,滴加速率逐段降低。
表3 各样品不同官能度组分的分布情况
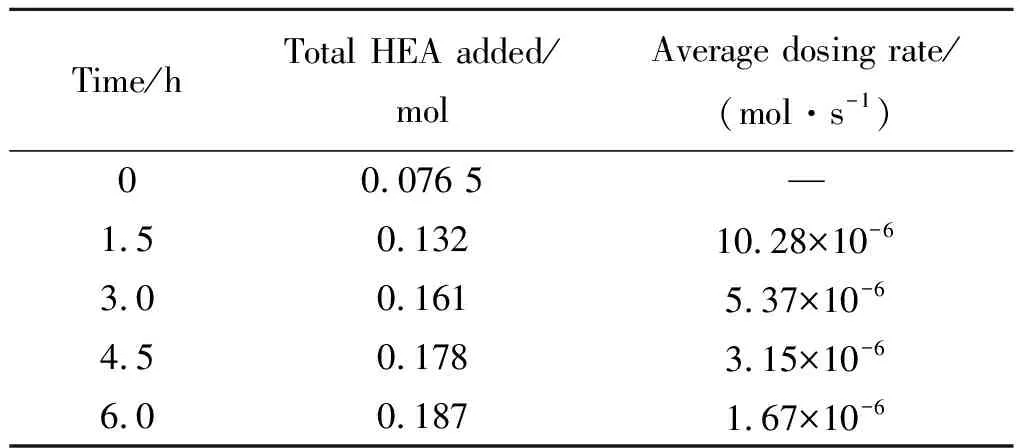
表3 HEA的多段滴加过程
HEA总投料如图11,与纵坐标的截距即为起始投料量[M20]=0.076 5 mol,反应结束时HEA总投料量为0.187 mol。
此外,本模型还可得到AN(式(10))和HEA(式(22))的转化率以及单体总和转化率(式(23))。两种单体的转化率如图12所示,高活性单体HEA转化率仍一直高于低活性单体AN转化率,单体总和转化率介于二者之间。不同于间歇共聚工艺(图5),半连续共聚工艺中HEA转化率未达100%。半连续共聚工艺中AN转化率并未达到100%,所以HEA总投料量同时也小于0.2 mol(实际为0.187 mol)。与图6不同,单体混合物中AN的摩尔分数f1一直不变,共聚物瞬时组成F1也不变,实现了整个共聚过程中前、后期生成的共聚物组成一致。
3 结论
(1)由于HEA反应活性高于AN,共聚反应过程中单体混合物中AN的摩尔分数f1逐渐增大,会导致前期生成的共聚物中HEA含量较高(F1较小),后期生成的共聚物中HEA含量较低(F1较大),共聚物组成不均匀,即组成漂移。
(3)为了使半连续共聚工艺更具操作性,可选择多段匀速滴加的方法,本文中的模型可确定各段的滴加速率。
(4)为简化模型,本研究做了五个假设。笔者会将此模型应用到下一步工作中,通过实验测定AN和HEA共聚反应的竞聚率和过程中单体的转化率、聚合物组成等信息,来验证并完善该模型。
