全弓与右半弓置换术在急性Stanford A 型主动脉夹层治疗中的临床分析
2024-01-12张兆喻董书强
张兆喻 张 羽 董书强
(中国人民解放军联勤保障部队第九四〇 医院,甘肃 兰州 730050)
主动脉夹层属于临床常见心血管病,机体主动脉内膜发生撕裂,动脉中原本的血流会从主动脉撕裂位置流动,使得主动脉壁发生分离的状况[1]。该病多发群体为中老年,且男性发病比例多于女性,患病后机体内血液流动走向会发生紊乱,致使患者身体脏器内血液循环发生障碍。急性Stanford A 型主动脉夹层作为血管外科中多见的急症疾病,存在发病快、进展迅猛,患者致死率高等特征,该类患者可在48 h 内存在高致死率[2]。该类患者发病后会出现显著的腰背部撕裂样疼痛感,临床针对该病常用的诊断方式为动脉血管内CT 造影检查。患者可发生大血管中膜肌层发生退行性病变、囊性坏死等临床表现,最终导致血管内膜破裂,血流从撕裂口抵达中膜、内膜中间,主动脉形成真假两腔,可能存在假腔顺行、逆行传达至主动脉分支中,引起脏器缺血[3]。临床针对该病常采取手术干预,全弓与右半弓置换术两种术式均有其各自优势。本研究选取我院急性Stanford A 型主动脉夹层患者90 例,探讨全弓与右半弓置换术的应用价值,现报道如下。
1 资料与方法
1.1 一般资料
本研究选取2019 年1 月至2023 年3 月我院急性Stanford A 型主动脉夹层患者90 例,参照随机法将其等分为两组,右半弓置换组与全弓置换组,各45 例。研究经我院伦理委员会同意批准。纳入标准:(1)符合《2021 AATS 专家共识:急性A 型主动脉夹层的手术治疗》[4],经CT、MRI 等检查确诊为急性Stanford A 型主动脉夹层;(2)存在胸背部撕裂样疼痛感;(3)符合临床手术指征;(4)知情并同意本研究者。排除标准:(1)术前存在脑血管、脑卒中者;(2)颈动脉两端存在狭窄者;(3)术中48 h 内发生死亡者;(4)合并恶性肿瘤者;(5)凝血功能严重障碍者;(6)近期进行手术治疗者。
1.2 方 法
破口位置在升主动脉者予以右半弓手术,破口位置在弓部者做全弓手术。所有患者均采取全麻操作,自右侧大腿、腹部交界位置确定腹股沟韧带位置,明确股动脉,行切口,自下将皮肤组织分离,直至股动脉搏动。分离动脉鞘膜、股总动脉。止血夹夹断血液流动。右侧锁骨下2 cm,和右侧锁骨中间位置行切口。游离腋动脉,对动脉进行结扎预防血液流动。切断胸骨,切开心包,游离主动脉、动脉弓,将阻断带置入其中。将肝素注入其中,避免血凝,肝素化后切开腋动脉,置入导管,将其与循环机连接,构建循环后阻断升主动脉。进行深低温、单侧脑灌注。右半弓置换组患者采用人造血管对右半弓进行替换,全弓置换组则用人造血管对主动脉全弓进行替换。
1.3 观察指标
(1)两组基线资料对比,记录年龄、病程、体质量指数等。
(2)两组术中情况对比,记录主动脉阻断、脑灌注及体外循环时间。
(3)两组术后情况对比,记录清醒、机械通气及住院时间。
(4) 两组炎症因子水平对比,C 反应蛋白(CRP)、肿瘤坏死因子(TNF-α)水平。
(5)两组凝血功能对比,凝血酶原时间(PT),D二聚体(D-D)水平。
(6)两组并发症发生率对比,记录急性肾损伤、心包引流等发生率。
1.4 统计学方法
采用SPSS 22.0 软件进行统计学数据处理,计量资料用表示,采用t检验,计数资料采用n(%)表示,组间比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结 果
2.1 两组基线资料对比
两组基线资料均衡可比,差异无统计学意义(P>0.05)。见表1。
表1 两组基线资料对比[n(%)/]
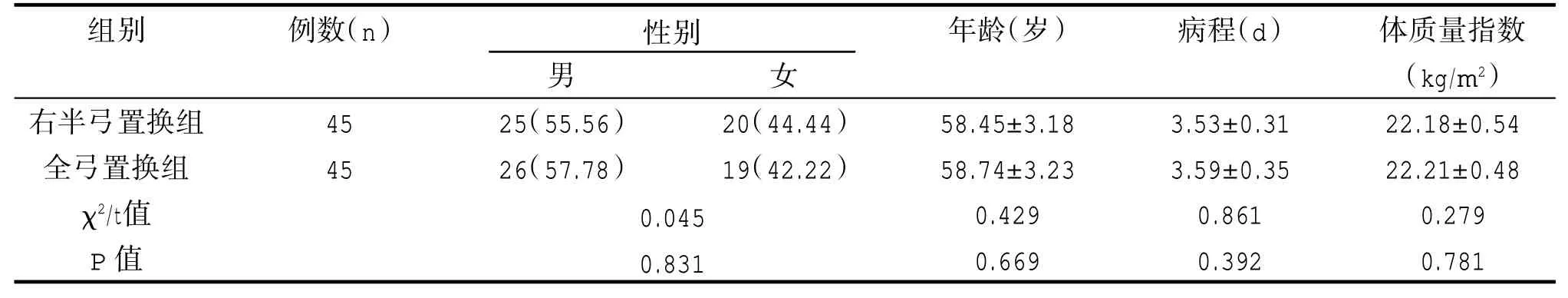
表1 两组基线资料对比[n(%)/]
?
2.2 两组术中情况对比
右半弓置换组主动脉阻断、脑灌注及体外循环时间短于全弓置换组,差异有统计学意义(P<0.05)。见表2。
表2 两组术后情况对比(,min)

表2 两组术后情况对比(,min)
?
2.3 两组术后情况对比
右半弓置换组清醒、机械通气及住院时间均短于全弓置换组,差异有统计学意义(P<0.05)。见表3。
表3 两组术中情况对比()

表3 两组术中情况对比()
?
2.4 两组炎症因子水平对比
术后48 h,右半弓置换组CRP、TNF-α 水平低于全弓置换组,差异有统计学意义(P<0.05)。见表4。
表4 两组炎症因子水平对比()
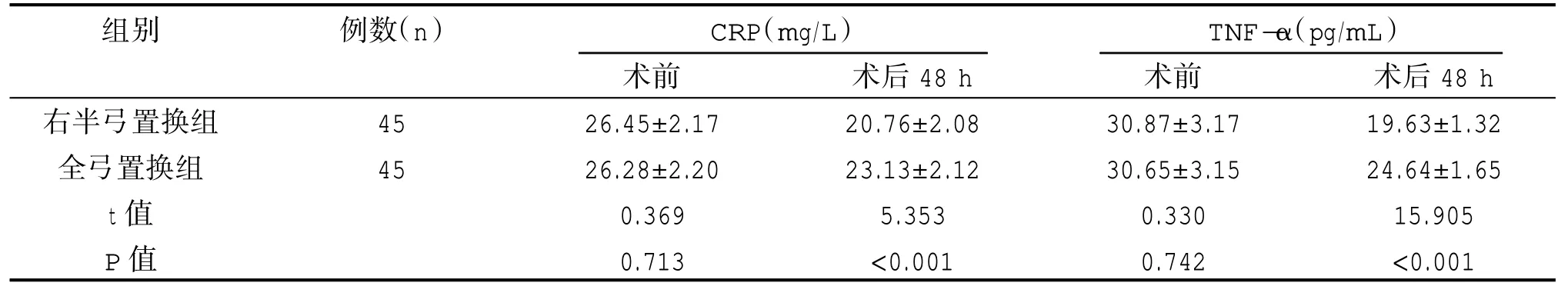
表4 两组炎症因子水平对比()
?
2.5 两组凝血功能对比
术后48 h,右半弓置换组PT 长于全弓置换组,D-D 水平低于全弓置换组,差异有统计学意义(P<0.05)。见表5。
表5 两组凝血功能对比()
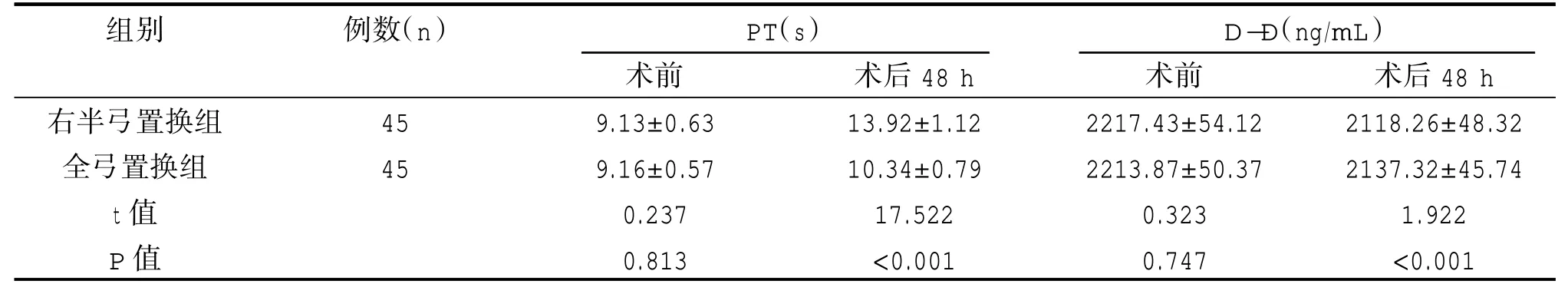
表5 两组凝血功能对比()
?
2.6 两组并发症发生率对比
右半弓置换组并发症发生率(4.44%)与全弓置换组(8.89%)对比,差异无统计学意义(P>0.05)。见表6。
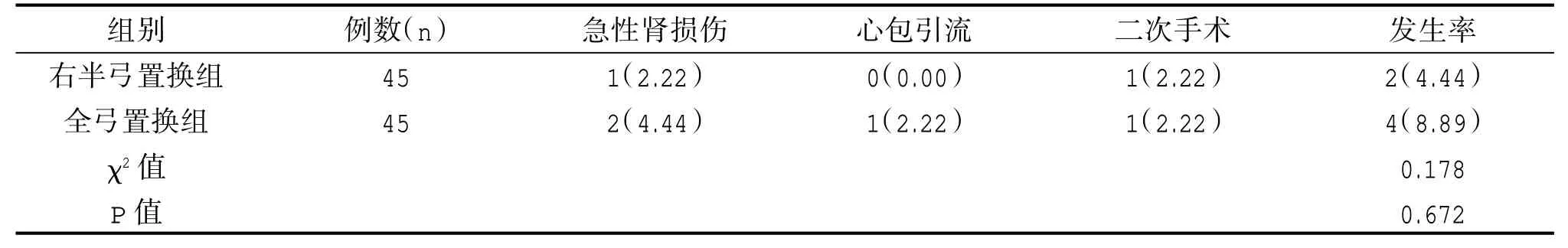
表6 两组并发症发生率对比[n(%)]
3 讨 论
急性Stanford A 型主动脉夹层是患者主动脉产生相关病变,导致动脉破裂,缺乏及时有效的治疗可致死,该病在临床发病率较高。临床针对该病的发病机制尚不明确,但有研究认为高血压可导致该病发生,其发病机制可能为机体血液动力学变化,其组织病理学发生变化等等,发病因素复杂,临床治疗难度大[5]。其中A 型夹层属于较为严重的夹层类型,可累及机体胸主动脉、主动脉弓和降主动脉。患者发病后病情往往急骤凶险,48 h 内发生的致死率极高,临床针对该类疾病通常需要采取动脉血管置换,植入降主动脉支架。此类手术难度较高,风险较大,因此对于开展何种术式治疗该类患者存在较大争议[6]。
本研究针对急性Stanford A 型主动脉夹层患者采用右半弓置换术,结果显示,右半弓置换组主动脉阻断、脑灌注及体外循环时间短于全弓置换组(P<0.05),右半弓置换组清醒、机械通气及住院时间均短于全弓置换组(P<0.05),提示采用该术式有利于围术期情况改善。分析原因在于,临床开展弓置换术中需要对患者主动脉进行阻断血流、切开皮肤组织等操作,使得患者机体内环境长期暴露在空气中,机体长时间会在深低温情况下,存在身体体温大幅度的降低和增加的趋势,容易导致应激反应发生。且配合肝素注入会导致机体凝血机制被激活,致使凝血功能障碍,加上长时间的体外循环会引发血管内皮细胞发生缺氧受损坏死,最终导致大量的炎症介质被释放入血,诱导凝血功能发生障碍[7-8]。右半弓置换术由于未采取全弓置换,手术流程操作少,减少了对机体主动脉周围组织和血管不必要的损伤,降低对内环境状态的破坏,能有效减少体外循环、脑灌注等发生时间。而全弓置换术需要行弓部重建,其主动脉阻断时长也会延长,右半弓置换组则更有益于术后患者机体康复周期缩短,利于其恢复[9]。
本研究结果显示,术后48 h,右半弓置换组CRP、TNF-α 水平低于全弓置换组,差异有统计学意义(P<0.05),术后48 h,右半弓置换组PT 长于全弓置换组,D-D 水平低于全弓置换组,差异有统计学意义(P<0.05),提示采用该术式可缓解炎症,利于凝血功能改善。分析其原因:炎症是机体受内源性或外源性等损伤因子影响,导致血管机体细胞组织发生损伤,机体局部和全身区域也可能发生炎症反应,CRP、TNF-α 作为炎性因子,当机体组织损伤或受病菌侵袭后产生炎症性刺激,这两种因子水平的提升可表示炎症状况加重。D-D 能特异性反映继发性纤溶亢进、高凝状况的标志物,该水平的显著提升提示患者出现高凝状况,PT 则为外源性凝血功能敏感标志物,能有效判断凝血障碍状况。弓部置换术作为手术操作必然会对机体内环境造成破坏,引发机体损伤,诱导应激反应发生,引起机体炎症。而右半弓置换术较全弓置换术手术难度更低,体外循环时间及脑灌注时间等都要更短,其深低温停循环对患者脑部造成的影响更小,对喉返神经的损害更轻微,其预后效果更好,帮助凝血功能改善[10]。此外,本研究结果还显示,右半弓置换组并发症发生率(4.44%)与全弓置换组(8.89%)对比,差异无统计学意义(P>0.05),提示采用该术式安全性较好,该研究结果与潘君晖[11]等人一致。但黄志辉等人也表明,该术式操作中也存在一定缺陷,在对患者分支动脉进行重建时,还需要做对应的分支动脉阻闭,存在潜在风险,尽管缩短了深低温停循环时间,但仍然存在停循环状况,也容易会有并发症[12]。本研究还存在所选取样本数量较少的局限性,临床后续还需加大样本数量,予以更多的随机样本研究丰富结果科学性。
综上所述,针对急性Stanford A 型主动脉夹层治疗,采用右半弓置换术有利于改善围术期情况、凝血功能,缓解炎症,便于临床推广应用。
