健脾渗湿解毒汤对高尿酸血症大鼠的作用及机制探讨❋
2024-01-11叶文静杨文奎符芸瑜吴小翠邱晓堂
叶文静,杨文奎,符芸瑜,吴小翠,邱晓堂
(海南省中医院,海口 570203)
近年来,由于生活水平提高及饮食习惯改变,高尿酸血症(hyperuricemia, HUA)的患病率在我国呈显著上升趋势[1-2]。HUA是由嘌呤代谢障碍,血清中尿酸积聚过多所致。由于尿酸在血清中的溶解度低,导致其在关节及其他组织中沉积形成痛风[3-4]。HUA在痛风的发生和发展中发挥至关重要的作用。中医认为HUA证属本虚标实,主要与先天不足或后天饮食不节,造成脾运失常,水谷不能化生精微而酿生浊邪,久之脾损及肾,肾之泌浊气化功能受损,浊毒排泄障碍相关。本病以脾虚为本,湿热、痰浊、瘀血为标[5]。本课题组结合HUA“湿浊内阻、壅滞血脉”的中医病机,拟健脾益气、泄浊渗利、化瘀解毒为法,以四妙散为底方,创立“健脾渗湿解毒汤”,前期在临床实践中发现该方有一定的降尿酸功效。本研究拟在探讨健脾渗湿解毒汤对HUA大鼠血尿酸、肝肾功能和病理学变化作用的基础上,进一步观察其对肾脏尿酸盐转运蛋白(urate transporter,URAT)1和有机阴离子转运蛋白(organic anion transporter,OAT)3表达的影响,以期为临床使用该方提供实验依据。研究计划已通过海南省中医院实验动物管理与使用委员会批准,编号:IACUC-HPHCM-2203010。
1 材料
1.1 动物
普通雄性SD大鼠 60只,6~8周龄,体质量(200±20)g,购自长沙天勤生物科技有限公司,动物许可证号:SCXK(湘)2019-0014。所有大鼠均饲养于海南省中医院实验动物中心,每日12 h照明,室温25 ℃,不限食水,实验前适应性喂养7 d。
1.2 药品与试剂
土茯苓、苍术、绵萆薢、薏苡仁、黄柏、威灵仙、木瓜、当归、丹参、鸡血藤,以上药材均由海南省中医院中药房制作成中药颗粒散剂使用。苯溴马隆购自宜昌东阳光长江药业股份有限公司(货号:006208020);腺嘌呤、氧嗪酸钾及羧甲基纤维素钠粉末均购自上海麦克林生化科技有限公司(货号分别为:C10921809、C12740420、C11402786);异氟烷购自河北一品制药股份有限公司(货号:2011103);4%多聚甲醛固定液、SDS-PAGE凝胶配制试剂盒购自苏州新赛美生物科技有限公司(货号分别为:22242687、202120320);蛋白裂解液(强)、蛋白浓度测定试剂盒购自江苏碧云天生物技术公司(货号分别为:P0013B、P0012);RNA提取试剂购自美国ThermoFisher Scientific公司(货号:15596026);逆转录试剂盒购自北京天根生化科技有限公司(货号:X01787);实时荧光定量PCR试剂盒购自美国Bio-Rad公司(货号:64435437);URAT1兔单克隆抗体购自美国Immunoway公司(货号:YN3803);OAT3兔单克隆抗体购自武汉爱博泰克生物科技有限公司(货号:A14575);内参β-actin鼠单克隆抗体购自美国CST公司(货号:3700S);辣根过氧化物酶标记山羊抗兔和兔抗小鼠二抗购自美国Jackson公司(货号分别为:111-035-003、315-035-003);苏木素-伊红(hematoxylin-eosin,HE)染色试剂盒购自北京索莱宝科技有限公司(货号:G1121)。
1.3 主要仪器
BSH-C2型组织研磨仪和FC-1100型超微量紫外可见分光光度计,杭州逐真生物技术有限公司;SUNRISE型酶标仪,瑞士Tecan公司;4600SF型化学发光仪,上海天能科技有限公司;CFX Connec型实时荧光定量PCR仪和Mini-PROTEAN Tetra型电泳仪,美国Bio-Rad公司;AU5800型全自动生化分析仪,美国贝克曼库尔特有限公司;R540LP型麻醉机,深圳瑞沃德生命科技有限公司;Pannoramic MIDI型切片扫描仪,匈牙利3DHISTECH公司。
2 方法
2.1 分组与造模
将60只健康雄性SD大鼠随机分为空白对照组、模型组、苯溴马隆组和健脾渗湿解毒汤低、中、高剂量组,每组各10只。除空白对照组外,其余各组大鼠均以腺嘌呤50 mg/kg +氧嗪酸钾1.5 g/kg灌胃,1次/d,共灌胃21 d建立HUA大鼠模型[6]。
2.2 给药方法
按照成人体质量60 kg换算出大鼠等效剂量,健脾渗湿解毒汤低、中、高组给药剂量分别为9.5 g/kg、18.9 g/kg、3.78 g/kg,苯溴马隆组给药剂量为5.25 mg/kg。健脾渗湿解毒汤(土茯苓30 g、苍术15 g、萆薢20 g、薏苡仁30 g、黄柏15 g、威灵仙30 g、木瓜20 g、当归15 g、丹参15 g、鸡血藤20 g)颗粒散剂用加热后的蒸馏水溶解,配制成低(0.95 g/mL)、中(1.89 g/mL)、高(3.78 g/mL)3个不同浓度的溶液。苯溴马隆片研磨成粉末状后,于蒸馏水中溶解制成浓度为0.525 mg/mL的溶液。各药物治疗组大鼠在模型制备1 h后分别予苯溴马隆溶液及不同浓度的健脾渗湿解毒汤灌胃,空白对照组和模型组大鼠予蒸馏水灌胃,1次/d,共持续21 d。
2.3 标本采集
第21天末次给药2 h后,异氟烷麻醉各组大鼠,腹主动脉取血,收集血清保存于-80 ℃中用于血清生化指标的检测。取大鼠左肾液氮速冻后于-80 ℃保存用于总蛋白和总RNA提取,右肾及部分肝脏组织于4%多聚甲醛中固定用于肾脏及肝脏HE染色。
2.4 血清生化指标检测
将收集的血清置于全自动生化分析仪中检测血尿酸(serum uric acid,SUA)、血肌酐(serum creatinine,SCR)、尿素氮(blood urea nitrogen,BUN)、谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)含量。
2.5 肾脏及肝脏组织形态观察
对肾脏和肝脏组织进行固定后,进行脱水和石蜡包埋处理,制成厚度为4 μm的切片,并根据试剂盒说明书进行HE染色,在显微镜下观察其病理变化。
2.6 Western blot检测肾脏组织中URAT1和OAT3蛋白表达
取肾脏组织,加入适量蛋白裂解液提取组织蛋白质,蛋白浓度测定试剂盒检测蛋白浓度,每组取30 μg总蛋白进行电泳、转膜,5%脱脂奶粉室温封闭2 h后,加入URAT1(1:1 000)、OAT3(1:1 000)、β-actin(1:1 000)一抗,4 ℃冰箱孵育过夜,次日加入二抗(1:5 000)常温孵育1 h。洗膜后滴加增强型化学发光(enhanced chemiluminescence,ECL)液,化学发光成像仪中成像。利用Image J软件对条带灰度值进行分析,并用目的蛋白与内参的比值来表示目的蛋白相对表达量。
2.7 实时荧光定量PCR检测肾脏组织中URAT1和OAT3 mRNA表达
取肾脏组织,提取总RNA,使用超微量紫外可见分光光度计测定RNA的纯度和浓度,按照逆转录试剂盒说明书将RNA逆转录成cDNA,再按照实时荧光定量PCR试剂盒说明书对cDNA进行扩增反应。以GAPDH作为内参基因,采用2-△△Ct法计算 URAT1和OAT3 mRNA的相对表达水平。引物由北京擎科生物科技有限公司合成,各引物序列见表1。

表1 引物序列表
2.8 统计学方法
3 结果
3.1 健脾渗湿解毒汤对大鼠SUA、SCR、BUN水平的影响
如表2所示,与空白对照组比较,模型组大鼠SUA和SCR水平显著升高(P<0.05);与模型组比较,苯溴马隆组和健脾渗湿解毒汤低剂量组大鼠SUA水平明显下降(P<0.01),健脾渗湿解毒汤中剂量和高剂量组大鼠SUA、SCR、BUN水平均明显下降(P<0.05)。

表2 健脾渗湿解毒汤对大鼠SUA、SCR、BUN水平的影响
3.2 健脾渗湿解毒汤对大鼠AST、ALT水平的影响
如表3所示,各组大鼠血清AST、ALT水平比较,差异无统计学意义(P>0.05)。

表3 健脾渗湿解毒汤对大鼠AST、ALT水平的影响
3.3 健脾渗湿解毒汤对大鼠肝脏组织形态学的影响
HE染色结果表明各组大鼠肝小叶结构完整、清晰;肝细胞排列规则,未见肿胀或坏死;肝窦间隙正常,未见挤压或扩张,同时未见明显炎症组织浸润,见图1。
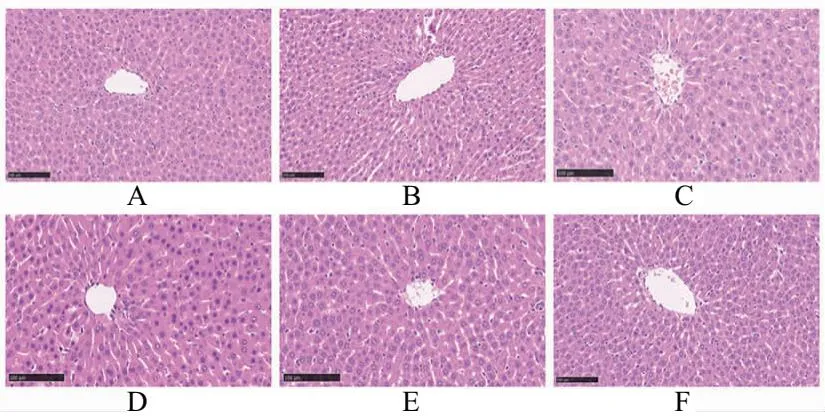
A.空白对照组;B.模型组;C.苯溴马隆组;D.健脾渗湿解毒汤低剂量组;E.健脾渗湿解毒汤中剂量组;F.健脾渗湿解毒汤高剂量组图1 大鼠肝脏组织形态学观察(HE ×200)
3.4 健脾渗湿解毒汤对大鼠肾脏组织形态学的影响
HE染色结果表明空白对照组大鼠肾脏组织形态学基本正常,模型组大鼠可见肾小球萎缩并呈现颗粒样变性,肾小管扩张,肾小管上皮细胞空泡变性;与模型组比较,各药物治疗组大鼠肾脏病理损伤均有所减轻,其中健脾渗湿解毒汤高剂量组大鼠改善较为明显,见图2、图3。
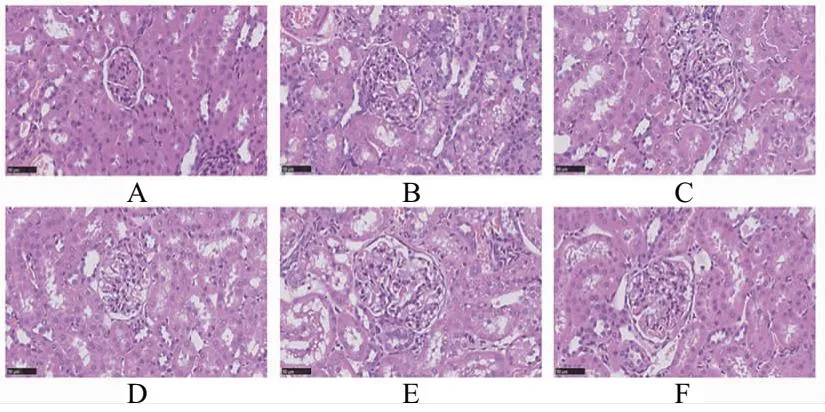
A.空白对照组;B.模型组;C.苯溴马隆组;D.健脾渗湿解毒汤低剂量组;E.健脾渗湿解毒汤中剂量组;F.健脾渗湿解毒汤高剂量组图2 大鼠肾小球形态学观察(HE ×400)
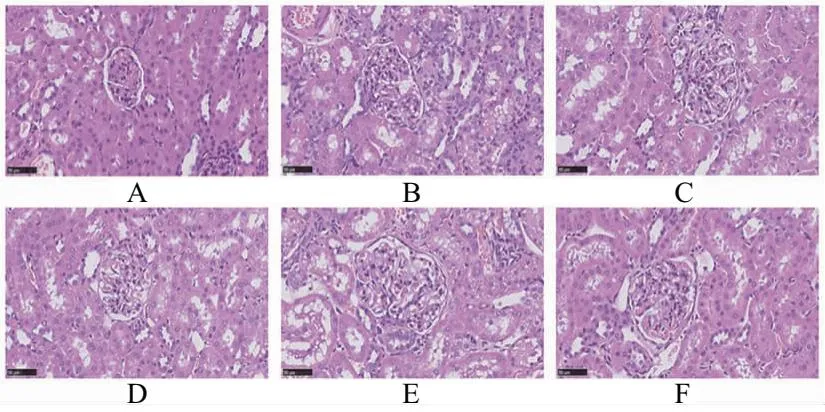
A.空白对照组;B.模型组;C.苯溴马隆组;D.健脾渗湿解毒汤低剂量组;E.健脾渗湿解毒汤中剂量组;F.健脾渗湿解毒汤高剂量组图3 大鼠肾小管形态学观察(HE ×400)
3.5 健脾渗湿解毒汤对大鼠肾脏转运蛋白URAT1、OAT3表达的影响
如图4所示,与空白对照组比较,模型组大鼠肾脏组织中URAT1的蛋白表达水平明显升高(P<0.01),OAT3的蛋白表达水平明显降低(P<0.01);与模型组比较,苯溴马隆组和健脾渗湿解毒汤高剂量组大鼠肾脏组织中URAT1的蛋白表达水平显著下降(P<0.01),OAT3的蛋白表达水平明显上调(P<0.05)。

注:与空白对照组比较 ##P<0.01;与模型组比较*P<0.05,**P<0.01;尿酸盐转运蛋白1(URAT1),有机阴离子转运蛋白3(OAT3)A.空白对照组;B.模型组;C.苯溴马隆组;D.健脾渗湿解毒汤低剂量组;E.健脾渗湿解毒汤中剂量组;F.健脾渗湿解毒汤高剂量组;图4 健脾渗湿解毒汤对肾脏组织URAT1、OAT3蛋白表达的影响 (n=3)
3.6 健脾渗湿解毒汤对大鼠肾脏转运蛋白URAT1、OAT3 mRNA表达的影响
如图5所示,与空白对照组比较,模型组大鼠肾脏组织中URAT1的mRNA表达水平明显升高(P<0.01),OAT3的mRNA表达水平明显降低(P<0.01);与模型组比较,苯溴马隆组和健脾渗湿解毒汤高剂量组大鼠肾脏组织中URAT1的mRNA表达水平显著下降(P<0.05),OAT3的mRNA表达水平明显升高(P<0.05)。
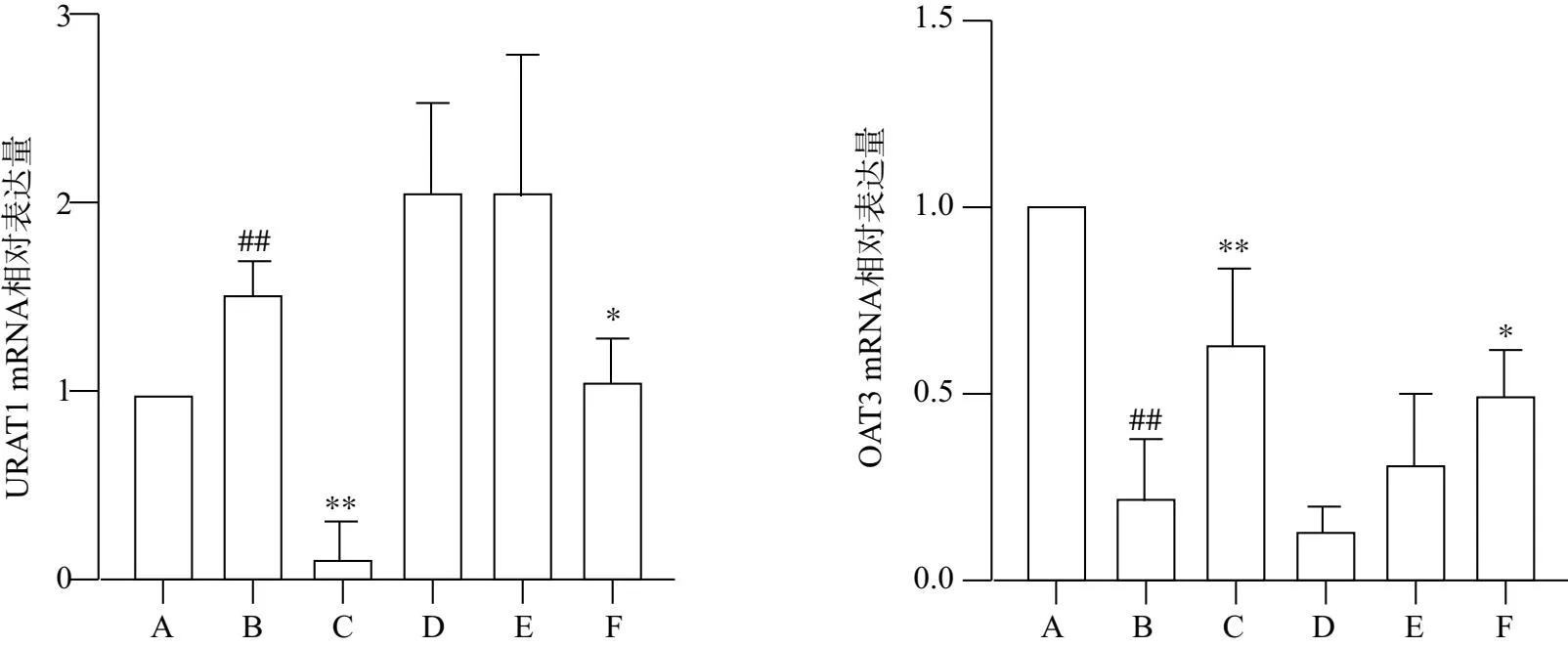
注:与空白对照组比较 ##P<0.01;与模型组比较*P<0.05,**P<0.01;尿酸盐转运蛋白1(URAT1),有机阴离子转运蛋白3(OAT3)A.空白对照组;B.模型组;C.苯溴马隆组;D.健脾渗湿解毒汤低剂量组;E.健脾渗湿解毒汤中剂量组;F.健脾渗湿解毒汤高剂量组;图5 健脾渗湿解毒汤对肾脏组织URAT1、OAT3 mRNA表达的影响 (n=3)
4 讨论
尿酸由嘌呤代谢产生,并通过尿酸酶氧化成更易溶于水的尿囊素,不通过肾小管的吸收而直接排出体外。与大多数哺乳动物不同,人类缺乏尿酸酶,因此肾脏排泄是维持人体尿酸盐水平稳定的关键因素。正常情况下人体每日约有90%的尿酸盐经肾脏过滤后从尿液中排出,尿酸的排出主要与肾脏的滤过、吸收、分泌及分泌后重吸收相关,而近端小管是尿酸重吸收和排泄的主要部位[7-8]。尿酸盐转运蛋白如尿酸重吸收蛋白和尿酸分泌蛋白主要分布于肾脏近端小管内,对尿酸重吸收与排泄起着至关重要的作用[9]。
尿酸重吸收蛋白URAT1主要由SLC22A12编码,位于近端肾小管上皮细胞的顶膜,通过介导管腔内的尿酸与近曲小管上皮细胞内无机阴离子、有机阴离子交换从而将尿酸从管腔内重吸收至上皮细胞内。URAT1是重要的尿酸重吸收转运蛋白,在维持人体尿酸稳态中起重要作用。研究发现,大鼠在高嘌呤负荷下, URAT1表达上调,进而促进尿酸的重吸收,导致尿酸排泄减少[10]。而通过药物干预可使URAT1表达下调,减少尿酸的重吸收,从而促进尿酸排泄,降低HUA的发生[11-12]。随着研究的深入,目前已有多个URAT1抑制剂被批准用于HUA的临床治疗[13]。因此,URAT1是治疗HUA的重要药物靶点。
OAT3是尿酸分泌蛋白,由SLC22A8基因编码,位于近端小管上皮细胞的基底外侧,主要功能是将尿酸从近端肾小管上皮细胞转运至肾小管腔。有研究证实,敲除OAT3 后小鼠肾小管的尿酸盐分泌下降,尿酸的排出减少,表明OAT3的基本功能是促进尿酸盐的排泄[14]。同时近期多项研究表明,在HUA中OAT3的表达是下调的,通过药物干预使OAT3表达上调可促进尿酸排泄,进而降低HUA的发生[15-16]。以上研究提示,OAT3在尿酸的排泄中发挥重要作用。
目前,HUA在我国患病率逐年升高,而民众对HUA了解程度低,起始治疗晚,极大地降低了病人的生活质量及预期寿命,亦为家庭及社会带来巨大经济负担。西医治疗HUA的药物主要涉及抑制尿酸生成、促进尿酸排泄及促进尿酸溶解。这些药物能有效降低血液尿酸水平,但部分患者易出现胃肠道刺激、皮疹、肝损害等不良反应[17],临床应用受到了一定的限制。中医药治疗以整体观念和辨证论治为基础,有一药或一方多效、作用靶点广泛等优势,在降尿酸、抗炎、消肿、镇痛等方面发挥重要作用[18]。健脾渗湿解毒汤方中土茯苓解毒除湿、通利关节,黄柏苦寒清热燥湿,苍术苦辛温燥、燥湿健脾,绵萆薢、薏苡仁利湿祛浊、宣解毒痹,威灵仙祛风除湿、通络止痛,佐以木瓜、丹参、当归、鸡血藤活血通络利滞,共奏湿浊去、血脉通、筋脉利之效。
本实验结果提示健脾渗湿解毒汤可有效降低HUA大鼠血清尿酸含量,且本方对HUA引起的肾脏损伤也有一定的保护作用。其使血尿酸下降的作用机理可能与其抑制尿酸重吸收蛋白URAT1表达和上调尿酸分泌蛋白OAT3表达相关。由于健脾渗湿解毒汤是首次用于降尿酸的治疗,因此对其进行体内的安全性评价显得尤为必要,本研究发现该方在发挥降尿酸作用的剂量下未见明显肝毒性,具有一定的安全性,这也为后期对该方开展临床研究奠定了基础。
