维生素D与自身免疫性甲状腺疾病的研究进展
2024-01-10宋静静樊琳琳
宋静静 樊琳琳
【摘要】 维生素D缺乏普遍存在于人群中,维生素D的经典作用与骨骼、肾脏和肠道有关。近年来研究发现,维生素D还与免疫、生殖、内分泌、肌肉及大脑、皮肤和肝脏相关。维生素D与自身免疫性甲状腺疾病(autoimmune thyroid disease,AITD)之间的关系也被广泛研究,但只有少数在人类中进行的随机临床试验研究了维生素D在预防或治疗免疫性疾病中的可能作用。本文的目的是回顾最近维生素D与AITD之间的文献,分析其可能存在的机制,以及补充维生素D在AITD中的潜在意义。
【关键词】 维生素D 自身免疫性甲状腺疾病 桥本甲状腺炎 格雷夫斯病 格雷夫斯眼病
Research Progress of Vitamin D and Autoimmune Thyroid Disease/SONG Jingjing, FAN Linlin. //Medical Innovation of China, 2023, 20(35): -188
[Abstract] Vitamin D deficiency is common in humans, and the classic effects of vitamin D are related to the bones, kidneys and intestines. In recent years, studies had found that vitamin D is also associated with immunity, reproduction, endocrine, muscle, brain, skin and liver. The relationship between vitamin D and autoimmune thyroid disease (AITD) has also been extensively studied, but only a handful of randomized clinical trials in humans have investigated the possible role of vitamin D in the prevention or treatment of immune diseases. The aim of this article was to review the recent literature on vitamin D and AITD, to analyze its possible mechanisms, and supplement the potential significance of vitamin D in AITD.
[Key words] Vitamin D Autoimmune thyroid disease Hashimoto thyroiditis Graves disease Graves' ophthalmopathy
First-author's address: Clinical Medical College of Jining Medical University, Jining 272067, China
doi:10.3969/j.issn.1674-4985.2023.35.041
自身免疫性甲狀腺疾病(autoimmune thyroid disease,AITD)是一组器官特异性自身免疫性疾病,以产生自身甲状腺抗体和淋巴细胞浸润甲状腺为特征。主要包括桥本甲状腺炎(Hashimoto thyroiditis,HT)、格雷夫斯病(Graves disease,GD)、格雷夫斯眼病(Graves' ophthalmopathy,GO)[1]。其发病机制复杂,体液免疫和细胞免疫均参与其中[2]。目前的研究发现,维生素D受体在免疫细胞上表达,它可以调节免疫细胞的增殖和分化,导致甲状腺损伤,维生素D与AITD的发生发展有关,维生素D的免疫调节作用为改善自身免疫性疾病的治疗提供了机会,补充维生素D可能会预防或延缓AITD的进展,这对临床治疗具有指导意义[3-4]。本文对维生素D与AITD关系的研究进展进行综述。
1 维生素D简述
维生素D是类固醇的衍生物,通过结合存在于人体大多数组织和细胞中的维生素D相关受体,发挥其生物学作用。维生素D的主要作用是维持钙和磷的稳态及骨骼代谢的调节。近年来国内外研究发现,维生素D在糖尿病、肠道、肾脏、代谢、免疫、肿瘤等多方面也发挥作用,可以调节激素分泌、免疫功能和细胞增殖和分化[5]。
人体内获得维生素D的三个来源:食物、皮肤局部合成和补充剂。维生素D有两种形式:常见的是维生素D2、D3,分别称为麦角钙化醇和胆钙化醇。前者是通过紫外线辐射在各种植物和真菌中产生,后者是在紫外线辐射的影响下通过7-脱氢胆固醇在皮肤中产生的[5]。两种形式的维生素D都被转运到肝脏,在肝脏中它们通过25-羟化酶(CYP27A1和CYP2R1)羟基化为25-羟维生素D3[25-(OH)D3]。肾脏进行进一步的修饰,其中25-(OH)D3通过1-α-羟化酶(CYP27B1)转化为1,25-二羟维生素D3[1,25-(OH)2D3],才能具有生物活性[6]。1,25-(OH)2D3水平受肾脏负反馈回路和24-羟化酶(CYP24A1酶)调节,使1,25-(OH)2D3失活;CYP27B1的活性受甲状旁腺激素的控制,它通过1,25-(OH)2D3和成纤维细胞生长因子23(FGF-23)的负反馈下调[3]。
血清25-(OH)D是维生素D的主要循环和储存形式,稳定性好,因此血清25-(OH)D的评估被认为是衡量全身维生素D状态的最佳标志物。最新发布的《维生素D营养状况评价及改善专家共识》中将维生素D缺乏和不足分别定义为血清25-(OH)D<12 μg/L(<30 nmol/L)和≥12 μg/L且<20 μg/L(≥30 nmol/L且<50 nmol/L)[7]。
2 维生素D的免疫调节作用
在20世纪首次发现,维生素D在免疫系统调节中发挥重要作用,其受体在树突状细胞(dendritic cell,DC)、巨噬细胞、T和B淋巴细胞及其他免疫细胞中均表达[8]。维生素D的作用机制是通过与高親和力的受体相互作用介导的,两者的相互作用可以调节先天性和适应性免疫应答,诱导免疫耐受并使自身免疫性疾病发生的风险降低[9]。低浓度的维生素D与各种自身免疫性疾病的易感性有关,其中包括AITD[6]。
2.1 维生素D与T淋巴细胞
T细胞在胸腺中分化成熟,可以根据其功能分为细胞毒性T淋巴细胞(Tc细胞),表达表面蛋白分化簇CD8,主要负责针对细胞内病原体的免疫防御和肿瘤监测;辅助T淋巴细胞(Th细胞),主要表达表面蛋白CD4;以及调节性T细胞(Treg),主要作用为引起免疫耐受[10]。
Tc细胞通常指CD8+T细胞,具有免疫功能,可以浸润甲状腺,并可通过激活CD95膜受体(Fas-FasL)诱导甲状腺细胞凋亡[11]。同样CD4+T和Treg细胞也具有免疫功能,未激活的初始CD4+T细胞为Th0,当其在局部微环境刺激调控下,可分化为不同亚型的T细胞[3,11-13]:Th1亚群可以产生白细胞介素(interleukin,IL)-2、肿瘤坏死因子-α(TNF-α)、γ-干扰素(IFN-γ)等,参与细胞介导的组织损伤反应;Th2亚群可以产生IL-4、IL-5和IL-6等,这些细胞因子能够促进Th2细胞分化,并抑制Th1细胞增殖,驱动B细胞在体液免疫反应中产生抗体;Th17细胞亚群对感染因子的免疫反应和自身免疫性疾病的维持中起作用,可产生IL-17和IL-21等细胞因子;Treg主要通过其分泌的转化生长因子-β(transforming growth factor β,TGF-β)、IL-10影响CD4+T、CD8+T细胞的细胞因子产生和增殖能力,抑制免疫炎症反应。但是CD4+T细胞对细胞因子的反应性各异:IFN-γ可诱导Th1细胞分化,但抑制Th2细胞增殖;IL-4可以诱导Th2细胞分化,但可与IL-13等一起抑制Th1细胞功能;IL-2则可同时引起Th1和Th2细胞增殖。TGF-β可以同时促进Th17及Treg分化。
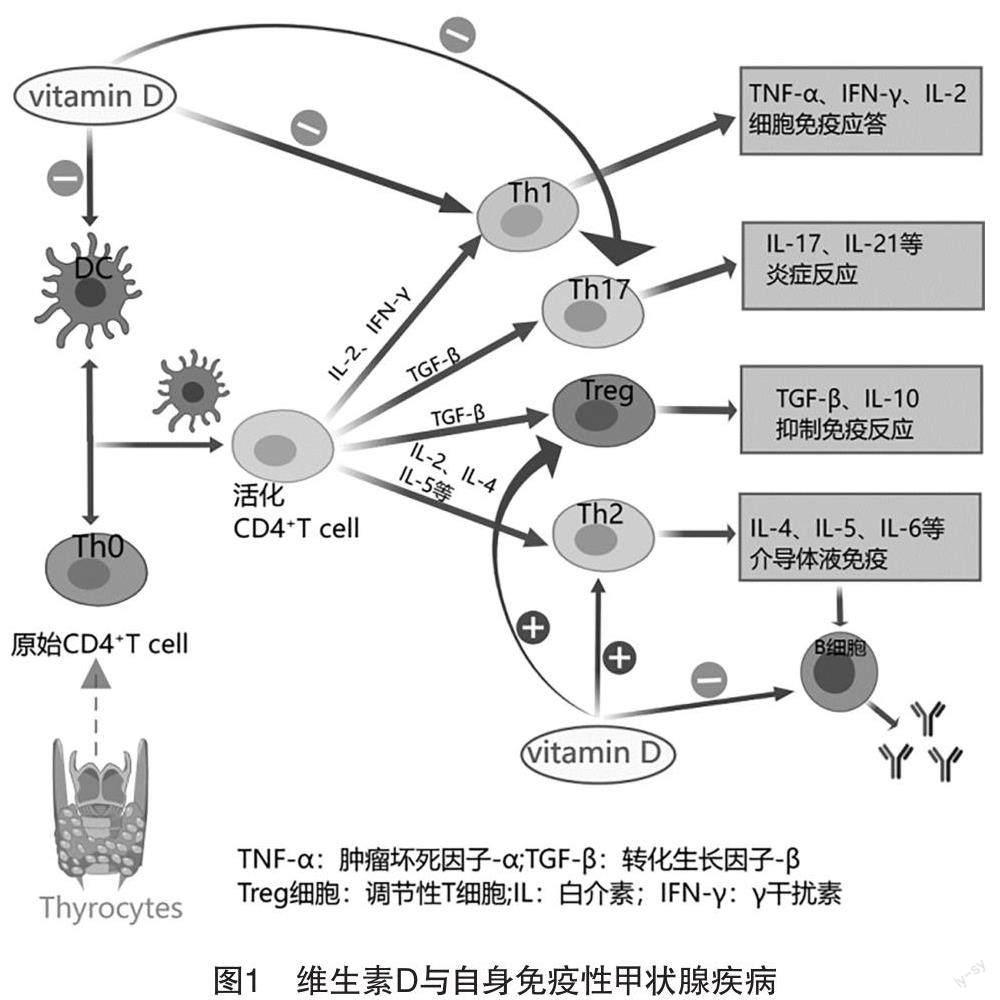
当主要组织相容性复合物(major histocompatibility complex,MHC)Ⅱ类分子呈递肽抗原时,CD4+T细胞被触发,这些分子可以在抗原呈递细胞(antigen-presenting cell,APC)上表达,DC充当T淋巴细胞的APC[2]。维生素D通过下调MHCⅡ类分子和在DC上表达的共刺激分子,从而影响T细胞活化[14]。此外,维生素D可以抑制DC的产生,使CD4+T细胞向Th1细胞的分化被抑制,向Th2细胞的分化被激活,同时促进Th1细胞向Th2细胞的转化,上调后者的活性,来调节Th1/Th2细胞比率,改变Th1/Th2平衡,限制由Th1诱导的免疫反应引起的潜在组织损伤[3]。维生素D也可以抑制CD4+T细胞向Th17细胞的分化,诱导Treg细胞生成,并上调后者活性,维生素D对Th17和Treg的以上作用,可以调控Th17/Treg的平衡失调,恢复机体Th17/Treg细胞平衡比率,发挥其免疫作用[12,15]。
2.2 维生素D与B淋巴细胞
维生素D可以调节抗体的产生并对B细胞稳态产生直接影响。一方面,维生素D可以诱导B细胞低反应性,或者直接引起B细胞凋亡,抑制记忆B细胞的产生,减少免疫球蛋白的分泌。另一方面,维生素D可能会改变CD4+T细胞反应,或通过抑制单核细胞/巨噬细胞的作用来抑制细胞因子分泌,从而间接抑制B细胞的功能[12]。此外,存在免疫调节性B细胞(regulatory B cell,Breg),它分泌的IL-10、TGF-β、Fas配体和TNF相关的凋亡诱导配体等,能够预防疾病发作和抑制免疫反应[2]。目前认为,Breg通过以下途径发挥免疫作用[13,16]:(1)Breg可以调节T细胞增殖分化,Breg和T细胞之间的相互作用控制Treg细胞的生成;(2)Breg通过抑制DC分化来抑制Th1和Th17细胞增殖;(3)Breg具有通过在慢性感染期间产生IL-10来抑制Th1免疫反应的能力;(4)Breg通过产生TGF-β细胞,进而诱导CD4+的凋亡和CD8+的无反应性。
2.3 维生素D与巨噬细胞
单核细胞和巨噬细胞是吞噬细胞,巨噬细胞可以在向T细胞提呈抗原及诱导其他APC表达共刺激分子等方面发挥作用,从而启动适应性免疫反应。在炎症初期,巨噬细胞在通过提供趋化因子和细胞因子来协调炎症反应中起关键作用,这些趋化因子和细胞因子募集并激活中性粒细胞、单核细胞和淋巴细胞[17]。维生素D可增强巨噬细胞的抗菌特性,并使适应性免疫系统的细胞趋向于免疫耐受状态,从而诱导Th1向Th2转变,并抑制DC分化和成熟[18]。
3 维生素D与自身免疫性甲状腺疾病
AITD是一组以甲状腺为靶器官的免疫性疾病,涉及的发病机制较为复杂,是由遗传和环境因素共同作用所引起的多基因疾病。其特征是对甲状腺抗原的自我耐受性破坏,导致抗体产生及淋巴细胞浸润。与其他自身免疫性疾病一样,体液及细胞免疫机制在AITD中密切相关和交联,一旦它们被触发,它们就会经历随后的反馈回路,这些回路会相互放大和延续其中一种反应,同时抑制相反的反应,因此表示AITD中涉及复杂的机制[2,11]。
近年来,越来越多的临床证据指出血清维生素D水平的高低与AITD之间存在关系[19]。当维生素D受体在各种免疫细胞上表达时,通过调节免疫细胞的增殖分化,导致甲状腺组织损伤,且其受体的多态性与AITD风险增加相关[3-4]。根据目前研究发现,维生素D可能通过以下几种途径发挥其在AITD患者中的免疫作用[6,20-22]:(1)维生素D通过下调甲状腺中人类组织相容性Ⅱ类基因的表达,抑制DC的分化和成熟,防止DC依赖性T细胞活化。(2)也可以直接抑制CD4+T细胞向Th1和Th17细胞的分化,从而抑制炎症细胞因子的分泌。通过促进CD4+T向Th2细胞的活化,同时上调Th2细胞活性及其分泌的细胞因子水平,调节Th1/Th2平衡,抑制免疫炎症反应,从而阻断自身免疫反应引起的甲状腺功能亢进。(3)通过作用于Treg,调节Th17/Treg的平衡失调,并抑制Th17细胞诱导的甲状腺炎症,避免甲状腺组织被炎症因子破坏。(4)维生素D可以通过直接或间接方式抑制B细胞大量增殖分化为浆细胞,从而抑制甲状腺自身抗体的产生,避免其引起的甲状腺组织破坏、甲状腺肿大及甲状腺激素的过度分泌等发生,降低AITD的发病风险。见图1。
3.1 维生素D与HT
HT是常见的AITD之一,其特征是由于甲状腺的自身免疫攻击与抗甲状腺球蛋白抗体(anti-thyroglobulin antibodise,TGAb)和抗甲状腺过氧化物酶抗体(antithyroid peroxidase autoantibody,TPOAb)产生相关的T和B淋巴细胞,甲状腺结构被大量淋巴细胞炎性浸润,从而导致甲状腺细胞进行性破坏[23]。常表现为无痛性甲状腺肿,伴或不伴明显的甲状腺功能减退。
HT的发病机制有待进一步明确,目前研究发现,HT的主要机制是Th1与Th2平衡失调,在HT患者中,Tc和巨噬细胞被Th1细胞激活后,浸润甲状腺组织,并且对甲状腺细胞有直接的细胞毒性破坏作用,最终导致HT的发生。此外,由于APC及Th1细胞的细胞因子刺激,甲状腺细胞表达Fas基因,它是肿瘤坏死因子基因或超基因家族中密切相关的成员,但非自身免疫性甲状腺细胞不表达Fas基因,Fas基因与甲状腺细胞表面Fas配体相互作用进而引起甲状腺细胞凋亡[24]。Th2细胞通过诱导刺激B細胞产生自身抗体TPOAb和TGAb,介导免疫反应的发生[25]。研究发现HT患者的Th17/Treg比率显著升高,可能与其发病机制相关[2]。
近年来大量临床研究表明维生素D不足或缺乏与HT之间存在关联,并且对HT患者进行维生素D治疗或补充,可能有助于延缓疾病的活动[26-30]。有研究表明血清25-(OH)D水平升高与HT风险降低相关,因此血清25-(OH)D水平每升高5 ng/mL,HT风险降低19%[31]。Mazokopakis等[32]报道了,大多数(85.3%)HT患者的血清25-(OH)D水平低与血清TPOAb水平呈负相关,对维生素D缺乏的HT患者中补充维生素D3治疗4个月后,血清TPOAb浓度显著降低。此外,一项随机双盲临床试验研究表明,与安慰剂对照组相比,维生素D补充治疗后的HT患者的TGAb和TSH激素显著降低,因此认为,维生素D有助于缓解HT患者的疾病活动[20]。然而,由于该研究样本数量小、随访时间短,还需要进一步的控制良好的、大规模的纵向研究来确定它是否可以引入临床实践。
然而有研究未能建立血清维生素D水平或其缺乏与HT受试者之间的关联。Cvek等[33]发现当将所有疾病阶段(轻度和明显)的HT患者与对照组进行比较时,维生素D水平或其缺乏症的患病率差异均无统计学意义。但是,明显的甲状腺功能减退可能与患者血清维生素D水平逐渐降低有关。一项研究指出,较低的维生素D水平与HT患者无关,但甲状腺素水平被确定为维生素D缺乏症的促成因素[34]。两项研究都存在局限,对照数量较少及横跨春季和夏季的样本收集时间,都会对结果产生影响。此外Vahabi等[35]进行了一项双盲随机安慰剂对照临床试验,选取56例HT合并维生素D缺乏患者,被随机分为维生素D治疗组和安慰剂治疗组并分别每周服用50 000 IU维生素D和安慰剂治疗,12周后,两组TSH、TPOAb均无显著变化,因此认为补充维生素D治疗可能不一定使维生素D缺乏的HT患者受益。但该研究也存在样本量较小、时间周期短的局限性。
不可忽视的是,研究对象的饮食、光照和运动等,可能会影响流行病学研究结果,导致矛盾的结果出现。因此,仍需要更多的临床证据来验证维生素D缺乏或不足与HT之间的关系,更准确地确定维生素D补充剂对HT的影响,评估是否可以将维生素D应用于临床该病的治疗。
3.2 维生素D与GD
GD是一种重要的AITD,其特征性自身抗体是TSH受体刺激性抗体(hyroid stimulating antibody,TSAb),这也是甲状腺腺外表现发病机制的决定因素。TSAb通过竞争性的结合于促甲状腺激素受体(thyroid stimulating hormone receptor antibody,TSHR),可诱导甲状腺细胞增殖、甲状腺生长和甲状腺激素大量分泌[36]。
研究发现,GD中存在Th1/Th2失衡,这可能与其发病机制有关[37]。Th1细胞选择性激活存在于IgG1亚类中的TSAb,TSAb与TSHR结合,对甲状腺细胞产生刺激,诱导其增殖、促进甲状腺生长和甲状腺激素的分泌[36]。此外,Th1细胞也可能通过分泌IL-10来诱导激活B细胞,促进浆细胞分化产生TSAb[2]。Th2细胞则通过诱导B细胞产生大量的自身抗体TSAb。TSAb水平的持续增高会刺激TSHR,引起甲状腺滤泡细胞的生长和影响其功能,从而导致甲状腺激素的产生和分泌增加,促使甲状腺肿和甲状腺功能亢进的发展[11]。Th17和Treg细胞介导的免疫性疾病也参与其中。
一系列的病例对照研究指出血清25(OH)D浓度每升高5 nmol/L,GD风险降低1.55倍[38]。Mangaraj等[39]的研究结果与此相符,GD患者的血清维生素D水平低于健康人,但是具有局限性,未排除研究对象的饮食、运动、光照时间等对维生素D的影响,并且样本量小。另外,一项关于低维生素D水平与GD病发生风险关系的meta分析,表示低水平的维生素D可能会增加GD的发生风险,且GD患者低水平维生素D与促甲状腺激素受体抗体(thyroid stimulating hormone receptor antibody,TRAb)滴度升高及甲状腺自身免疫功能有关[40]。而Planck等[41]的研究与此存在分歧,GD患者发病时的维生素D水平明显低于普通人群,但GD患者的甲状腺功能、TPOAb、TRAb水平及终止抗甲状腺药物治疗后1年内的复发率,均与其维生素D水平无明显相关性。
关于纠正维生素D水平能否降低GD的发生风险或对该病起到辅助治疗作用,目前研究较少。一项前瞻性研究表明,对初诊GD患者使用甲巯咪唑(methimazole,MMI)联合1-α-羟基维生素D3治疗,可以减少MMI用量,降低血清中TRAb水平,且治疗24周后未出现高钙、高磷血症等不良反应[42]。维生素D的辅助治疗可能是高滴度TRAb GD的治疗新策略。此外,国外一项研究认为,每日补充维生素D可能会延迟发病时间,但似乎不能预防疾病复发。但以上研究具有局限性[43]。虽然现有大多数研究表明,GD患者广泛缺乏维生素D,维生素D参与GD的发生和发展,但未来仍需要大规模研究来进一步阐明研究结果。
3.3 维生素D与GO
GO是AITD最常见的甲状腺外表现之一,可能发生在高达25%的GD患者,在慢性自身免疫性甲状腺炎甲减患者中也有发生。其发病机制尚未完全明确,目前认为,GO患者体内存在针对甲状腺与眼眶发生交叉反应的抗原[主要是TSHR和胰岛素样生长因子1受体(insulin-like growth factor-1 receptor,IGF-1R)]的自身抗体,自身抗体可能通过细胞毒作用、刺激靶细胞及抗体中和等作用造成病理损伤[44]。
目前研究认为,活化的T细胞,主要是CD4+T及其产生的细胞因子均参与GO的发病[45]。(1)Th1介导的细胞免疫反应,在早期、活动期占主导地位,其分泌的细胞因子能够增强成纤维细胞(fibroblast,OF),主要表达TSHR、IGF-1R增殖分化,可产生透明质酸导致成纤维细胞增生、糖胺聚糖合成和脂肪增生,即眼眶组织重塑[46-47]。(2)而Th2在后期、非活动期占主导地位,其主要的自身抗原介导信号转导通路相互作用,产生大量的糖胺聚糖[46-47]。(3)Th17细胞刺激OF的促炎细胞因子和共刺激分子(CD40和MHCⅡ)的表达并调节纤维化OF亚群的脂肪生成;同时,OF通过前列腺素2诱导Th17细胞分化和功能,增加眼眶炎症反应[48]。(4)Treg细胞也参与其中,其功能异常可能与眼眶炎症的扩大有关[45]。(5)同时CD4+T细胞可以产生多种黏附分子,与受刺激的OF分泌的趋化因子和黏附分子共同作用,介导更多淋巴细胞向眼眶组织的募集及OF和T细胞之间的进一步相互作用[49]。(6)通过激活B细胞,刺激自身抗体(包括刺激、阻断和中和亚型)的产生,进而识别并攻击眼眶中的脂肪结缔组织[45]。
维生素D不足可能导致免疫系统活动紊乱,而在GO患者中也发现了血清维生素D水平的降低。Sadaka等[50]进行的一项回顾性研究发现,GO患者中维生素D缺乏和不足的患病率分别为20%和31%,然而,这些结果是使用相对较小的样本量获得的,并且与临床疾病活动没有相关性。另一项回顾性病例对照研究认为血清维生素D缺乏是GO的独立危险因素,低血清维生素D与GO诊断相关[51]。为了预防GO的进展,维生素D水平的评估及其补充可能在GD病的早期管理中發挥至关重要的作用。根据当前的研究认为维生素D与GO相关,但是证据有限。未来需要纵向研究和前瞻性临床试验,以进一步探索观察到的关联机制。
4 总结与展望
目前关于维生素D和AITD之间关系的研究结果不尽一致,但是大多数研究表明低水平的维生素D会增加AITD的发病风险。当AITD发病后,其后果可能会产生恶性循环,加剧维生素D缺乏,进而加剧自身免疫的进程,未来仍需要进行长期的随机对照研究,来证实AITD与维生素D之间的因果关系。另外,维生素D辅助治疗可能延缓疾病进展和缓解症状,但值得注意的是,补充高剂量维生素D可能会增加骨折风险、不利于肌肉力量恢复及导致高钙血症等其他问题的风险增加[52]。因此,有必要进一步的研究来确定最佳的维生素D水平,评估维生素D在预防或治疗AITD中的可行性,为以后的预防或治疗提供新思路。
參考文献
[1] ANTONELLI A,FERRARI S M,RAGUSA F,et al.Graves' disease: epidemiology, genetic and environmental risk factors and viruses[J].Best Pract Res Clin Endocrinol Metab,2020,34(1):101387.
[2] RYDZEWSKA M,JAROMIN M,PASIEROWSKA I E,et al.Role of the T and B lymphocytes in pathogenesis of autoimmune thyroid diseases[J].Thyroid Res,2018,11:2.
[3] SKROBOT A,DEMKOW U,WACHOWSKA M.Immunomodulatory role of vitamin D: a review [J].Adv Exp Med Biol,2018,1108:13-23.
[4] ALTIERI B,MUSCOGIURI G,BARREA L,et al.Does vitamin D play a role in autoimmune endocrine disorders? A proof of concept[J].Rev Endocr Metab Disord,2017,18(3):335-346.
[5] BIKLE D.Nonclassic actions of vitamin D[J].J Clin Endocrinol Metab,2009,94(1):26-34.
[6] KIM D.The role of vitamin D in thyroid diseases[J].Int J Mol Sci,2017,18(9):1949.
[7]中国营养学会健康管理分会.维生素D营养状况评价及改善专家共识[J].中华健康管理学杂志,2023,17(4):245-252.
[8] LANG P O,ASPINALL R.Can we translate vitamin D immunomodulating effect on innate and adaptive immunity to vaccine response?[J].Nutrients,2015,7(3):2044-2060.
[9] D'AURIZIO F,VILLALTA D,METUS P,et al.Is vitamin D a player or not in the pathophysiology of autoimmune thyroid diseases?[J].Autoimmun Rev,2015,14(5):363-369.
[10] MESQUITA J?NIOR D,ARA?JO J A,CATELAN T T,et al.Immune system-part Ⅱ: basis of the immunological response mediated by T and B lymphocytes[J].Rev Bras Reumatol,2010,50(5):552-580.
[11] RAMOS-LEV? A M,MARAZUELA M.Pathogenesis of thyroid autoimmune disease: the role of cellular mechanisms[J].Endocrinol Nutr,2016,63(8):421-429.
[12] ZHOU L,WANG J,LI J,et al.1,25-Dihydroxyvitamin D3ameliorates collagen-induced arthritis via suppression of Th17 cells through miR-124 mediated inhibition of IL-6 signaling[J].Front Immunol,2019,10:178.
[13] KRISTENSEN B.Regulatory B and T cell responses in patients with autoimmune thyroid disease and healthy controls[J].Dan Med J,2016,63(2):B5177.
[14] BAEKE F,TAKIISHI T,KORF H,et al.Vitamin D: modulator of the immune system[J].Curr Opin Pharmacol,2010,10(4):482-496.
[15] GORMAN S,FISHER S A,RAHIMZADEH M,et al.The role of vitamin D in increasing circulating T regulatory cell numbers and modulating T regulatory cell phenotypes in patients with inflammatory disease or in healthy volunteers: a systematic review[J/OL].PLoS One,2019,14(9):e0222313.https://pubmed.ncbi.nlm.nih.gov/31550254/.
[16] ROSSER E C,MAURI C.Regulatory B cells: origin, phenotype, and function[J].Immunity,2015,42(4):607-612.
[17] VAROL C,MILDNER A,JUNG S.Macrophages: development and tissue specialization[J].Annu Rev Immunol,2015,33:643-675.
[18] BIZZARO G,SHOENFELD Y.Vitamin D and thyroid autoimmune diseases: the known and the obscure [J].Immunol Res,2015,61(1-2):107-109.
[19] KHOZAM S A,SUMAILI A M,ALFLAN M A,et al.Association between vitamin D deficiency and autoimmune thyroid disorder: a systematic review[J/OL].Cureus,2022,14(6):e25869.https://pubmed.ncbi.nlm.nih.gov/35836431/.
[20] CHAHARDOLI R,SABOOR-YARAGHI A A,AMOUZEGAR A,et al.Can supplementation with vitamin D modify thyroid autoantibodies (anti-TPO Ab, anti-Tg Ab) and thyroid profile (T3, T4, TSH) in Hashimoto's Thyroiditis? A double blind, randomized clinical trial[J].Horm Metab Res,2019,51(5):296-301.
[21] TAMER G,ARIK S,TAMER I,et al.Relative vitamin D insufficiency in Hashimoto's thyroiditis[J].Thyroid,2011,21(8):891-896.
[22] L BISHOP E,ISMAILOVA A,DIMELOE S,et al.Vitamin D and immune regulation: antibacterial, antiviral, anti-inflammatory[J/OL].JBMR Plus,2021,5(1):e10405.https://pubmed.ncbi.nlm.nih.gov/32904944/.
[23] RALLI M,ANGELETTI D,FIORE M,et al.Hashimoto's thyroiditis: an update on pathogenic mechanisms, diagnostic protocols, therapeutic strategies, and potential malignant transformation[J].Autoimmun Rev,2020,19(10):102649.
[24] VASCONCELOS J C,SIQUEIRA I B,MAIA F F R,et al.Influence of thyroid hormone in the expression of the marker pro-apoptosis BID, in spite of the predominance of anti-apoptosis activation in intratiroidal lymphocytic infiltration in Hashimoto's thyroiditis[J].Mol Cell Endocrinol,2021,537:111421.
[25] BERGHI N O.Immunological mechanisms implicated in the pathogenesis of chronic urticaria and Hashimoto thyroiditis[J].Iran J Allergy Asthma Immunol,2017,16(4):358-366.
[26] ?TEFANI? M,TOKI? S.Serum 25-hydoxyvitamin D concentrations in relation to Hashimoto's thyroiditis: a systematic review, meta-analysis and meta-regression of observational studies[J].Eur J Nutr,2020,59(3):859-872.
[27] TURASHVILI N,JAVASHVILI L,GIORGADZE E."Vitamin D deficiency is more common in women with autoimmune thyroiditis: a retrospective study"[J].Int J Endocrinol,2021,2021:4465563.
[28] BAKR H G,MEAWED T E.Relevance of 25 (OH) vitamin D deficiency on Hashimoto's thyroiditis [J].Egypt J Immunol,2017,24(2):53-62.
[29] TAHERINIYA S,ARAB A,HADI A,et al.Vitamin D and thyroid disorders: a systematic review and meta-analysis of observational studies[J].BMC Endocr Disord,2021,21(1):171.
[30]向茜,张弦,李万碧,等.桥本甲状腺炎患者117例25羟维生素D水平分析 [J/OL].中华临床医师杂志:电子版,2017,11(9):1478-1482.http://qikan.cqvip.com/Qikan/Article/Detail?id=90768968504849554857484854&from=Qikan_Search_Index.
[31] MANSOURNIA N,MANSOURNIA M A,SAEEDI S,et al.The association between serum 25OHD levels and hypothyroid Hashimoto's thyroiditis[J].J Endocrinol Invest,2014,37(5):473-476.
[32] MAZOKOPAKIS E E,PAPADOMANOLAKI M G,TSEKOURAS K C,et al.Is vitamin D related to pathogenesis and treatment of Hashimoto's thyroiditis?[J].Hell J Nucl Med,2015,18(3):222-227.
[33] CVEK M,KALI?ANIN D,BARI? A,et al.Vitamin D and Hashimoto's thyroiditis: observations from CROHT biobank[J].Nutrients,2021,13(8):2793.
[34] BOTELHO I M B,MOURA NETO A,SILVA C A,et al.Vitamin D in Hashimoto's thyroiditis and its relationship with thyroid function and inflammatory status[J].Endocr J,2018,65(10):1029-1037.
[35] VAHABI ANARAKI P,AMINORROAYA A,AMINI M,et al.Effect of vitamin D deficiency treatment on thyroid function and autoimmunity markers in Hashimoto's thyroiditis: a double-blind randomized placebo-controlled clinical trial[J].J Res Med Sci,2017,22:103.
[36] KOTWAL A,STAN M.Thyrotropin receptor antibodies-an overview[J].Ophthalmic Plast Reconstr Surg,2018,34(4S Suppl 1):S20-S27.
[37] ESHAGHKHANI Y,SANATI M H,NAKHJAVANI M,et al. Disturbed Th1 and Th2 balance in patients with Graves' disease [J].Minerva Endocrinol,2016,41(1):28-36.
[38] MA J,WU D,LI C,et al.Lower serum 25-hydroxyvitamin D level is associated with 3 types of autoimmune thyroid diseases[J/OL].Medicine (Baltimore),2015,94(39):e1639.https://pubmed.ncbi.nlm.nih.gov/26426654/.
[39] MANGARAJ S,CHOUDHURY A K,SWAIN B M,et al.Evaluation of vitamin D status and its impact on thyroid related parameters in new onset Graves' disease-a cross-sectional observational study[J].Indian J Endocrinol Metab,2019,23(1):35-39.
[40] ZHANG H,LIANG L,XIE Z.Low vitamin D status is associated with increased thyrotropin-receptor antibody titer in Graves disease[J].Endocr Pract,2015,21(3):258-263.
[41] PLANCK T,SHAHIDA B,MALM J,et al.Vitamin D in Graves disease: levels, correlation with laboratory and clinical parameters, and genetics[J].Eur Thyroid J,2018,7(1):27-33.
[42]余靖,王婉茹,孫志纯,等.甲巯咪唑联合1α-羟基维生素D3治疗高滴度TRAb Graves病的疗效研究[J].中国医师杂志,2021,23(8):1214-1218.
[43] CHO Y Y,CHUNG Y J.Vitamin D supplementation does not prevent the recurrence of Graves' disease[J].Sci Rep,2020,10(1):16.
[44] KRIEGER C C,NEUMANN S,GERSHENGORN M C.TSH/IGF1 receptor crosstalk: mechanism and clinical implications[J].Pharmacol Ther,2020,209:107502.
[45] HUANG Y,FANG S,LI D,et al.The involvement of T cell pathogenesis in thyroid-associated ophthalmopathy[J].Eye (Lond),2019,33(2):176-182.
[46]叶小珍,王坚.成纤维细胞在Graves眼病发病机制中的作用及相关免疫治疗[J].中国全科医学,2009,12(11):1016-1018.
[47] TAYLOR P N,ZHANG L,LEE R W J,et al.New insights into the pathogenesis and nonsurgical management of Graves orbitopathy[J].Nat Rev Endocrinol,2020,16(2):104-116.
[48] FANG S,HUANG Y,ZHONG S,et al.Regulation of orbital fibrosis and adipogenesis by pathogenic Th17 cells in Graves orbitopathy[J].J Clin Endocrinol Metab,2017,102(11):4273-4283.
[49] DIK W A,VIRAKUL S,VAN STEENSEL L.Current perspectives on the role of orbital fibroblasts in the pathogenesis of Graves' ophthalmopathy[J].Exp Eye Res,2016,142:83-91.
[50] SADAKA A,NGUYEN K,MALIK A,et al.Vitamin D and selenium in a thyroid eye disease population in texas[J].Neuroophthalmology,2019,43(5):291-294.
[51] HEISEL C J,RIDDERING A L,ANDREWS C A,et al.Serum vitamin D deficiency is an independent risk factor for thyroid eye disease[J].Ophthalmic Plast Reconstr Surg,2020,36(1):17-20.
[52] SANDERS K M,NICHOLSON G C,EBELING P R.Is high dose vitamin D harmful?[J].Calcif Tissue Int,2013,92(2):191-206.
(收稿日期:2023-03-24) (本文編辑:白雅茹)
①济宁医学院临床医学院 山东 济宁 272067
②山东省济宁市第一人民医院
通信作者:樊琳琳
