miR-25通过调节TGF-β信号传导通路促进胃癌细胞增殖和转移*
2024-01-10宋钉町马博曹博威来比江吾斯曼张文斌
宋钉町 马博 曹博威 来比江·吾斯曼 张文斌
胃癌(gastric cancer,GC)是胃肠道一种常见的恶性疾病,相关统计显示,胃癌已成为全球第五大癌症,是继肺癌、结直肠癌和肝癌的第四大死亡原因[1]。在我国,尽管胃癌的发病率和死亡率都在下降,但仍处于世界较高水平,且存在性别和年龄差异,疾病负担集中在高龄人群,而我国的人口老龄化逐渐加重,了解其可能的发病机制,并实施精准性防控策略刻不容缓[2-3]。随着现代分子生物学的不断发展,microRNA(miRNA)在胃癌的早期诊断、疾病干预和预后评价中发挥了越来越重要的作用。miRNA 是单链、高度保守的小分子非编码RNA,含有20~24 个寡核苷酸,以组织特异性的方式表达。miRNA 主要是通过与目标mRNA 3'非编码区的碱基配对进行交互作用,利用mRNA 的降解或翻译抑制,对目标基因的表达进行调控,到现在为止,人们已经发现,多达30%的人类基因的表达都受到它的调控,并对人体生长发育,细胞增殖、凋亡,以及新陈代谢等重要的生理过程产生影响[4-5]。胃癌的增殖与转移是一个多步骤、多阶段、多因素调控的持续而复杂的生物学过程,在此过程中miRNA 发挥着重要的作用[6],但其机制尚不明确。因此,我们将以人胃癌细胞SGC-7901 为切入点,从细胞和分子两个层面,深入探讨miR-25 在人胃癌细胞SGC-7901 增殖、侵袭、迁移、凋亡等方面的作用及其可能的作用机制,为阐明miR-25在胃癌发生发展中的作用奠定基础。
1 材料与方法
1.1 材料
人胃癌细胞SGC-7901 购自普诺赛(货号:CL-0206),采用上海生工生物工程股份有限公司制备的miR-25 及内参U6 引物,使用从杭州朗基科技仪器有限公司采购的荧光PCR 定量分析(型号:Q2000B),使用Elabscience 公司生产的Annexin V-APC/7-AAD 双染法细胞凋亡检测试剂盒(货号:E-CK-A218),从合肥白鲨生物科技有限公司购入总RNA 提取试剂(货号:BS259A),自北京凯奥科技发展有限公司购入酶标仪及超微量分光光度计(型号:K5800),CCK-8(货号:BA00208)、beta-Actin(货号:bs-0061R)、转化生长因子-β(TGF-β)抗体(货号:bs-0086R)均购于中国Bioss 公司,从Solarbio 公司购入BCA 蛋白浓度测定试剂盒(货号:PC0020),细胞流式仪(型号:LSRII)购自BD 公司。
1.2 实验方法
1.2.1 细胞培养 将冻存的人胃癌细胞SGC-7901从液氮罐中取出,37 ℃水浴锅中解冻复苏,室温下每分钟1 000 r,离心5 min,弃去上清液,转入60 mm 的细胞培养皿中,5% CO2培养箱中继续培养。在显微镜下观察人胃癌细胞SGC-7901 的生长密度,达到细胞培养皿面积的90%左右时,用无菌磷酸盐缓冲液(PBS)洗涤2 次,0.25%胰蛋白酶消化后传代培养。
1.2.2 细胞转染及分组 6 孔板一个孔接种(1~4)×105个对数期生长的贴壁细胞,37 ℃培养过夜,第二天观察细胞密度在40%~60%时,进行慢病毒感染。根据人胃癌细胞SGC-7901 的MOI=10,分别往细胞中加入滴度为1×108TU/mL 的空载慢病毒和干扰慢病毒200 µL,分别设置正常组、miR-25 干扰慢病毒组和miR-25 干扰慢病毒空载组。
1.2.3 实时荧光定量PCR(qRT-PCR)检测miR-25的转染效率 收集3 组人胃癌细胞SGC-7901,提取总RNA 并检测纯度及浓度。遵逆转录试剂盒说明将miRNA 逆转录为cDNA。 基于GenBank数据库中的序列设计miR-25 的qRT-PCR 引物(F-CATTGCACTTGTCTCGGTCTGA) 及U6 的qRTPCR 引物(F-AGCACATATACTAAAATTGGAACGAT),PCR 扩增以cDNA 为模板进行。反应程序为:95 ℃5 min,95 ℃ 30 s,60 ℃ 1 min,45 个循环,反应体系为10 µL。将提取的RNA 吸取2 µL 用超微量分光光度计测定RNA 浓度。每组实验重复3 次,取平均值。
1.2.4 细胞增殖实验(cell counting kit-8,CCK-8)慢病毒感染成功后,在96 孔平板中接种细胞[(1~2)×104细胞]并培养24 h,在每个孔中添加10 µL 的CCK-8 溶液,并持续在培养箱中温育1~4 h。酶标仪检测450 nm 波长下各孔的吸光值,计算细胞存活率。实验重复3 次,取平均值。
1.2.5 Transwell 法检测细胞侵袭 Matrigel 胶按1∶8的比例用RPMI 1640 培养基稀释,将Transwell 小室底部膜覆盖在上室表面,在37 ℃下放置4 h,让Matrigel 聚合为凝胶,对细胞进行2~3 min 的消化,然后停止消化,离心,将培养基取出,用PBS 冲洗2 次,再用无血清的培养基重新悬浮。将细胞密度调节到每毫升1.0×105。在Transwell 小室内添加100 µL 的细胞悬液。在24 孔平板下腔中添加750 µL 含血清的培养基,将小腔置于平板中,置于5% CO2培养箱中,37 ℃培养24 h。
1.2.6 细胞划痕实验(cell scratch assay) 检测细胞迁移能力,用marker 笔在6 孔板背后,每隔1 cm均匀的划一条横穿过孔的基准线,取对数生长期细胞消化重悬为细胞悬液,约5×105个细胞每孔的密度接种至6 孔板内,继续培养至细胞贴壁。使用同一20 µL 枪头以直尺辅助垂直基准线划痕,使不同孔之间的划痕宽度尽量一致,使用PBS 清洗3 次,去除游离细胞,观察划痕处清晰笔直且无细胞残留,以基准线辅助拍摄0、24 h 照片。计算公式:伤口愈合百分比=[初始面积(0 h)-24 h 的面积]/初始面积×100%。
1.2.7 细胞凋亡实验 将转染后的不同组分的细胞,用胰蛋白酶消化后,用Annexin V-APC/7-AAD染色,用流式细胞仪测定细胞的凋亡率。
1.2.8 蛋白质印迹法(western blotting) 完成细胞蛋白抽提后,严格按照BCA 蛋白浓度测定试剂盒说明书进行蛋白定量,以目标蛋白的分子量为依据,选用10%配胶试剂盒配胶,待检测蛋白样品上样量为20 µg/孔,待胶凝固之后,将胶连同玻璃板从架子上拿下,装进电泳内槽中,加样面向内,将内槽放进电泳外槽中,在内槽中加满电泳液(要注意内槽安装的密封性,避免漏液),在外槽中加入电泳液到内槽高度约1/3 处。接上电源,用50~85 V的低压让试样穿过浓缩胶,30 min 后,等蛋白质分子达到分离胶时,再把电压提高到100~130 V,直至溴酚蓝达到胶体的最底面(大约1.5 h),切断电源,停止电泳,封闭,转模,温育,然后把试样放到胶体成像仪上进行图像处理,并拍照记录。
1.3 统计学处理
所得数据均以SPSS 26.0 统计软件处理。计量资料以(±s)表示,两组间比较用t 检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 各组细胞转染后miR-25 的表达水平
与正常组miR-25 表达水平[(1.003±0.098)%]相比,miR-25 干扰慢病毒组[(0.287±0.122)%]明显更低,差异有统计学意义(t=10.160,P<0.05);正常组与miR-25 干扰慢病毒空载组miR-25 表达水平[(0.803±0.151)%]比较,差异无统计学意义(t=0.026,P>0.05)。见图1。
2.2 抑制miR-25 表达对人胃癌细胞SGC-7901 增殖的影响
与正常组增殖率[(100±0)%]相比,miR-25干扰慢病毒组[(64.81±8.67)%]明显更低,差异有统计学意义(t=10.260,P<0.05);正常组与miR-25干扰慢病毒空载组增殖率[(93.17±9.49)%]比较,差异无统计学意义(t=0.039,P>0.05)。
2.3 Transwell 检测细胞侵袭性结果
将Transwell 小室放入显微镜下,随机选择3 个视野,计算通过基底膜的细胞数目。与对照组[(287.7±11.5)个]相比,miR-25 干扰慢病毒组侵袭能力[(190.7±10.02)个]明显降低,差异有统计学意义(t=3.201,P<0.05);正常组与miR-25 干扰慢病毒空载组的侵袭能力[(304±10.58)个]比较,差异无统计学意义(t=0.039,P>0.05)。见图2。
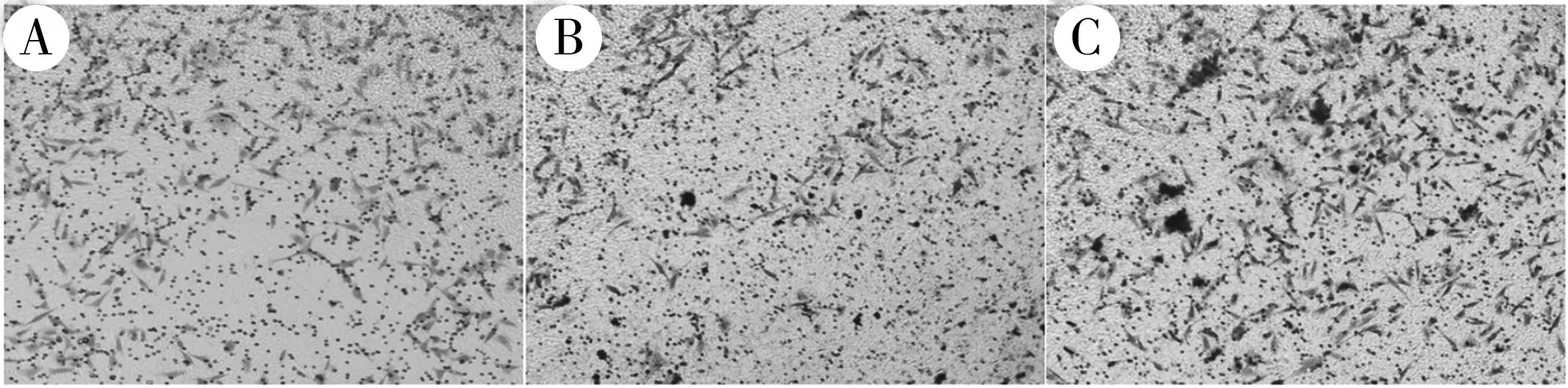
图2 各组细胞侵袭结果
2.4 细胞划痕实验检测细胞迁移能力结果
完成实验后,从0、24 h 两个时间点,观察细胞迁移的面积(200×),进而计算迁移率。与对照组迁移率[(69.53±7.34)%]相比,miR-25 干扰慢病毒组[(46.56±9.251)%]明显更低,差异有统计学意义(t=5.251,P<0.05);正常组与miR-25 干扰慢病毒空载组的迁移率[(61.845±9.759)%]比较,差异无统计学意义(t=0.477,P>0.05)。见图3。
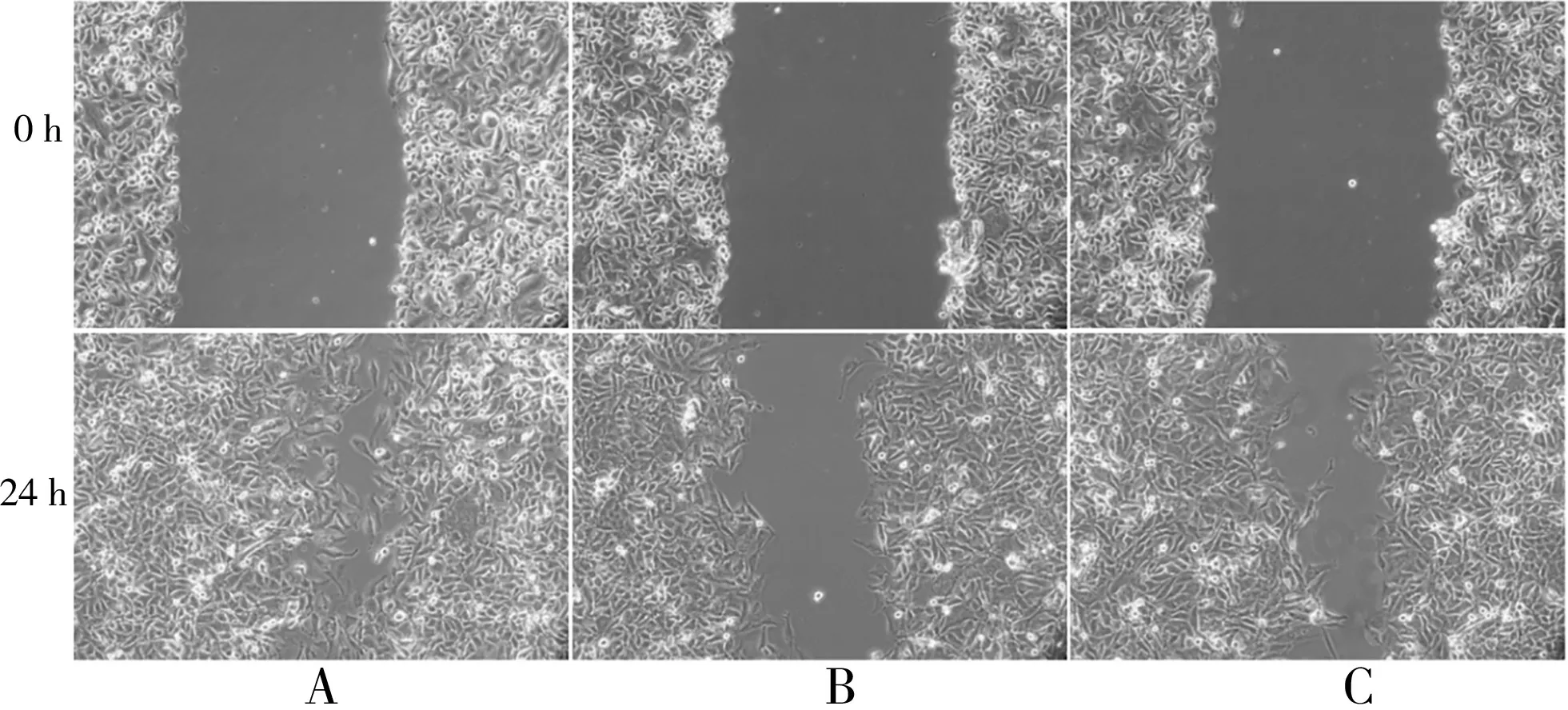
图3 各组细胞划痕结果
2.5 人胃癌细胞SGC-7901 凋亡结果
与正常组细胞凋亡率[(15.13±3.36)%]相比,miR-25 干扰慢病毒组[(22.17±3.15)%]更高,差异有统计学意义(t=6.591,P<0.05);正常组与miR-25 干扰慢病毒空载组细胞凋亡率迁移率[(15.360±0.821)%] 比较,差异无统计学意义(t=0.004,P>0.05)。流式图Q1 表示这一部分的细胞是坏死的,但也可能存在少量的后期凋亡的细胞或是被机械破坏的细胞。Q2 代表此区域的细胞为晚期凋亡细胞。Q3 代表此区域的细胞为活细胞。Q4 代表此区域的细胞为早期凋亡细胞。见图4。
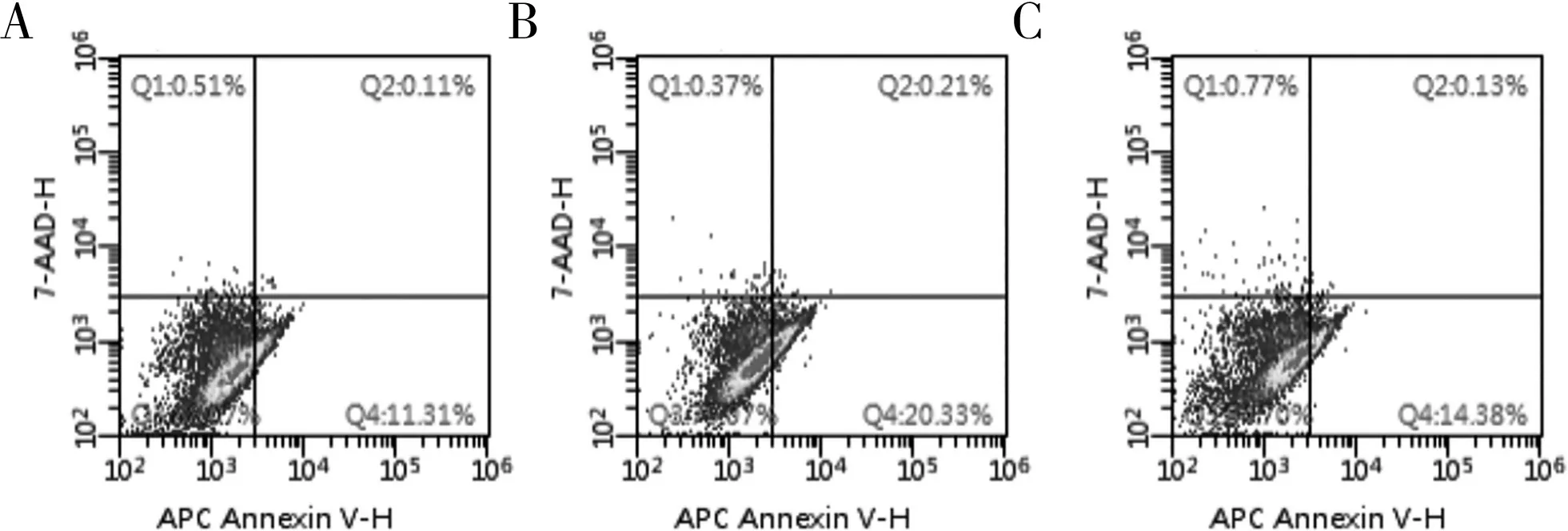
图4 各组SGC-7901细胞凋亡结果
2.6 人胃癌细胞SGC-7901 中TGF-β 蛋白表达情况
与正常组TGF-β 蛋白表达量[(0.610±0.03)mg/mL]相比,miR-25 干扰慢病毒组[(0.751±0.03)mg/mL]显著增加,差异有统计学意义(t=6.501,P<0.05);正常组与miR-25 干扰慢病毒空载组的TGF-β 蛋白表达量[(0.751±0.030)mg/mL]比较,差异无统计学意义(t=0.485,P>0.05)。各组样本中TGF-β 蛋白表达量条带见图5。
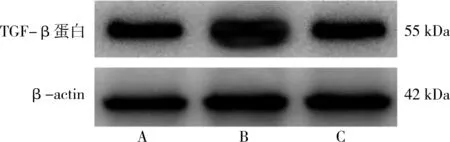
图5 各组样本中TGF-β蛋白表达量条带图
3 讨论
越来越多的研究表明,miRNA 的表达异常与多种恶性肿瘤发生发展、远处转移及预后密切相关[7-11]。miR-25 定位在人7q22.1 染色体上的miRNA-7 上[12],Guo 等[7]的研究表明miR-25 通过直接抑制B 细胞易位基因2(BTG2)的表达促进食管鳞状细胞癌的进展,miR-25 的敲除有助于抑制食管癌细胞的增殖和转移。有研究发现食管癌患者血浆外泌体中的miR-25 表达水平明显高于健康人群,且与食管癌组织中的表达量呈正相关,提示外泌体miR-25 可作为食管癌早期诊断的生物标志物[13]。Hesari 等[14]对乳腺癌患者的研究表明,miR-25 的表达降低与其临床分期、转移和生存时间显著相关。有研究发现,miR-25 在非小细胞肺癌患者血清中的表达水平与外周浸润、病理分级、肿瘤直径、TNM 分期、淋巴结转移等临床特点有很强的相关性,它还会对患者的5 年生存率产生影响,可以作为评价患者预后的一种重要的肿瘤标志物。我国学者对结肠癌的一项研究显示,miR-25-3p 在结肠癌患者中明显增高,且与患者的临床病理指标呈正相关,是结肠癌诊断及判断患者预后的潜在标志物[15]。miR-25是一个在胃癌组织中高表达的微小RNA,我们的实验结果表明,下调miR-25 可显著抑制人胃癌细胞SGC-7901 的增殖、迁移和侵袭能力,并诱导其凋亡。本项目拟深入研究miR-25 对胃癌侵袭转移的影响,并在分子水平上阐明其可能的作用机制。
TGF-β 信号传导在包括癌症在内的炎症性疾病的进展中发挥了重要作用。TGF-β 通过抑制细胞生长和刺激细胞凋亡来维持哺乳动物组织的稳态。癌细胞过度产生TGF-β 导致局部纤维化和免疫抑制微环境,促进肿瘤生长,并与癌细胞的侵袭性和转移性行为相关[16]。人体内大多数有核细胞都有分泌TGF-β 的能力,在癌症发生时,TGF-β 主要由肿瘤浸润区的肿瘤细胞、基质细胞和巨噬细胞分泌[17],主要是通过上皮细胞-间充质转化(EMT)来促进肿瘤的发生和发展[18],在此信号途径被活化之后,可以使上皮细胞更具有侵袭性,从而增加上皮细胞的生长速度和迁移能力[19]。同时,TGF-β通过刺激B 淋巴细胞和T 淋巴细胞凋亡,引发肿瘤微环境的免疫抑制,阻止肿瘤内浸润免疫细胞的激活,让肿瘤逃脱宿主免疫的监视[20-21]。有研究表明,阻断TGF-β 信号通路可有效阻止癌细胞在体内发生EMT[22]。一项关于胰腺癌(PC)的研究表明,在PC 早期,TGF-β 是一种具有抑制细胞增殖,诱导细胞凋亡,激活自噬,通过基质成纤维细胞抑制生长因子信号传导,抑制炎症,抑制血管生成,从而保持正常组织动态平衡的重要的肿瘤抑制因子,而在PC 晚期,通过诱导EMT 逃避细胞凋亡,从而促进肿瘤微环境的形成,促进晚期肿瘤的进展[23-24]。但TGF-β 对早期肿瘤的抑制作用如何被癌细胞的侵袭性和转移性反应所取代的机制尚不明确[25]。由于TGF-β 的表达与不良预后相关,且其转导途径不同于细胞因子,因此TGF-β 及其信号转导途径为靶向治疗提供了新思路,目前研究最广泛的化合物是TβRⅠ抑制剂Galunisertib,也被称为LY2157299,已被证明具有在体外抑制肺癌和乳腺癌细胞生长的作用[26]。
为进一步证实并探讨miR-25 对TGF-β 信号传导通路促进胃癌增殖和转移的影响,本研究通过降低胃癌细胞miR-25 表达并对人胃癌细胞SGC-7901 进行了TGF-β 蛋白的测定,结果发现在miR-25 干扰慢病毒组中,TGF-β 蛋白表达量显著增加。进一步验证,miR-25 通过TGF-β 信号传导通路促进胃癌增殖和转移。但本研究未展开探讨miR-25 调控TGF-β 信号传导通路促进胃癌增殖和转移的具体机制及其是否对除早期生长反应蛋白2(EGR2)[27]、富含半胱氨酸蛋白(RECK)[28]、磷酸酶与张力蛋白同源物基因(PTEN)[29]、BTG2[30]等已知的基因以外的某些基因具有靶向调控作用从而促进胃癌的发生发展,这将是后续实验的研究重点。
综上所述,miR-25 表达下调可显著抑制人胃癌细胞SGC-7901 的增殖、迁移和侵袭能力,并可促进其凋亡,从分子水平进一步阐明胃癌侵袭、转移的可能机制,本研究将有助于深入理解胃癌的发病机理,并可能为胃癌的防治提供新的思路。
