利用CRISPR/Cas9系统建立成体心肌细胞特异性Oga基因敲除小鼠模型
2024-01-10徐京平李振华
辛 充 徐京平 常 劲 王 凡 王 剑 杨 晓 李振华
(1.辽宁大学生命科学学院,沈阳 110031) (2.军事科学院军事医学研究院生命组学研究所,北京 102206) (3.中国人民解放军总医院,北京 100039)
以冠心病、心力衰竭(心衰)等为代表的心脏疾病是威胁人类健康的头号杀手,在全球范围内造成了巨大的健康和经济负担,成为日益严重的公共卫生问题并持续成为领域内研究热点[1]。探索心脏疾病的致病机制,发现影响心脏稳态的关键基因,将为心脏疾病治疗带来新的希望。
蛋白质O-连接的β-N-乙酰基葡糖胺修饰(O-GlcNAcylation)是一种重要的蛋白质翻译后修饰方式,在心脏稳态维持中发挥了至关重要的功能。细胞内的两种关键酶O-GlcNAc转移酶(O-GlcNAc transferase,OGT)和O-GlcNAc糖苷酶(O-GlcNAcase,OGA) 参与了这一修饰过程[2]。在主动脉引起的心肌肥厚和左冠状动脉结扎引起的心肌梗死大鼠模型中,O-GlcNAcylation水平都有显著升高,提示O-GlcNAcylation异常升高可能在心脏疾病发生过程中发挥关键功能[3]。研究团队发现心肌细胞特异性敲除蛋白精氨酸甲基转移酶5(Prmt5)会影响Oga的转录及剪切,使Oga基因表达下降和O-GlcNAcylation水平异常升高,最终导致扩张型心肌病,而通过腺相关病毒AAV9恢复心肌细胞内Oga基因的表达可以缓解Prmt5敲除小鼠的扩张型心肌病表型[4]。然而,目前尚缺乏利用建立成体心肌细胞特异性Oga敲除小鼠,来研究OGA对心脏功能影响的报道。
CRISPR/Cas系统是一种古老的细菌适应性免疫系统,是细菌抵御外来病原入侵的的防御体系,基于其识别并切割特定核酸序列的特性,现已被改造并广泛应用于各物种的基因组编辑[5]。基于CRISPR/Cas9的基因编辑技术与传统基因打靶技术相比,具有成本低、操作简单、耗时少等特点,可用于快速构建基因敲除模式生物[6]。然而,生殖细胞的基因编辑会带来前所未有的伦理挑战,因此,利用腺相关病毒AAV作为CRISPR/Cas9系统的递送载体,在特定时间、特定体细胞内进行编辑的体细胞基因编辑系统对于构建人类疾病小鼠模型及疾病治疗具有重要的意义。例如利用AAV9病毒将靶向Myh6基因的sgRNA递送到心肌细胞特异性Cas9转基因小鼠心脏内,建立了成体心肌细胞特异性基因敲除小鼠模型。[7]因此,AAV介导的CRISPR/Cas9系统可作为我们研制心肌细胞特异性Oga敲除小鼠,研究内源性OGA功能的一种有效手段。
本研究旨在利用AAV9介导的CRISPR/Cas9系统在成体小鼠心肌细胞中特异性敲除Oga基因,快速建立Oga敲除小鼠模型。该模型的建立为研究OGA及其调节的O-GlcNAcylation在心脏稳态维持中的功能提供了理想的动物模型。
1 材料和方法
1.1 材料
1.1.1实验动物:本实验所使用的α-MHC-Cre转基因C57BL/6J小鼠由本实验构建,Rosa26-Cas9基因敲入小鼠购于Jackson实验室(货号024857),所有小鼠均饲养于SPF级屏障环境,体质量30~32 g,所有实验操作通过生命组学研究所动物实验委员会批准,实验动物使用许可证号【SYXK(军)2020-0002】。
1.1.2实验试剂:2×PCR Mix(+Dye)(北京普利莱基因技术有限公司);DNA Maker、核酸染料(北京博迈德基因技术有限公司);2×SYBR Green MasterMix(TaKaRa公司);Trizol(Sigma公司);异丙醇、三氯甲烷(国药集团化学试剂有限公司);蛋白酶和磷酸酶抑制剂(Roche公司);RIPA蛋白裂解液、十二烷基磺酸钠(sodium dodecyl sulfate,SDS)电泳上样缓冲液、WB一抗稀释液、1.5 mol/L Tris-HCl pH 8.8、1mol/L Tris-HCl pH 6.8(北京普利莱基因技术有限公司);蛋白分子量标志物PageRulerTMPrestained Protein Ladder、PierceTM BCA 蛋白定量试剂盒(Thermo Fisher);小鼠抗GAPDH单抗(北京中杉金桥生物技术有限公司);OGA多克隆抗体(Proteintech);聚偏氟乙烯PVDF膜(Millipore公司)。引物合成以及测序结果均来自南京擎科生物技术有限公司。
1.2 实验方法
1.2.1设计靶向Oga基因组编码序列的sgRNA:小鼠Oga基因在小鼠19号染色体上,共有18个外显子,基因ID为76055。利用gRNA设计软件(https://zlab.bio/guide-design-resources),按照sgRNA设计原则,选择On-Target和Off-target评分分值较高的6条sgRNA,序列见表1。利用基因敲除效率荧光检测系统,针对目的sgRNA构建Cas9及sgRNA共表达质粒和带有对应sgRNA靶序列的报告质粒,将其共转染HEK293细胞,48 h后观察荧光进行sgRNA有效序列筛选。
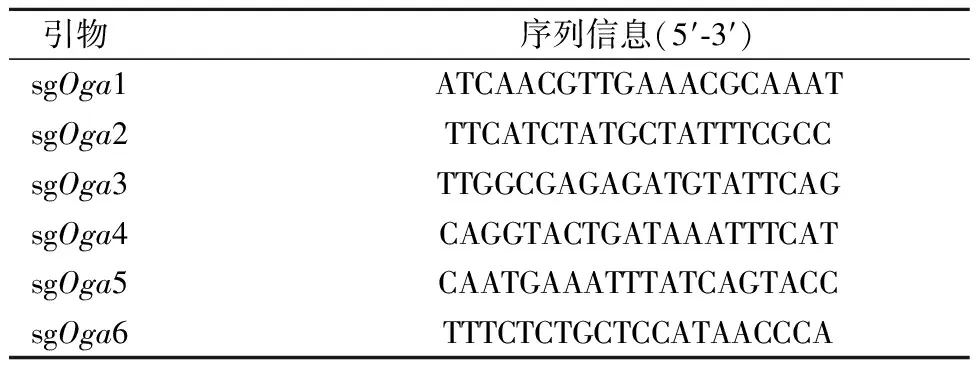
表1 靶向Oga基因组编码序列的sgRNA序列Table 1 sgRNA sequences targeting the coding sequence of Oga
对于效率最高的两个sgRNA(sgOga2和sgOga6)的筛选细胞,通过提取基因组、sgRNA靶序列所在区域PCR扩增(引物序列见表2),测序,进一步证实敲除效果。
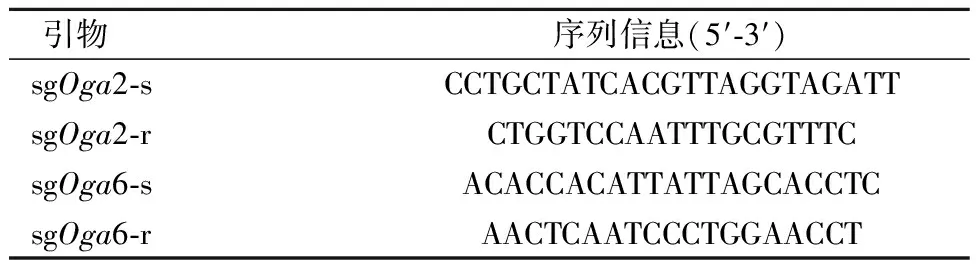
表2 sgRNA靶序列所在区域PCR扩增引物序列Table 2 PCR amplification primer of sgRNA target sequence
1.2.2构建腺相关病毒载体:将sgOga2和sgOga6序列克隆到带有mCherry荧光报告基因的腺相关病毒sgRNA表达载体上,构建携带外源基因的重组质粒。然后将重组质粒与辅助质粒Ad-Helper Vector和pAAV-rep/capVector共转染HEK293 T细胞,72 h后细胞内会产生大量的重组病毒。裂解细胞得到病毒并用碘克沙醇法纯化病毒,纯化完成后置于超滤管进行浓缩。得到AAV9-sgOga2-sgOga6-mCherry。最后实时定量PCR法对病毒进行滴度测定。
1.2.3心肌细胞特异性spCas9表达小鼠的获得:通过将α-MHC-Cre转基因小鼠和Rosa26-Cas9敲入小鼠交配获得F1代杂合子小鼠(α-MHC-Cre,Rosa26-Cas9+/-小鼠),由F1代α-MHC-Cre,Rosa26-Cas9+/-小鼠与Rosa26-Cas9敲入小鼠交配获得F2代纯合子α-MHC-Cre;Rosa26-Cas9+/+小鼠,即心肌细胞特异性的SpCas9表达小鼠(α-MHCCas9)。鉴定引物序列信息见表3,PCR条件为:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,32个循环;72 ℃ 5 min。

表3 小鼠基因型鉴定引物序列Table 3 Primer sequences of mice genotype identification
1.2.4基因编辑小鼠的构建和鉴定:将AAV9-sgOga2-sgOga6-mCherry以及对照空载病毒以2×1012vg(viral genomes)剂量腹腔注射入1月龄α-MHCCas9小鼠,得到对照小鼠AAV9-Control和敲除小鼠AAV9-sgOga各6只。在小鼠7月龄时,将对照小鼠AAV9-Control和敲除小鼠AAV9-sgOga麻醉,心脏灌流,取出心脏,以及肝、脑、肺、胃组织备用。
1.2.5qPCR检测:Trizol提取心脏组织的总RNA,测量浓度后取2 μg进行反转录得到cDNA,以Gapdh作为内参,在各个组织中分别对Oga表达情况进行qPCR检测并统计分析。并对心脏组织的cDNA进行肥大标志基因和纤维化标志基因的检测。反应条件如下:50 ℃ 20 s,95 ℃ 1 min;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 45 s,40个循环。其中扩增用引物序列见表4。

表4 qPCR引物序列Table 4 qPCR primer sequences
1.2.6Western blot印记杂交检测:取各部分组织,加适量的添加了蛋白酶和磷酸酶抑制剂的RIPA裂解液。用组织匀浆机将组织充分研磨后,超声打碎DNA,冰上静置20 min,13 000 r/min 4 ℃离心20 min,取上清。用BCA试剂盒测定蛋白质浓度,加入蛋白上样缓冲液混合,100 ℃煮沸5 min后,-30 ℃ 保存。取30 μg蛋白样本进行10% SDS-PAGE凝胶电泳,转膜,5%脱脂奶粉溶液封闭1 h,加入1∶1 000稀释的一抗,4 ℃孵育过夜,PBST洗涤3次,每次5 min,加入1∶1 000稀释的二抗,室温孵育1 h,PBST洗涤8 min,共洗3次。在膜上滴适量ECL发光液覆盖稍作反应,使用化学发光仪拍照。
1.2.7组织学染色:将取出的心脏组织置于4 %的多聚甲醛固定液中4 ℃固定12 h,脱水,石蜡包埋,切片厚度为5 μm,放置在载玻片上备用。将石蜡切片于二甲苯中脱蜡,梯度乙醇复水,用于HE和Masson染色。
1.2.8超声心动图分析:使用异氟烷麻醉小鼠,将胸前区毛发剃去后,将小鼠置于温度恒定的操作台上,利用超声影像系统对小鼠心脏各腔室室壁厚度及收缩、射血等指数进行测量与分析。
1.3 统计学分析

2 结果
2.1 靶向Oga基因组编码序列的sgRNA的筛选
CRISPR/Cas9激活的sgRNA效率荧光检测系统原理如图1A所示,检测系统包括一个报告质粒和一个表达质粒,如果候选sgRNA有效,则可以与另一个已经确定有效的sgRNA共同作用,分别在其对应报告质粒靶序列上进行切割,敲除我们人为添加的外显子,使N端和C端EGFP外显子正确切割从而表达,细胞会产生绿色荧光,EGFP阳性的细胞越多表示gRNA敲除效率越高,反之亦然。

注:A.CRISPR/Cas9激活的候选sgRNA效率荧光检测系统原理图,SD:剪切供体,SA:剪切受体;B.构建6条候选sgRNAs表达及报告质粒共转细胞的荧光检测图(×20);C.Sanger测序验证sgOga2和sgOga6对Oga靶序列的有效切割。Note:A. Schematic showing the CRISPR/Cas9-activated fluorescent reporter system to detect the efficiency of a candidate sgRNA, SD: splicing donor, SE: splicing acceptor; B. Fluorescent microscopy images of cells co-transfected with six candidate sgRNAs and their corresponding reporter plasmids(×20); C. Sanger sequencing confirmed the effective cleavage of targeting sites by the sgOga2 and sgOga6.
如图1B所示,候选的6条sgRNA中,只有sgOga2和sgOga6表达的细胞有绿色荧光产生,sgOga6的敲除效率最高,sgOga2的敲除效率次之。为了进一步验证基因组的改变,我们在sgOga2、sgOga6基因组靶序列上下游各约400 bp处设计PCR引物,以基因组为模板扩增出目的DNA,并进行了测序。Cas9切割引起DNA断裂位置发生非同源末端连接修复,这种修复方式是完全随机的,会大概率的引起插入缺失突变,导致其切割位置的碱基序列不同,从而在测序时出现套峰现象。如图1C所示,在sgOga2、sgOga6的识别切割位置的下游出现了套峰,说明sgOga2、sgOga6敲除效果很好。
2.2 基于CRISPR/Cas9 AAV9系统的成体Oga敲除小鼠的构建
α-MHCCas9小鼠特定基因组位点结构图及调控表达模式如图2A所示,心肌细胞内Cre重组酶特异性表达,介导Rosa26位点的stop序列敲除并启始spCas9核酸酶表达,小鼠基因型鉴定如图2B所示。AAV9-sgOga病毒表达载体结构模式图如图2C所示,sgOga2和sgOga6分别由两个独立的U6启动子启始表达,表达载体同时带有CMV启动子启始的mCherry报告基因。

注:A.Cre重组酶介导的Rosa26-Cas9位点重组及相关基因表达调控表达模式图;B.小鼠基因型鉴定结果;C.AAV9-sgOga病毒表达载体结构模式图;D.AAV9递送实验模式图;E.Cre重组酶介导的EGFP和AAV9介导的mCherry表达的检测。Control:未注射病毒的野生型小鼠;AAV9:注射病毒的α-MHCCas9小鼠。Note:A. Schematic representation of Rosa26-Cas9 allele before and after Cre-mediated recombination; B.Genotypic analysis of mice indicated;C. Schematic representation of the AAV9-sgOga vector; D. Experimental design of AAV9 delivery; E.Detection of Cre-mediated EGFP and AAV9-mediated mCherry expression. Control: Wild type mice without virus injection; AAV9: α-MHCCas9 mice with virus injection.
如图2D所示,将AAV9通过腹腔注射的方式递送到α-MHCCas9小鼠体内,图2E展示的Western blot 印记杂交结果表明,Cre介导的Cas9表达元件和AAV9介导的sgRNA表达元件在心脏组织都得到有效的表达,表明成功获得了同时在心肌细胞内特异性表达Cas9核酸酶和靶向Oga编码序列sgRNA的小鼠。
2.3 敲除小鼠心脏组织中Oga敲除效率和O-GlcNAcylation表达水平的验证
对建立的成体心肌细胞特异性Oga敲除小鼠进行了基因表达的验证,如图3A所示,Western blot印记杂交结果显示注射了AAV9-sgOga的α-MHCCas9小鼠(AAV9-sgOga小鼠)心脏组织的OGA蛋白表达水平较注射AAV9-Control的α-MHCCas9小鼠(AAV9-Control小鼠)显著下降,OGA调控的蛋白O-GlcNAcylation修饰水平也显著的升高。图3A的统计结果及图3B的qPCR结果表明,构建的6只Oga敲除小鼠心脏OGA蛋白及mRNA表达均显著下降,成模率100%。同时,在大脑、肺、肾等其他组织中没有检测到OGA表达水平的显著差异(图3C)。以上结果表明,本实验成功建立了成体心肌细胞特异性Oga敲除小鼠,实现了对心脏O-GlcNAcylation蛋白修饰水平的调控。

注:A.蛋白质印迹检测心脏组织OGA和O-GlcNAcylation蛋白水平的表达;B.qPCR检测心脏组织Oga mRNA水平的表达;C.肺、大脑、肾组织中OGA蛋白表达水平检测;与AAV9-Control组比较,*P<0.05,** P<0.01。Note:A.Western blot analysis of the protein levels of OGA and O-GlcNAcylation in the heart;B. qPCR analysis of the mRNA level of Ogain the heart; C.Detection of OGA expression in lung, brain and kidney;Compared with AAV9-control,*P<0.05, **P<0.01.
2.4 成体心肌细胞特异性Oga敲除小鼠的表型分析
对成体心肌细胞特异性Oga敲除小鼠进行表型分析,发现7月龄AAV9-sgOga小鼠心脏外观与AAV9-Control小鼠相比无显著异常(图4A),两者心脏重量与体质量比值(HW/BW)和心脏重量与胫骨长度比值(HW/TL)均无显著差异(图4B,C)。图4D所示的HE染色和图4E所示的Masson染色结果表明,AAV9-sgOga小鼠没有发生扩张、肥大和纤维化等心脏病理性改变。qPCR实验结果显示两组小鼠心脏组织的肥大标志基因和纤维化标志基因也没有明显变化(图4F,G)。
利用M型超声心动图对心脏收缩功能进行分析发现,AAV9-sgOga小鼠左室收缩末期前壁厚度(LVAW;s,图5A)、左室收缩末期后壁厚度(LVPW;s,图5B)、左室收缩末期内径(LVID;s,图5C)、左室收缩末期容积(LVVol;s,图5D)、左室射血分数(EF,图5E)和收缩指数(FS,图5F)较AAV9-Control小鼠均无显著差异,表明AAV9-sgOga小鼠在7月龄时心脏收缩功能无明显异常。以上结果表明成体心肌细胞特异性Oga敲除小鼠心脏在生理状态下没有出现明显的结构病变和收缩功能异常。

注:A.左室收缩末期前壁厚度;B.左室收缩末期后壁厚度;C.左室收缩末期内径;D.左室收缩末期容积;E.左室射血分数;F.左室收缩指数。Note:A. Left ventricular anterior wall thickness at end systole; B.Left ventricular posterior wall thickness at end systole; C.Left ventricular diameter at end systole; D.Left ventricular volume at end systole; E.Left ventricular ejection fraction; F. Left ventricular fractional shortening.
3 讨论
近十年来,基于CRISPR/Cas系统的基因组编辑技术被开发并广泛应用于细胞内遗传物质的改变,通过基因组编辑不仅可以敲除特定基因从而研究它们在组织细胞稳态中的功能,而且可以精确纠正发生基因突变的DNA序列从而恢复蛋白的正常表达。基因编辑技术虽然强大,但是也存在极大的伦理挑战和安全隐患,体细胞基因编辑将基因组编辑限制在特定的体细胞内,避免了生殖细胞基因组编辑带来的伦理问题,也大大降低了其他组织细胞基因编辑的风险。2018年美国国立卫生研究院(NIH)启动了体细胞基因组编辑计划,旨在开发高质量、安全有效的体细胞基因组编辑工具,为治疗人类遗传疾病开发新技术和新策略。体细胞基因组编辑技术也可以被应用于小鼠模型的构建中,与传统的基于胚胎干细胞和DNA同源重组的基因打靶技术相比,体细胞基因编辑技术周期短、成本低、可以更简单的实现时空表达的调控。由于CRISPR/Cas9系统发挥功能需要Cas9蛋白和sgRNA的共同作用,两者缺一不可,在本研究中,我们利用α-MHCCas9小鼠Cas9蛋白在心肌细胞表达的特异性及AAV9病毒对心脏的靶向性,用构建的表达针将Oga编码区的sgRNA的AAV9病毒导入α-MHCCas9小鼠中,利用qPCR和Western blot印记杂交检测到心脏组织内Oga的成功敲除及O-GlcNAcylation表达水平的升高,证实了成功应用CRISPR/Cas9基因编辑系统建立了成体心肌细胞Oga敲除小鼠模型。
以往的研究利用了一系列遗传修饰小鼠模型揭示了O-GlcNAcylation在心脏稳态维持中发挥了关键而复杂的功能。O-GlcNAcylation修饰受到OGT和OGA的共同调节。心肌细胞特异性Ogt过表达能够引起蛋白过度的O-GlcNAcylation修饰进而导致心衰及小鼠死亡。成型的心肌细胞特异性Ogt敲除小鼠只有12%可以存活到4周龄,表现出严重的心衰表型;成体可诱导的Ogt敲除小鼠在长久缺失Ogt表达时也会发生进行性的心脏功能异常。此外,可诱导的Ogt敲除小鼠在压力负荷状态下心室会发生更严重的收缩功能障碍[8]。这些研究表明,OGT的稳定表达及精确调控对于心脏正常功能的维持至关重要。作为O-GlcNAcylation调控的另一个关键酶,OGA被证实在心脏中过表达可以预防或缓解Ogt转基因小鼠、Prmt5敲除小鼠及糖尿病小鼠心脏的异常表型,提示OGA在心脏组织结构和功能维持方面发挥重要作用。由于以往研究发现心肌细胞特异性Oga过表达转基因小鼠心脏无显著异常[9],为了进一步研究内源性Oga在心脏稳态维持中的功能,我们对建立的成体心脏特异性表达Oga敲除小鼠进行系统的表型分析,发现敲除小鼠的心脏组织形态与功能在基础水平与对照小鼠相比无明显异常,该结果也与此前一项心肌细胞Oga单倍剂量不足小鼠的研究结果一致[10]。今后的研究中需要进一步关注在病理条件刺激下Oga敲除对心脏功能的影响。
综上所述,本研究构建的成体心肌细胞特异性Oga敲除小鼠为深入研究生理及病理状态下,OGA以及O-GlcNAcylation在体内心脏稳态维持中的功能提供了良好的实验动物模型。
