葡萄糖-PEG2000-DSPE 修饰卡马西平纳米系统对癫痫大鼠海马线粒体内氧化应激作用
2024-01-10赵斐谢旭芳吴成斯梁慧婷
赵斐,谢旭芳,吴成斯,梁慧婷
南昌大学第一附属医院,江西 南昌 330006
癫痫是由于脑的兴奋性和抑制性之间的不平衡而引起的反复发作的慢性神经系统疾病[1]。目前癫痫的治疗主要通过抗癫痫药物控制其发作,仅有60%的癫痫患者能有效缓解症状,且部分患者可能罹患认知、情绪障碍等合并症[2]。因此,确定引起癫痫的原因和机制,寻找新的、针对性强的靶向药物十分必要。卡马西平是目前治疗癫痫等神经系统疾病的主要药物,若能够有效地将卡马西平输送至大脑对于治疗癫痫非常重要[3]。研究[4]表明,当药物与葡萄糖(glucose,GLU)的6 碳结合时,嵌于细胞膜上的GLU 转运体GLUT1 识别能力最强,说明GLU 修饰的药物分子具有良好的靶向性。因此,本研究以海马神经元细胞膜上的GLUT1 为靶标,并基于海马神经细胞中线粒体内氧化应激机制,探究GLU-甲氧基聚乙二醇2000-二硬脂酰磷脂酰乙醇胺(GLU-PEG2000-DSPE)修饰卡马西平纳米系统脑靶向效果,对于临床开发研究新型靶向治疗癫痫药物具有重要意义。
1 材料与方法
1.1 实验动物
无特定病原体(specific pathogen free,SPF)级雄性斯波累格·多雷(Sprague Dawley,SD)大鼠60 只,由上海斯莱克实验动物有限责任公司提供,生产许可证号:生产许可SCXK(沪)2022-0004,体重240 g 左右,所有SD 大鼠均置于SPF 级实验动物房中饲养,环境温度为22 ℃左右,均自由摄食及饮水。所有动物实验均已经过南昌大学第一附属医院医学伦理委员会的批准。
1.2 药物与仪器
GLU-PEG2000-DSPE(上海炎怡生物科技有限公司),卡马西平原料药(常州亚邦制药有限公司,国药准字H20053419),超速冷冻离心机(美国贝克曼公司),透射电子显微镜(JEOL JEM-1220,Japan),酶标仪(BioTeK CytationTM5,UK),匀浆器(IKA T10B,Germany),高效液相色谱(HPLC)系统(美国Agilent 公司),超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)试剂盒(南京建成生物工程研究所)。
1.3 GLU-PEG2000-DSPE 修饰卡马西平纳米系统制备
薄膜分散法制备GLU-PEG2000-DSPE 修饰卡马西平脂质体,将蛋黄卵磷脂、胆固醇、GLU-PEG2000-DSPE、卡马西平按照摩尔比为95∶20∶5∶6.35(质量比为3.907∶1.02∶1∶0.5)用氯仿溶解于圆底烧瓶中。减压条件下蒸发该混合物形成薄的脂质膜,生理盐水超声水化形成脂质体溶液,并通过100 nm聚碳酸酯膜挤出,过G50 葡聚糖凝胶柱除去未包裹卡马西平,于4 ℃备用。
1.4 电镜观察纳米粒子的表征
使用透射电子显微镜观察纳米粒子的表面形态。取制备好的脂质体溶液用超纯水稀释10 倍,取1 滴滴加在230 目铜网上,再滴加0.5%磷钨酸溶液,晾干后使用透射显微镜观察并拍摄。负载荧光染料DiR 的纳米粒子的制备方法同上。
1.5 细胞培养
随机选取10 只SD 大鼠取其完整的海马组织,经PBS 漂洗后将海马组织剪成小块,并放入培养液中。将小块海马组织离心后去除上清液,加入20%FBS 悬浮中和,再次离心,去除神经和血管组织,收集沉淀(底部沉淀为大鼠海马神经元细胞)。
1.6 细胞毒性实验
取96 孔板,每孔铺大鼠神经元细胞5 000 个,过夜,随机均分为两组,将制备好的纳米粒子和单纯的卡马西平按15、30、45、80、100、200、400 μg/mL浓度梯度分别给药每孔细胞中,孵育48 h后,加10 μM 浓度为5 mg/mL 的MTT 溶液。培养箱继续培养4 h 后,弃去培养液,每孔加入100 μL DMSO 溶液,酶标仪振板10 min,490 nm 检测OD 值,计算各浓度下各制剂的48 h 细胞存活率。
1.7 分组与造模
将剩余50 只SD 大鼠随机分为四组,一组为正常组(n=10),其余三组进行造模,分别为模型组(n=10)、卡马西平组(n=15)、纳米组(n=15)。所有SD 大鼠按照分组分笼饲养于SPF 级动物房,适应性饲养1 周后进行实验。根据氯化锂-匹罗卡品诱导法构建癫痫大鼠模型,观察大鼠的行为学变化并根据Racine 评级标准判断癫痫模型是否制备成功,若大鼠出现Ⅳ级以上的持续癫痫状态,表明模型制备成功。本研究癫痫模型40只大鼠均构建成功。
1.8 检测癫痫大鼠脑组织中卡马西平含量
随机从卡马西平组、纳米组各选取5 只大鼠,分别给卡马西平组大鼠注射单纯的卡马西平溶液,纳米组注射GLU-PEG2000-DSPE 修饰的卡马西平纳米粒子溶液,各组溶液浓度根据细胞毒性实验结果注射。药物干预2 h 处死两组大鼠,收集其脑组织,冲洗后称重,并制备10%的匀浆液。匀浆液与1 mL乙酸乙酯充分混合、离心后,取上层有机相,重复3 次萃取过程,然后用滤头过滤,用200 μL 流动相复溶残余物,最后取20 μL 用HPLC 系统分析。
1.9 检测各组大鼠的海马组织病理学变化及氧化应激相关指标
卡马西平组、纳米组各10 只大鼠,经药物干预24 h 后处死各组大鼠,取部分海马组织经HE 染色后,在显微镜下观察并记录其病理变化。另取部分海马组织制备海马组织匀浆,吸取上清液,按照南京建成生物工程研究所提供的试剂盒说明书进行操作,通过化学比色法检测大鼠海马组织中氧化应激因子SOD、GSH-Px、MDA 的含量。
1.10 统计学方法
2 结果
2.1 纳米粒子的表征及粒径
不担载卡马西平药物的聚合物纳米粒子粒径最低为40 nm,最高为60 nm,呈分散均匀的球形,而担载抗癫痫药物卡马西平的聚合物纳米粒子粒径最低为70 nm,最高为90 nm,表面形态也为球形,无明显改变,但粒径明显增加(P<0.05)。见图1。
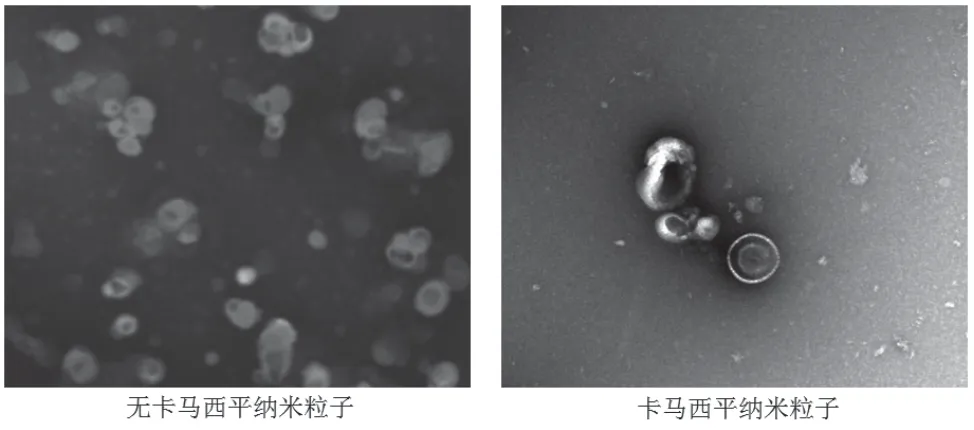
图1 电镜观察纳米粒子的表征(×100)
2.2 不同浓度的卡马西平纳米粒子对神经元细胞的毒性
80 μg/mL 及以上单纯的卡马西平对神经元细胞产生明显的毒性作用,而各浓度下卡马西平纳米粒子均对神经元细胞无明显毒性作用。在80 μg/mL 及以上时,卡马西平纳米粒子溶液中神经元细胞存活率明显高于单纯的卡马西平。在100 μg/mL 时,卡马西平纳米粒子对细胞的毒性最低,与单纯的卡马西平相比具有明显差异。见图2。

图2 不同浓度的卡马西平纳米粒子对神经元细胞的毒性
2.3 卡马西平在癫痫大鼠脑部药物定量分析
根据细胞毒性实验,卡马西平组、纳米组大鼠注射的卡马西平浓度均为15 μg/mL。通过药物定量分析显示,纳米组大鼠海马组织中卡马西平含量(1.69±0.17)μg/mL 明显高于卡马西平组(1.02±0.10)μg/mL(P<0.05)。见图3。
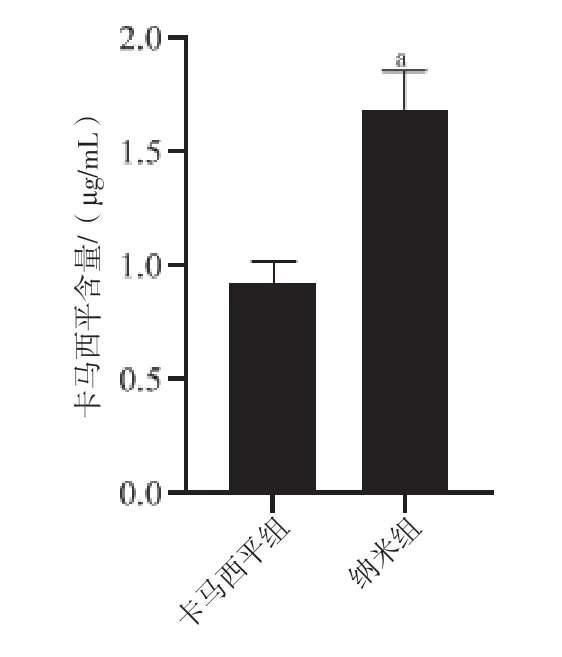
图3 癫痫大鼠脑组织中卡马西平含量
2.4 各组大鼠海马组织神经元病理形态结果
根据细胞毒性实验,在100 μg/mL 时,卡马西平纳米粒子对细胞毒性最低,在15 μg/mL 时,单纯的卡马西平对细胞毒性最低,基于此,检测卡马西平对癫痫大鼠海马组织神经元病理形态的影响。正常组大鼠脑皮质、颗粒细胞等结构轮廓完整,核仁清晰,染色质均匀;模型组大鼠海马组织神经元细胞排列紊乱,细胞发生膨胀、破裂,细胞间距加大;卡马西平组大鼠海马组织神经元排列稍有改善,细胞水肿明显;纳米组大鼠海马组织神经元细胞排列较为整齐,细胞无明显水肿,细胞间距变小,见图4。

图4 卡马西平对癫痫大鼠海马组织病理改变的影响(HE染色,×400)
2.5 各组大鼠海马组织中氧化应激相关指标水平
与正常组相比,模型组大鼠海马组织中SOD、GSH-Px 含量明显下降,MDA 含量明显上升(P<0.05)。与模型组相比,卡马西平组、纳米组大鼠海马组织中SOD、GSH-Px 含量明显上升,MDA 含量明显下降(P<0.05)。与卡马西平组相比,纳米组大鼠海马组织中SOD、GSH-Px 含量明显上升,MDA 含量明显下降(P<0.05)。见图5。

图5 大鼠海马组织中氧化应激相关指标
3 讨论
癫痫发作时脑组织产生大量活性氧,对线粒体产生毒性作用,导致线粒体结构受损、能量代谢功能障碍[5]。正常情况下脑细胞主要依靠GLU 的有氧氧化获得能量,而脑部摄取GLU 主要通过葡萄糖转运体家族(GLUTs)转运来实现[6]。研究显示,将抗肿瘤药物与葡萄糖连接起来形成缀合物可实现靶向输送药物、提高抗肿瘤效果,其作用机制与细胞通过GLUT 1 受体摄取GLU 缀合物有关[7]。纳米粒子的大小在粒子的生物分布、消除和传递中起着重要作用。本研究结果显示,担载卡马西平的聚合物纳米粒子表面形态呈分散均匀的球形,粒径明显大于不担载卡马西平药物的聚合物纳米粒子。
细胞毒性实验显示,卡马西平纳米粒子在各浓度下均对细胞无明显毒性作用,在80 μg/mL 及以上时,其细胞存活率明显高于单纯的卡马西平。表明GLU-PEG2000-DSPE 对正常细胞的存活率无明显影响,并且在担载卡马西平后,卡马西平对细胞的毒性作用可以显著减轻。研究表明,PEG2000-DSPE 修饰盐酸表阿霉素脂质体后显著降低药物毒性[8],与本研究结果一致。卡马西平穿过血脑屏障能力较低,而纳米粒子药物蓄积和递送能力更强,将有利于药物的定向传送和药效的发挥。本研究结果显示,纳米组大鼠海马组织中CBZ 含量明显高于卡马西平组。有研究[9]显示,通过RVG29-PEG-PLGA 纳米粒子可以更多地积累在脑组织中,可以有效保护缺血性脑卒中大鼠的神经功能。本研究探索卡马西平纳米粒子对癫痫大鼠的治疗作用,结果显示,卡马西平组、纳米组大鼠海马组织病理形态相较于模型组均有所改善,且纳米组大鼠改善效果更佳。表明GLU-PEG2000-DSPE 修饰卡马西平纳米系统能有效改善癫痫大鼠的病理状态。
研究[10]表明,氧化应激是癫痫发病的重要病理机制。大脑几乎是单一通过线粒体呼吸链的有氧代谢获取能量,且抗氧化能力弱,非常容易受氧化应激损伤,目前机体对抗氧自由基主要依赖自身的抗氧化酶系统,其中SOD 和GSH-Px 是机体主要的抗氧化酶[11-12]。MDA 是细胞脂质过氧化的直接产物,其含量可反映机体氧化应激损伤程度[13]。本研究结果显示,与模型组和卡马西平组相比,纳米组大鼠海马组织中SOD、GSH-Px 含量明显上升,MDA 含量明显下降。表明GLU-PEG2000-DSPE 修饰卡马西平纳米粒子可以有效缓解癫痫大鼠海马组织中的氧化应激作用。
综上所述,GLU-PEG2000-DSPE 修饰卡马西平纳米粒子可以有效改善癫痫大鼠海马组织的病理状态,缓解其氧化应激损伤。
