黄荧光染色技术引导荧光显微镜下肿瘤切除术治疗小脑幕上胶质瘤的效果分析
2024-01-10雷钟奇刘家传王金标温玉东姚寅生武孝刚王春琳
雷钟奇, 刘家传, 王金标, 温玉东, 姚寅生, 武孝刚, 王春琳
脑胶质瘤是一种神经外科较为常见的原发性恶性脑瘤,占颅脑恶性肿瘤的70%~80%[1]。脑胶质瘤中约1/4分布在幕下,3/4分布在幕上,其中幕上肿瘤的常见发病位置为额叶、颞叶、顶叶,其在脑组织中呈浸润性、侵袭性增长,边界不清晰,手术切除难度较大,且易复发,对患者预后不利[2]。近年来随着医学技术的不断创新及提高,目前临床治疗脑胶质瘤的方案主要有手术、免疫、放疗、化疗及分子靶向治疗等多种综合疗法,其中手术切除仍是首选方案[3]。术中肿瘤切除程度与患者的预后密切相关[4-5]。黄荧光染色技术中所使用的荧光素钠是一种常用染色剂,可透过遭到破坏的血脑屏障对肿瘤组织进行染色,正常的脑组织则不会被染色,从而有助于术中识别肿瘤组织[6]。本研究将黄荧光染色技术引导显微镜下肿瘤切除术应用于小脑幕上胶质瘤患者,分析其临床疗效及其预后生存情况,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年1月至2019年3月中国人民解放军联勤保障部队第901医院收治的98例小脑幕上胶质瘤患者,纳入标准:①符合2015年版《中国中枢神经系统胶质瘤诊断和治疗指南》中胶质瘤的诊断标准,术前经影像学检查提示颅内占位性病变,其肿瘤位置在小脑幕上,并经术后病理证实[7];②为首次发现,术前未经放疗及化疗;③肿瘤位置在可进行全切处理的区域。排除标准:①颅内多发肿瘤者;②合并其他部位肿瘤者;③患有器质性心脏病史者;④卡氏评分(karnofsky performance status,KPS)≤60分者。98例患者中男53例,女45例,年龄35~60岁,平均(46.38±5.24)岁,病程3~13个月,平均(9.65±2.31)个月,肿瘤位置:额叶38例、颞叶34例,顶叶26例;世界卫生组织(world health organization,WHO)病理分级:Ⅱ级26例,Ⅲ级30例,Ⅳ级42例。98例患者根据治疗方式的不同分为传统手术组(48例)与黄荧光技术组(50例),两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性,见表1。本研究方案经医院伦理委员会批准[审批号:2022年审(016)],研究对象均签署知情同意书。
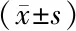
表1 黄荧光技术组与传统手术组一般资料比较
1.2 治疗方法
1.2.1 传统手术组 用常规显微外科方法行肿瘤切除术。
1.2.2 黄荧光技术组 术前用荧光素钠[国药准字H45021477,广西梧州制药(集团)股份有限公司]对患者实施静脉试敏,监测患者血压、血氧饱和度及心电图(包括心率、心律等)后,以0.9%的生理氯化钠将荧光素钠原液稀释至1%,经静脉推注5 mL稀释后的荧光素钠,监测患者生命体征0.5 h,观察患者血压、血氧饱和度及心率等情况,并注意观察是否出现恶心呕吐、过敏及痉挛抽搐等不良反应。试敏后将患者全麻,常规切开头皮,并将颅骨切除、硬脑膜悬吊,止血。剪开硬脑膜前,自静脉推注15 mL荧光素钠。剪开硬脑膜后仔细观察肿瘤所在位置,病灶区域显示由浅黄色状态持续变深。约15 min后利用具有560 nm波长荧光模块的显微镜(Zeiss Pentero 90,德国)在荧光模式下观察,此时肿瘤实质多显示为深黄色的强荧光,肿瘤边界及其附近水肿的脑组织多呈现浅黄色的荧光淡染或无荧光。主刀医生可根据荧光染色,确定切除范围。手术中需及时止血,以免影响视线范围,在实现整体肿瘤切除的情况下,还需病理分析所切除的不同黄染肿瘤。术中切除重要功能区域肿瘤时需结合神经电生理监测,以免出现神经系统功能障碍。整个荧光染色可维持1~2 h,最后被机体代谢降解。
1.3 观察指标及评定标准
手术情况:包括手术时间、肿瘤完全切除率及术后住院时间。术前及术后72 h对患者进行MRI检查,通过对比结果确定肿瘤切除程度,术后初次复查MRI提示未见增强肿瘤残余定义为完全切除,完全切除率=完全切除/总例数×100%。术后并发症情况:包括肢体运动障碍、脑水肿及肺部感染等。生存质量评分:分别于术前及术后1个月采用KPS评分评估患者的生存质量,总分为0~100分,分值越高表示患者生存质量越好[8]。生存情况:通过电话问询或门诊复诊的方式对患者随访至2021年6月,记录患者无进展生存期(progression free survival,PFS)和总生存期(overall survival,OS)。其中PFS定义为患者开始接受治疗至肿瘤进展或死亡时间;OS定义为患者开始接受治疗至死亡时间。
1.4 统计学方法
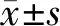
2 结果
2.1 黄荧光技术组与传统手术组手术情况比较
两组手术时间比较差异无统计学意义(P>0.05),黄荧光技术组肿瘤完全切除率高于传统手术组,术后住院时间短于传统手术组,差异有统计学意义(P<0.05),见表2。
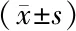
表2 黄荧光技术组与传统手术组手术情况比较
2.2 黄荧光技术组与传统手术组术后并发症情况比较
两组肢体运动障碍、脑水肿及肺部感染等术后并发症发生率比较,差异均无统计学意义(P>0.05),见表3。

表3 黄荧光技术组与传统手术组术后并发症比较[例(%)]
2.3 黄荧光技术组与传统手术组KPS评分比较
两组术前KPS评分比较差异无统计学意义(P>0.05),术后1个月,两组KPS评分均较术前上升,且黄荧光技术组高于对照组,差异有统计学意义(P<0.05),见表4。

表4 黄荧光技术组与传统手术组KPS评分比较(分,
2.4 荧光技术组与传统手术组生存情况比较
随访至2021年6月,平均随访时间(17.26±2.33)月,黄荧光技术组失访5例,传统手术组失访7例。黄荧光技术组患者中位PFS为12.60个月,中位OS为14.18个月;传统手术组中位PFS为10.55个月,中位OS为11.36个月。两组患者PFS比较,差异有统计学意义(χ2=5.498,P=0.015),两组患者OS生存曲线比较,差异有统计学意义(χ2=6.527,P=0.013),见图1。

图1 黄荧光技术 组和传统手术组生存曲线比较 1A:PFS生存曲线;1B:OS生存曲线
3 讨论
胶质瘤的具体发生机制复杂,有学者认为其可能与饮食习惯、化学致癌物质接触史、遗传因素及吸烟饮酒史等因素有关[9]。随着环境污染等因素的加重,胶质瘤的发病率呈逐渐升高趋势,其中男性发病率高于女性[10]。肿瘤组织的浸润性生长特点致使其与正常组织的边界不易分辨,医者多以临床经验、肿瘤颜色及脑回形态等判断肿瘤边界,致使肿瘤完全切除率不理想。初次手术时肿瘤组织残留越多,术后越易复发,患者预后越差[11-13]。为提高恶性肿瘤完全切除率,临床医师采取了多种办法,如神经导航、超声引导、荧光物质引导等,其中荧光素钠引导可使难以识别的肿瘤界线在显微镜下显示得较为清晰。
荧光素钠作为临床上常用的医学荧光剂,是一种非靶向示踪剂。荧光素钠在正常情况下无法穿透血脑屏障进入正常脑组织[14]。而脑胶质瘤患者的血脑屏障被破坏,荧光素钠可渗透破坏的血脑屏障,使被肿瘤侵袭的脑组织染色,同时脑坏死区域及脑水肿组织亦可染色,在显微镜下可清晰辨别肿瘤边界,从而使医师能精准地进行肿瘤切除。其次荧光素钠不参与机体代谢,进入人体后,多数与血浆白蛋白结合,少数与红细胞结合,毒性小,可经肾脏由尿液排出,少部分经肝脏在24 h内从胆汁排出。Vetrano等[15]采取荧光素钠引导切除丛状神经纤维瘤,肿瘤切除率较高,且安全可靠。本研究结果显示,与传统手术组比较,黄荧光技术组的肿瘤完全切除率更高,住院时间更短;两组术后并发症发生率比较差异无统计学意义,说明采取黄荧光染色技术引导荧光显微镜下切除小脑幕上胶质瘤可提高肿瘤完全切除率,且住院时间短,并未增加术后并发症发生率,是一种安全可行的临床治疗方案。被荧光素钠染色的肿瘤组织在激发光源照射下可清晰显示出黄绿色的荧光,正常的脑组织则不会显色,借助荧光素钠的这种特点,可清晰明确肿瘤边界。若肿瘤处于重要的功能区域,如丘脑、脑干、运动或语言等区域,可减少对正常脑组织的切除,最大程度减少损伤,保护患者的神经功能,进而改善患者预后[16]。顾小宇等[17]研究表明,采用荧光染色技术辅助切除脑胶质瘤后,患者的KPS评分提高。本研究结果显示,术后1个月,黄荧光技术组的KPS评分高于对照组;随访发现在两组预后生存情况方面,黄荧光技术组优于对照组,说明应用黄荧光染色技术引导切除小脑幕上胶质瘤可改善患者的预后生存情况,与Markosian等[18]的研究结果基本一致。
综上所述,应用黄荧光染色技术引导荧光显微镜下肿瘤切除术治疗小脑幕上胶质瘤,可提高肿瘤的完全切除率,缩短患者住院时间,促进患者术后生存质量改善,可在一定程度上改善患者预后生存情况。
