感染嗜水气单胞菌鱼类组织病理变化与多组学分析的研究进展
2024-01-09张鹤千潘超曾晓曼曹凯欣李珏贤王思语朱嘉桦
张鹤千,潘超,曾晓曼,曹凯欣,李珏贤,王思语,朱嘉桦
(北京师范大学未来教育学院,广东 珠海 519087)
嗜水气单胞菌(Aeromonas hydrophila)属于弧菌科、气单胞菌属,广泛分布于土壤、污水和河底,是兼性厌氧无芽孢的革兰氏阴性短杆菌[1]。该菌可产生多种毒力因子[2],为鱼类流行性败血症的主要病原菌,感染后常引发暴发性出血病,导致鱼类大面积死亡,在患病鱼的肠道、鳃、肝等器官均可分离并检测到嗜水气单胞菌[3,4]。嗜水气单胞菌感染宿主种类广,包括鱼类、甲壳类、两栖类等多种动物类群,在中国常见感染宿主为鲤科鱼类[5-8]。嗜水气单胞菌主要通过侵入肠道引发宿主全身感染,其致病性易受外界环境影响且常与其他致病菌协同作用混合感染[9]。嗜水气单胞菌感染导致多种鱼类流行病频发,造成严重的经济损失,制约了水产鱼类养殖业的健康发展[10]。
肠道、脾脏、肝脏、肾脏和鳃是鱼类重要的免疫相关器官,在鱼类抵御病原菌入侵中发挥重要作用[11]。嗜水气单胞菌感染可能引起鱼体免疫相关器官组织炎性水肿及部分坏死,细胞空泡化变性[12]。借助多组学测序技术可获得鱼体在应激扰动和病理状态下的相应变化,通过基因差异表达分析及相关信号通路注释有助于研究嗜水气单胞菌感染后机体转录调控变化,进一步揭示鱼体感染病原菌后免疫应答机制。嗜水气单胞菌作为条件致病菌与鱼类肠道菌群之间存在微妙的平衡关系,当平衡被破坏时致病菌将在宿主内大量增殖并引发疾病[13]。鱼类的肠道菌群与宿主代谢及免疫密相关,嗜水气单胞菌感染可能导致宿主肠道菌群组成及结构发生较大变化,改变肠道菌群稳态对宿主的免疫力及炎症反应有一定影响[14,15]。本文着重阐述嗜水气单胞菌感染后鱼类免疫相关器官病理学变化,综述了感染后鱼体转录组学水平变化研究进展,为进一步研究病原菌感染鱼类免疫应答机制及肠道菌群功能提供参考依据。
1 组织病理学变化
1.1 肠道组织病理变化
鱼类肠道为化学屏障、生物屏障、物理屏障及免疫屏障发挥抵御病原菌的作用,鱼类肠道淋巴结中有巨噬细胞、淋巴细胞等多种免疫细胞,可分泌出溶菌酶等黏附因子[16,17]。莫桑比克罗非鱼(Oreochromis mossambicus)感染嗜水气单胞菌后易引起“腹水病”,出现肠黏膜坏死、部分粘膜下层出血增厚、粘膜基层呈现水肿以及部分肠微绒毛脱落等现象[18]。组织病理学观察发现,自然感染病死的西伯利亚鲟(Acipenser baerii)肠腺上皮细胞坏死脱落,固有膜水肿[19]。斑鳢(Channa maculata)感染嗜水气单胞菌后,肠黏膜上皮层广泛性坏死脱落,毛细血管扩张、充血,基底膜排列紊乱[20]。鲫(Carassius auratus)感染嗜水气单胞菌后肠黏膜上皮细胞和绒毛柱状细胞脱落,肌肉层结构由紧凑变为松散[21]。异育银鲫(Carassius auratus gibelio)感染后肠腔褶皱部分黏膜下层出现白细胞浸润和组织坏死,坏死组织脱落于鱼肠腔中[22,23]。草鱼(Ctenopharyngodon idella)在嗜水气单胞菌感染早期肠道出现大量炎性细胞浸润、肠黏膜炎症、绒毛脱落等现象,一周后其肠黏膜开始修复,三周后基本完成[12](图1)。杂交鲟和鳗鲡(Anguilla japonica)在感染后组织病理变化相似,均出现小肠绒毛溃烂脱落、肠黏膜上皮细胞明显增生、部分细胞坏死脱落等现象;但鳗鲡小肠黏膜的固有层和黏膜下层炎性细胞浸润更严重[24-26]。

图1 肛灌嗜水气单胞菌后草鱼肠道不同时段组织损伤的情况[12]Fig.1 Tissue damage of intestine in grass carp Ctenopharyngodon idella exposed to anal infusion of Aeromonas hydrophila in different periods
1.2 脾脏组织病理变化
脾脏是鱼类重要的次级淋巴器官,是中性粒细胞产生、贮存、成熟及抗体形成与B 细胞分化的场所,具有造血及免疫相关功能[27,28]。鲫感染嗜水气单胞菌的病理组织切片显示,脾脏实质内淋巴细胞和其他细胞排列不规则、部分细胞溶解、脾脏组织严重坏死[21]。感染后西伯利亚鲟脾脏实质区域淋巴细胞数量减少,红细胞和中性粒细胞显著增加[19]。鳜(Siniperca chuatsi)感染嗜水气单胞菌后脾脏严重肿胀和充血,脾细胞排列松散,细胞质呈亮红色,出血明显[29,30]。青鱼(Mylopharyngodon piceus)感染后脾脏组织出现明显出血、严重坏死,脾脏细胞排列松散无序[31]。在感染后期,黄鳝(Monopterus albus)脾脏严重充血、出血,部分脾脏组织细胞变性、坏死;美洲鳗鲡(Anguilla rostrata)脾白髓几乎消失、组织结构疏松,局部出现坏死灶、被膜结缔组织增厚、出血[32,33]。感染发病的罗非鱼脾脏中央动脉和毛细血管充血,巨噬细胞数量明显增多,皮质部部分细胞坏死[18]。Hossam[34]等观察感染嗜水气单胞菌5 h、24 h、48 h 后病理组织切片发现,5~48 h 斑点叉尾鮰(Ictalurus punctatus)从轻度脾炎发展成重度脾炎;在48 h 时出现纤维性脾炎,红髓内的红细胞几乎耗尽,并被纤维素物质所取代,病变区域被巨噬细胞和淋巴细胞浸润(图2)。
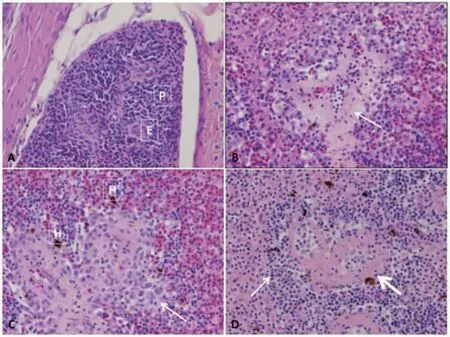
图2 嗜水气单胞菌感染斑点叉尾脾脏组织病理切片[34]Fig.2 Histopathological changes in spleen of channel catfish Ictalurus Punctatus infected with Aeromonas hydrophila
1.3 肝脏组织病理变化
肝脏为鱼类免疫相关器官参与机体先天性免疫,肝巨噬细胞可吞噬越过肠屏障进入肝脏的病原菌[11,35]。感染嗜水气单胞菌发病死亡的罗非鱼肝脏肿大、肝血窦内出血,肝小叶静脉淤血,肝细胞坏死,部分细胞核消失[18]。感染嗜水气单胞菌后,尼罗罗非鱼(Oreochromis niloticus)肝脏肝细胞出现空泡变性且伴有细胞核固缩和含铁血黄素积累(图3)[36]。自然感染患病后低眼无齿巨鲶(Pangasianodon hypophthalmus)肝组织有多处出血、肝细胞坏死严重、肝细胞核固缩且伴有肝巨噬细胞细胞聚集(图4)[37]。黄鳝(Monopterus albus)感染6~9 h 后肝细胞核浓缩偏向一侧,15 h 后肝细胞空泡变性,感染约1 d 后肝脏广泛出血[38]。黄颡鱼(Pelteobagrus fulvidraco)感染患病后肝细胞排列紊乱,肝组织大部分坏死,血管、肝胆管和肝细胞不易区分[39]。鳜感染后肝脏细胞排列紊乱、松散,肝细胞空泡化,部分细胞严重肿大甚坏死,细胞核染色加深[40]。金线鱼(Nemipterus virgatus)感染后肝脏细胞形态不规则,并伴有血细胞浸润等损伤[41]。剑尾鱼(Xiphophorus swordtails)感染嗜水气单胞菌6 h 后肝脏出现明显病理组织变化,11~12 h 后肝细胞广泛的空泡变性、细胞核溶解;18~20 h 可见棕黄色的血源性色素沉积,较短时间内感染能引起剑尾鱼器官快速病变,导致剑尾鱼多器官功能衰竭[42]。
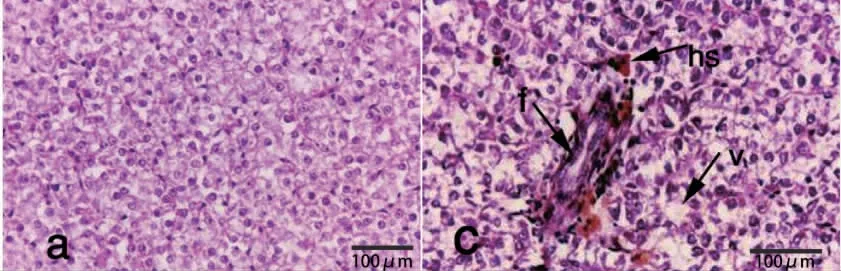
图3 感染嗜水气单胞菌的尼罗罗非鱼肝脏组织切片[36]Fig.3 Histopathological changes in liver of Nile tilapia(Oreochromis niloticus)infected with Aeromonas hydrophila
1.4 肾脏组织病理变化
鱼类的头肾中存在大量的淋巴细胞,是吞噬病原体、抗原加工、产生免疫球蛋白M(IgM)和黑色素巨噬细胞中心形成免疫记忆的重要场所,后肾在造血和免疫中发挥重要作用[43]。嗜水气单胞菌感染引起尼罗罗非鱼的肾小管严重变性,伴有间质单核细胞浸润和含铁血黄素积累(图5)[36]。黄鳝在感染后肾脏的组织病理变化经历了由肾间质出血、肾小球出血到肾小管上皮坏死、肾小球出现坏死灶的历程[38]。草鱼感染后头肾和中肾均出现严重坏死、浑浊肿胀、细胞肥大和颗粒细胞浆现象[44]。白斑狗鱼(Esox lucius)和团头鲂(Megalobrama amblycephala)感染后组织病理变化较相似:肾小管上皮肿胀、细胞颗粒变性,上皮细胞脱离基底膜、细胞核溶解消失[45-47]。养殖罗非鱼感染发病后鱼体亦出现肾小管上皮急性肿胀等病理变化[18]。南亚野鲮(Labeo rohita)在感染后头肾组织出现广泛退化和坏死,肾小管内膜增厚、管腔扭曲狭窄[48]。
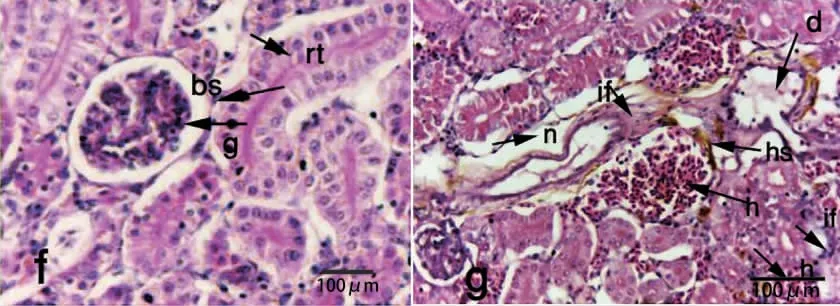
图5 嗜水气单胞菌感染尼罗罗非鱼肾脏组织切片[36]Fig.5 Histopathological changes in kidney of Nile tilapia(Oreochromis niloticus) infected with Aeromonas hydrophila
1.5 鳃组织病理变化
鳃在呼吸、渗透平衡及免疫反应中发挥重要的作用,鱼鳃通过形成物理屏障和免疫屏障,防止外来病原体入侵[49,50]。嗜水气单胞菌感染引起鲤(Cyprinus carpio)败血症。病鱼鳃小片间隙出现少量纤维素渗出,毛细血管充血,部分呈现鳃小片结构崩解及中性白细胞浸润[51]。西伯利亚鲟感染患病后,鳃小片扩张出血,部分断裂,鳃基部炎性细胞浸润[19]。感染嗜水气单胞菌后,鲶(Silurus asotus)鳃上皮高度坏死脱落、与支持细胞分离,次级鳃片缺失并伴有肥大和增生。斑鳢(Channa maculata)和鲢(Hypophthalmichthys molitrix)感染后鳃呈现相似的组织病理变化,而鲢感染后鳃弓白细胞浸润更为严重[20,22,37,52,53]。鳜和鲫感染嗜水气单胞菌后鳃丝严重出血且上皮细胞增生,部分细胞空泡化变性、坏死,并伴有炎性细胞浸润(图6)[22,30,40]。Fernandes 等[54]研究发现,罗非鱼鳃组织的感染通过微循环系统进行,被吞噬细胞内化的嗜水气单胞菌通过中心静脉窦的内皮进入鳃小瓣间质;鳃小瓣上皮细胞严重坏死,中心静脉周围大量白细胞浸润。
综上所述,对自然患病及人工感染鱼类免疫相关器官的组织学观察发现,感染嗜水气单胞菌后鱼类肠道、脾脏、肝脏、肾脏和鳃均表现出明显的病理学变化(表1)。鱼类感染后免疫相关器官组织常呈现出血、坏死、水肿和炎性细胞浸润等特征,部分组织细胞变形及间隙增大,核溶解,细胞呈现空泡化。
2 转录组学和微生物组学分析
2.1 感染后鱼类转录组学研究
转录组学借助高通量测序技术获得大量的转录本,通过分析差异表达基因和基因的结构功能,深入理解病原菌感染后鱼类疾病的发生及免疫答机制。脾脏转录组测序分析显示,鲤感染嗜水气单胞菌后,显著差异表达基因主要参与连接与粘附、病原体识别、细胞表面受体信号传导等免疫相关途径[71]。大口黑鲈(Micropterus salmoides)脾脏转录组测序显示,感染组与注射灭活菌的免疫组差异显著,感染组中与代谢途径相关的差异表达上调基因数量和基因表达水平显著大于免疫组。感染后大口黑鲈死亡率高达85%,可能与鱼体代谢紊乱、炎症反应水平升高以及适应性免疫反应降低等因素密切相关[1]。Zhang 等[31]分析感染后青鱼脾脏组织转录组学变化,部分差异表达基因被显著富集到细胞免疫、细胞黏附、病原体识别、补体系统等通路上;感染后补体和凝血级联通路极活跃,提示其在青鱼抵御病原菌感染中发挥重要作用。高通量转录组测序技术结合qRT-PCR 方法探究鲫感染嗜水气单胞菌后皮肤和鳃组织转录水平上变化,共筛选并验证11个皮肤免疫相关差异表达基因和12 个鳃免疫相关差异表达基因,通过KEGG 信号通路和GO 功能分析发现,TGF-β、补体及凝血系统、细胞凋亡和吞噬小体等参与鲫皮肤和鳃免疫应答分子调控网络[72]。对感染嗜水气单胞菌后欧洲鳗(Anguilla anguilla)肝脏、脾脏、肠道的转录组测序分析表明,差异表达基因最多的是脾脏,其次为肝脏和肠道[73]。差异表达基因数和KEGG 途径分析表明,上述组织中发生的免疫反应存在一致的时间进程,肝脏和脾脏富集到类似的模式识别受体相关途径如NOD 样受体、Toll 样受体和RIG-I 样受体信号通路[73]。转录组测序分析揭示,嗜水气单胞菌诱导草鱼肠道炎症机制,差异表达基因主要被富集到抗原加工和递呈、细胞因子—细胞因子受体相互作用等免疫相关通路上。这些通路与草鱼肠道炎症发生、进程、调节等直接相关[74]。转录组测序结果提示,感染后鱼体免疫和炎症相关通路被激活,机体积极抵御并消灭侵入病原菌。转录组学分析有助于进一步研究嗜水气单胞菌感染后鱼类免疫应答防御机制。
2.2 感染后鱼类肠道微生物组学研究
鱼类肠道菌群可辅助调节宿主众多生理功能,常被视为宿主的另一个“器官”。肠道菌群在影响宿主生长发育、营养代谢、免疫抵御的同时还可能作为潜在致病源,协同其他病原菌共同加速宿主的感染和死亡[75]。嗜水气单胞菌感染常引发宿主肠炎,这种感染依赖于细菌毒素及代谢产物等与宿主肠道内常驻微生物竞争,黏附定植于肠腔或肠隐窝[9]。近年来,研究结果阐释,嗜水气单胞菌感染往往伴随着其他病原菌混合感染,其致病性可能与宿主肠道菌群组成和结构的改变相关[9,76]。
嗜水气单胞菌感染后,鱼肠道菌群的组成和结构往往发生剧烈改变,其多样性和均匀性明显降低。感染后大口黑鲈肠道微生物组成丰度显著下降,气单胞菌属成为感染组肠道微生物的主要菌群,而注射灭活菌株的大口黑鲈肠道微生物组成无显著变化[1]。嗜水气单胞菌感染破坏大口黑鲈肠道微生物稳态,可能是攻毒后鱼死亡的主要原因[1]。尼罗罗非鱼感染后肠道菌群微生物总数、多样性和均匀性都显著降低,与宿主肠道炎症进程密切相关[77]。插管法感染后,鲤肠道菌群中嗜水气单胞菌数量迅速上升到较高比例,之后开始持续下降,7 d 后恢复低比例状态,而饲食益生元β-葡聚糖可以缓冲宿主肠道菌群的剧变[78]。草鱼感染后肠道菌群组成发生动态变化,12 h 出现剧烈波动,24~72 h 趋于缓和,6~9 d 群落多样性急剧增加,15 d 时有所减少。不同时间肠道菌群的波动主要发生在变形菌门、厚壁菌门、梭杆菌门和拟杆菌门,属水平上寡养单胞菌占比呈现较大变化,气单胞菌和乳酸杆菌等占比减少[15]。嗜水气单胞菌感染后,宿主肠道菌群的变化可能经历了开端、发展、高潮、回归和恢复的循环,该波动结果与组织病理学结果相似[15]。
优势微生物种群往往相互联系和影响,共同发挥维持环境群落结构和功能稳态的作用,而一些肠道微生物如芽孢杆菌属可通过产生特定酶、过氧化氢或细菌素等抑制嗜水气单胞菌在肠道内定植和生长[76,79]。鲤肠道内优势菌群为变形菌门和拟杆菌门,芽孢杆菌和粪球杆菌对气单胞菌有较强的拮抗作用[76]。尼罗罗非鱼肠道内优势菌群为厚壁菌门和梭杆菌门,其中芽孢杆菌抑制嗜水气单胞菌效果显著,饲料中添加芽孢杆菌可降低感染死亡率[79]。鲫肠道中乳球菌和芽孢杆菌的丰度与宿主对嗜水气单胞菌的易感性呈负相关,当肠道芽孢杆菌属和乳球菌属的水平下降时鱼病死亡率升高[80]。
3 总结
组织病理学研究表明,鱼类感染嗜水气单胞菌后免疫相关器官往往出现出血、坏死和炎性水肿等病理特征,部分组织结构紊乱、细胞核溶解、细胞空泡化严重。感染嗜水气单胞菌后鱼体有大量差异表达基因被注释到免疫相关信号通路,宿主肠道菌群丰富度和多样性显著降低,菌群的组成和结构发生动态变化。蛋白质组和代谢组在人类疾病研究中广泛运用,而在鱼类感染和免疫方面报道较少,缺乏鱼类感染后多组学联合分析相关研究。微生物组学分析可探索共生菌群与宿主的互作关系,目前仍较缺乏肠道菌群与鱼体免疫抵御功能的具体关联机制研究。未来综合分析多组学数据与组织病理学结果,从分子水平、细胞水平及组织器官水平研究感染后鱼体的变化,有望更深入理解嗜水气单胞菌感染对鱼类的影响。
