中山地区高危型HPV基因分型特点及与阴道微生态功能、中医体质的相关性分析
2024-01-09王山云曾建峰
王山云 曾建峰

基金项目:
广东省中医药管理局立项课题:基于中医体质学的宫颈持续性高危型 HPV 感染危险因素分析及风险列线图构建和验证(20222253);中山市科技局立项课题:基于网络药理学对清毒洗液治疗宫颈持续性高危型HPV感染机制的实验研究(2022B1127)。
作者简介:
王山云(1986—),女,汉族,在职博士研究生,副主任中医师,研究方向为中医药防治,女性生殖健康疾病。E-mail:wangshanyun.hi@163.com
通信作者:曾建峰(1985—),男,汉族,在职博士研究生,副主任医师,研究方向为中西医泌尿男科。E-mail:317528928@qq.com
【摘 要】
目的:为了解中山地区HPV基因分型感染情况及与阴道微生态功能学和中医体质的相关性;方法:对2022年1月至2022年7月在广州中医药大学附属中山医院行机会性宫颈筛查的女性11018例进行回顾性分析,探讨中山地区高危型HPV基因分型分别特点及与阴道微生态功能学、中医体质的相关性。对HPV检测同时行阴道微生态功能性检查并中医体质辨识的女性,随机选出HR-HPV阳性312例,以HR-HPV阴性 313例作为对照组。通过阴道阴道微生态功能学测定分析两组阴道微生态功能学的特点,通过中医体质辨识分析了解两组中医体质分布特点。结果:高危型HPV总阳性率 12.04%(1327/11018);30~39岁组的高危型HPV 感染阳性率最高,感染率为11.23%,其次是40~49岁组,感染阳性率为11.0%;感染亚型统计分析发现单一分型中的其他12种分型感染率最高,阳性率为9.08%,其次是16型,阳性率为1.35%。HR-HPV感染组BV、乳酸杆菌、过氧化氢阳性占比均高于对照组,HR-HPV感染组葡萄糖苷酶阳性占比低于对照组,差异有统计学意义(P<0.05)。经Logistic多因素分析显示优势菌为乳酸杆菌的异常、BV、过氧化氢的检出率增高、葡萄糖苷酶均不是HR-HPV患者的阴道微生态异常的独立风险因素(P>0.005)。HR-HPV阳性组湿热质分布最多(21.43%),其次是痰湿质(19.39%)、气虚质 (18.37%)。平和质、湿热质、痰湿质为HR-HPV感染的危险体质。湿热质对HR-HPV感染的影响最大(0R=2.199)。结论:中山地区高危型HPV总阳性率 12.04%,以其他12种分型感染率最高,阳性率为9.08%,以30~39岁组的高危型HPV感染阳性率最高。中山地区高危型HPV基因分型与国内及广东省不同地区在感染率、感染年龄分布、感染型别等方面均有差异性。因此在宫颈癌防治及HPV疫苗研发中,需要结合当地情况开展工作。HR-HPV感染患者阴道微生态的BV、乳酸杆菌、过氧化氫阳性明显增高,葡萄糖苷酶阳性明显降低,但均不是HR-HPV患者的阴道微生态异常的独立风险因素,可能和研究样本量、地域等差异有关,在HPV感染中起协同促进作用。对高危型HPV感染患者合病阴道微生态功能学异常者,积极调节阴道微生态功能,密切追踪感染人群,及早干预以降低宫颈癌变风险。HR-HPV与中医体质有密切关系,对体质偏颇的人群应积极干预以减少HR-HPV感染风险。
【关键词】 宫颈高危型HPV;基因分型;阴道微生态;中医体质
【中图分类号】R711 【文献标志码】 A 【文章编号】1007-8517(2023)22-0112-07
DOI:10.3969/j.issn.1007-8517.2023.22.zgmzmjyyzz202322024
The Genotyping Characteristics of High-Risk HPV Types in Zhongshan and Their Correlation with
Vaginal Microecological Function and Traditional Chinese Medicine Constitution
WANG Shanyun ZENG Jianfeng*
Zhongshan Hospital of Traditional Chinese Medicine,Zhongshan 528400, China
Abstract:
Objective To understand the situation of HPV genotype infection in Zhongshan area and its correlation with vaginal microecology and traditional Chinese medicine constitution. Method A retrospective analysis was conducted on 11018 women who underwent opportunistic cervical screening at Zhongshan Hospital affiliated to Guangzhou University of Traditional Chinese Medicine from January 2022 to July 2022. The characteristics of high-risk HPV genotypes in Zhongshan area and their correlation with vaginal microecology and traditional Chinese medicine constitution were explored. For women who underwent both HPV testing and vaginal microbiota functional testing, as well as traditional Chinese medicine constitution identification, 312 cases with positive HR-HPV were randomly selected, and 313 cases with negative HR-HPV were used as the control group. Analyze the characteristics of two groups of vaginal microbiota through vaginal microbiota functional measurement, and understand the distribution characteristics of two groups of traditional Chinese medicine constitution through identification analysis of traditional Chinese medicine constitution. Result The total positive rate of high-risk HPV was 12.04% (1327/11018); The high-risk HPV infection positive rate is the highest in the 30-39 year old group, with an infection rate of 11.23%, followed by the 40-49 year old group, with an infection positive rate of 11.0%; Statistical analysis of infection subtypes found that the other 12 subtypes in a single subtype had the highest infection rate, with a positive rate of 9.08%, followed by 16 subtypes, with a positive rate of 1.35%. The proportion of BV, Lactobacillus, and hydrogen peroxide positivity in the HR-HPV infection group was higher than that in the control group, while the proportion of glucosidase positivity in the HR-HPV infection group was lower than that in the control group, with a statistically significant difference (P<0.05). Logistic multivariate analysis showed that the dominant bacteria were abnormal lactobacilli, increased detection rates of BV, hydrogen peroxide, and glucosidase, which were not independent risk factors for vaginal microbiota abnormalities in HR-HPV patients (P>0.005). The HR-HPV positive group had the highest distribution of dampness and heat (21.43%), followed by phlegm dampness (19.39%) and qi deficiency (18.37%). Peaceful constitution, damp heat constitution, and phlegm dampness constitution are dangerous constitutions for HR-HPV infection. Damp heat has the greatest impact on HR-HPV infection (0R=2.199). Conclusion The total positive rate of high-risk HPV in Zhongshan area is 12.04%, with the highest infection rate among the other 12 subtypes, with a positive rate of 9.08%. The high-risk HPV infection positive rate is highest in the 30-39 year old group. There are differences in infection rates, age distribution, and infection types between high-risk HPV genotypes in Zhongshan region and different regions in China and Guangdong province. Therefore, in the prevention and treatment of cervical cancer and the development of HPV vaccines, it is necessary to carry out work in conjunction with local conditions. The positive rates of BV, lactobacilli, and hydrogen peroxide in the vaginal microbiota of HR-HPV infected patients were significantly increased, while the positive rates of glucosidase were significantly reduced. However, these were not independent risk factors for abnormal vaginal microbiota in HR-HPV patients, and may be related to differences in sample size and geographical distribution, playing a synergistic promoting role in HPV infection. For high-risk HPV infected patients with abnormal vaginal microbiota function, actively regulate vaginal microbiota function, closely track the infected population, and intervene early to reduce the risk of cervical cancer. HR-HPV is closely related to traditional Chinese medicine constitution, and active intervention should be taken to reduce the risk of HR-HPV infection in populations with biased constitution.
Keywords:
Cervical High-risk HPV; Genotyping; Vaginal Microecology; Traditional Chinese Medicine Physique
人类乳头状瘤病毒(HPV)包括一个DNA病毒家族,通过直接接触传播,导致肛门-生殖器和上气消化道皮肤和黏膜的良性和恶性病变。到目前为止,已发现了200 多种HPV类型[1-2]。全世界发生的所有癌症中有近5%可归因于HPV,每年有63 万新发癌症病例,使这种病毒成为癌症最重要的感染原因之一[3]。宫颈持续性高危型HPV是宫颈癌的最主要病因,其中16型,18型可导致约70%的宫颈癌变。宫颈癌在女性恶性肿瘤中仅次于乳腺癌,在发展中国家呈逐年增多并年轻化趋势,严重威胁着女性身心健康及家庭幸福。HPV疫苗能有效预防HPV感染,但国内外不同地区人群HPV基因分型有明显差异[4]。近年来,随着分子生物学的发展,研究发现病毒感染、疾病发生与阴道微生态环境密切相关。阴道微生态平衡是女性生殖系统的一道重要屏障,生理情况下阴道微生态菌群中HPV呈阴性,阴道内生态失衡会导致宫颈HPV感染概率增加,使厌氧菌过度生长,进而导致宫颈细胞學改变。目前国内外就HP-HPV基因分型与阴道微生态的相关研究不多。中医提倡“未病先防”,不同体质患者患病程度有差异,发展和转归亦有不同,注重患者体质状态,对于防治宫颈高危型HPV感染有重要意义。本研究通过分析中山地区HR-HPV女性基因分型特点及与阴道微生态功能性检查、中医体质的相关性,为中山地区HPV疫苗研发应用提供研究,更好开展宫颈癌防治工作,现将临床数据总结如下。
1 资料和方法
1.1 资料 选自回顾性分析2021年1月至2022年7月在广州中医药大学附属中山医院行机会性宫颈筛查的女性,共11018例, 年龄最小16岁,最大78岁,平均年龄(39±10)岁;年龄分组共四个:小于29岁、30~39岁、40~49岁及>50 岁4个组。所有入组者均进行cobas4800高危型HPV DNA分型检测,去除二次及多次复查的数据,对HPV阳性者进行LCT及阴道检查,必要时镜下活检。随机选取同时行阴道微生态及中医体质的HPV阳性女性312例,HPV阴性女性312例,统计本研究通过医院医学伦理审查。所有入组妇女为已婚或有性生活史,知情告知下自愿接受相关检查,既往无宫颈疾病手术史以及盆腔放射性治疗史,正值月经期及怀孕的妇女除外。
1.2 方法
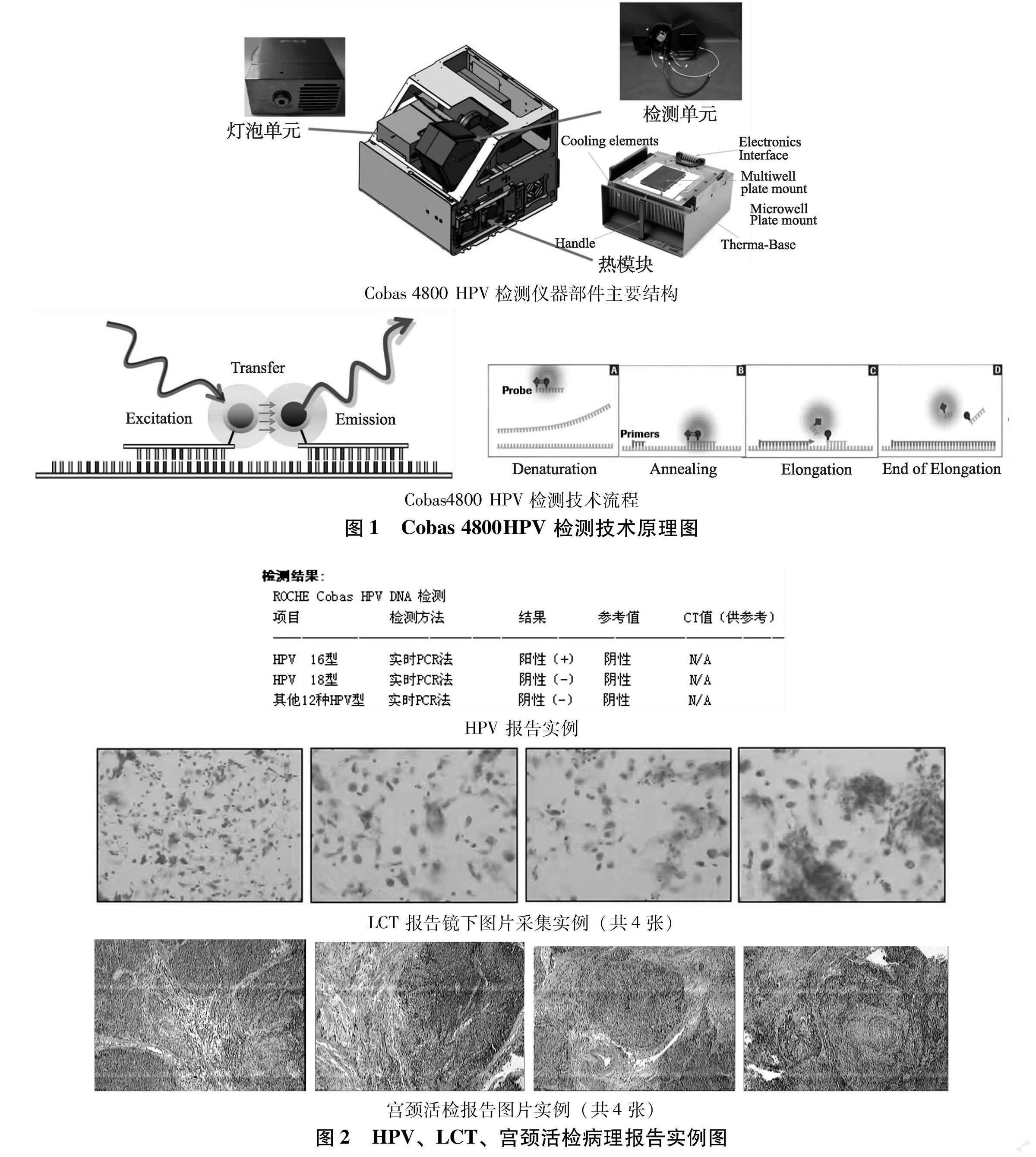
1.2.1 HPV检测方法及诊断标准 标本采集取膀胱截石位行妇科检查,用阴窥充分暴露宫颈,用HPV取样刷在宫颈口内口旋转5周停顿30秒采集宫颈分泌物,移至贴有入组者编号的条形码的标本瓶中,折断刷头至管中拧紧瓶盖,及时送至病理实验室4℃保存,当天批量检测。宫颈高危型HPV分型检测技术采用罗氏公司Cobas 4800HPV 检测技术,可同时检测目前国际公认的14 种高危型HPV型别,区分HPV16型、HPV18型,其他12 种高危型HPV分型。严格按照试剂盒说明书进行操作。Cobas 4800HPV 检测技术原理图如图1所示。
1.2.2 液基细胞学检查及诊断标准 用阴窥充分暴露宫颈,大棉枝擦去宫颈口的分泌物,用TCT刷置于宫颈内口旋转5周,收集宫口及宫颈管脱落上皮细胞,将采集刷头放入贴有入组者编号的TCT标本瓶中。TCT检查采用AutoCyte Prep自动制片染色机系列制片,采用子宫颈细胞学分类系统TBS标准[4]。对宫颈细胞学检测阳性者依据宫颈癌综合防控指南HPV 联合LCT 筛查流程方案进行阴道镜检查,必要时镜下活检送检。同一患者HPV、LCT、宫颈活检病理报告实例如图2所示。
1.2.3 阴道微生态功能学检查方法及诊断标准 取样前48 h禁性生活,取膀胱截石位,用窥阴器充分暴露阴道和宫颈口,常规消毒清洁。采用棉拭子从阴道侧壁上1/3 取少量分泌物后置于试管中用于检测阴道微生态,送检验科。判断标准:①干化学法检测所用试剂盒由郑州安图生物工程股份有限公司提供,过氧化氢(H2O2)<2 μmol/L时为阳性,白细胞酯酶>7 U/mL时为阳性,唾液酸苷酶>9 U/mL 时为阳性;②细菌性阴道病实验室诊断标准:用Amesel 方法诊断细菌性阴道病,标记为细菌性阴道病阳性;③阴道微生态正常:唾液酸苷酶(-),pH 值在3.8~4.5,过氧化氢为阴性,白细胞酯酶为阴性,分泌物中检查未发现阴道毛滴虫、菌丝、孢子等;④分泌物中检查发现阴道毛滴虫、菌丝及孢子时诊断为相应的阴道炎;⑤同时存在两种或两种以上阴道炎时诊断为混合性阴道炎;⑥唾液酸苷酶(-),pH 值在3.8~4.5,过氧化氢为阳性,白细胞酯酶为阴性,分泌物中检查未发现阴道毛滴虫、菌丝、孢子等时诊断为过氧化氢缺乏,考虑与乳杆菌功能下降有关;⑦唾液酸苷酶(-),pH 值在3.8~4.5,过氧化氢为阴性,白细胞酯酶为阳性,分泌物中检查未发现阴道毛滴虫、菌丝、孢子等时,诊断为白细胞酯酶阳性。
1.2.4 中医体质诊断方法及标准 参照王琦教授的9种基本中医体质分类学说[6]及中华中医药学会于2009年4月9日实施的《中医体质分类与判定标准(ZZYXH/T1157—2009)》[7],中医体质分为平和质、气虚质、阳虚质、阴虚质、痰湿质、湿热质、血瘀质、气郁质、特禀质。以感染者主要体质类型判定结果为“是”且转化分最高者为其体质类型,不考虑体质兼加情况。
1.3 统计方法 所得数据采用SPSS 23.0软件进行统计学分析,计量资料采用t检验,计数资料采用均数加减标准差(x±s)检验;HR-HPV 感染者阴道微生态异常影响因素以Logistic 多因素回归分析;宫颈高危险HPV与中医体质相关性采用Logistic回归分析,以HPV阳性是否为因变量,以9种体质类型为协变量,分别用X1~X9表示(1~9分别为平和质、阳虚质、阴虚质、气虚质、痰湿质、血瘀质、湿热质、气郁质、特禀质),组间对比以P<0.05为具有统计学意义。
2 结果
2.1 不同年龄宫颈癌筛查妇女高危型 HPV 感染率比较 HPV分型与年龄分布,将本研究的11018例女性按年齡段共分为4组,统计发现高危型HPV感染阳性率最高的组别是30~39岁组,感染率为 11.23%(548/4881),其次是40~49岁组的高危型HPV感染阳性率为11.0%(369/3354)。详见表1。
2.2 HR-HPV阳性型别及对应阳性率 在本次研究的11018例标本中HR-HPV 阳性总数共1327例(包括单一分型及多重感染),总阳性率达12.04%(1327/11018),其中以单一分型中的其他12种分型感染率最高,阳性率为9.08%(1000/11018),占总阳性率为75.36(1000/1327),其次是16型,阳性率为1.35%(149/11018),占总阳性率为11.23(149/1327)。详见表2。
2.3 两组阴道微生态功能学检查各项指标间比较 HR-HPV感染组BV、乳酸杆菌、过氧化氢阳性占比均高于对照组,HR-HPV感染组葡萄糖苷酶阳性占比低于对照组,差异有统计学意义(P<0.05),两组清洁度、念珠菌、白细胞酯酶、凝固酶、脯氨酸氨基肽酶、唾液酸苷酶、乙酰氨基葡萄糖苷酶、葡萄糖苷酶、PH比较差异均无统计学意义,详见表3。
2.4 HR-HPV感染相关阴道功能学危险因素多因素Logistic回归分析 将2.3中经单因素分析差异有统计学意义的因素纳入自变量,将HR-HPV患者阴道微生态情况作为因变量,经Logistic多因素分析显示优势菌为乳酸杆菌的异常、BV、过氧化氢的检出率增高、葡萄糖苷酶均不是HR-HPV患者的阴道微生态异常的独立风险因素(P>0.005)。详见表4。
2.5 HR-HPV人群9种中医体质分布情况比较 观察组湿热质分布最多(16.0%),其次是痰湿质(14.1%)、气虚质 (13.1%);对照组平和质分布最多(18.2%),其次是阳虚质(12.8%)、气郁质(11.8%)。详见表5。
2.6 中医体质与HR-HPV相关性分析 纳入回归模型的协变量为X2、X7、X8,即平和质、湿热质、痰湿质为HR-HPV感染的危险体质。湿热质对HR-HPV感染的影响最大(0R=2.199)。详见表6。
3 讨论
HR-HPV亚型是与宫颈癌相关的致癌过程中的一个必要因素。然而,不同型别的HPV对宫颈癌变的致病力不尽相同,总结分析高危型HPV与不同年龄段感染情况的相关性,及HPV基因分型及感染率在地域分布的差异性, 对HPV疫苗研发和易感人群重点防治都有促进意义[8]。阴道微生态是女性微生态系统一个重要而复杂的组成部分,与女性生殖道感染性疾病发生发展密切相关,是近年来研究的热点。阴道微环境是HPV侵入宫颈的第一道防线,HPV感染后的转归与阴道局部微环境功能密切相关[9]。阴道微生态失衡增加了 HR-HPV的易感性,影响HPV清除,促进宫颈上皮内瘤病变形成,进而导致宫颈癌的发生[10-12]。宫颈HR-HPV感染以宫颈局部病变为主,一般无典型症状和体征,中医学无对应病名,属于“带下病”范畴,治疗上以清利湿热为主要原则。中医认为高危型HPV感染者的体质类型与HPV的清除能力息息相关。
3.1 中山地区HR-HPV分布特点 本研究在接受HR-HPV分型检测的11018例标本中,共检出1327例HR-HPV 阳性,总阳性率 12.04%,高于韩朝娟等[13]研究报道的海口地区感染率为9.2%,蔡鹏飞等[14]研究报道的广西地区感染率为 10.20%,刘灵燕等[15]报道上海地区感染率为10.81%,低于曾建涛等[16]报道重庆地区感染率为16.19%,曹燕飞等[17]报道甘肃白银地区感染率为15.92%,武利涛等[18]报道北京地区感染率为18.61%。广东省内其他城市地区,如唐菁娟等[19]研究报道佛山和广州的HPV阳性率分别为27.63%、17.12%。本研究发现中山地区以其他12种分型感染率最高,阳性率为9.08%,占总阳性率为75.36,其次是16型,阳性率为1.35%,占总阳性率为11.23。武利涛等[18]报道北京地区,唐菁娟等[19]研究报道佛山和广州的HPV,高危型HPV检出率分型排序则其他12种分型居首,但也不尽相同。而曹燕飞等[17]报道甘肃白银地区高危型HPV检出率分型排序则以16型居首。中国人口多、地广、多种族等因素,HPV在各地区的感染情况有差异[20]。本究发现中山地区30~39岁组的高危型HPV感染阳性率最高,感染率为11.23%,其次是40~49岁组,感染阳性率为11.0%。韩朝娟等[13]报道海口地区20~29岁和50~59岁是高危型HPV感染的两个年龄高峰。曾建涛等[16]报道重庆市高危型HPV感染<20岁组感染率最高(27.03%),41~50岁组感染率最低(10.74%)。唐菁娟等[19]报道佛山和广州两地均在≤20 岁组和>50 组阳性率高。本研究通过对中山地区11018高危型HPV基因分型分型,当地高危型HPV总阳性率 12.04%,以其他12种分型感染率最高,阳性率为9.08%,以30~39岁组的高危型HPV 感染阳性率最高,中山地区宫颈病变和HPV16型感染关系密切。
由此推测,中山地区高危型HPV基因分型与国内其他地区在感染率,感染年龄分布、感染型别等方面均有差异性。因此在宫颈癌防治及HPV疫苗研发中,需要结合当地情况开展工作。本研究以机会性筛查人群,下一步希望结合当地“两癌”筛查等组织性筛查人群,扩大研究人数及人群,对比不同的HPV基因分型检测方法,更全面客观的进行研究。
3.2 HR-HPV与阴道微生态的相关性 本研究发现:在HR-HPV感染组BV、乳酸杆菌、过氧化氢阳性占比均高于对照组,HR-HPV感染组葡萄糖苷酶阳性占比低于对照组(P<0.05),相关报道支持本研究[21-22]。有学者[23-24]认为BV的病理基础是阴道正常菌群的平衡失调,而不是由致病菌引起。 BV感染更倾向于发生在 HR-HPV 持续阳性合并宫颈癌的患者。微生态的异常变化利于HR-HPV引起宫颈的系列演变,在长时间损坏因素影响下,更易于导致癌变。王鹏程等[24]研究报道H2O2阳性率在HPV阳性组中明显更高,支持本研究。潘颖等[25]报道宫颈 HR-HPV 阳性组患者阴道菌群中以乳酸杆菌属为优势菌者显著减少,支持本研究。尽管目前研究普遍认为阴道微生物菌群与HPV感染及宫颈病变存在关联,但尚没有证据说明它们之间是否存在因果关系。据目前多个研究报道对HR-HPV感染相关阴道功能学危险因素多因素回归分析独立影响因素说法不一。如陈媛[26]研究乳酸杆菌作为优势菌的比例下降、BV及AV占比升高是导致HR-HPV感染癌前病变患者阴道微生态异常的独立危险因素。吴小梅等[27]研究认为细菌性阴道病、乳杆菌减少是引起高危型HPV感染的独立危险因素。
本研究通过对HR-HPV感染相关阴道功能学危险因素多因素回归分析发现优势菌为乳酸杆菌的异常、BV、过氧化氢的检出率增高、葡萄糖苷酶均不是HR-HPV患者的阴道微生态异常的独立风险因素(P>0.005)。
3.3 HR-HPV与体质的相关性 在王琳[28]对120例宫颈高危型HPV持续感染患者的对照研究中发现,宫颈高危型HPV持续感染患者与健康女性的体质分布有明显差异,宫颈高危型HPV持续感染患者的体质集中呈现偏颇体质,以阳虚质偏颇体质为主。在刘静[29]的研究里,对于宫颈高危型HPV感染,病理学诊断为宫颈慢性炎症,体质以平和质、阳虚质、气郁质为主。研究表明,宫颈高危型HPV持续感染的发生与体质明确相关,偏颇体质可能导致宫颈高危型HPV持续感染的发生和结局。本研究通过比较HR-HPV感染组与健康组人群进行中医体质辨识分析,发现HR-HPV阳性组湿热质分布最多(16.0%),其次是痰湿质(14.1%)、气虚质 (13.1%)。平和质、湿热质、痰濕质为HR-HPV感染的危险体质。湿热质对HR-HPV感染的影响最大(0R=2.199)。由此可见,HR-HPV与中医体质有密切关系,对体质偏颇的人群应积极干预以减少HR-HPV感染风险。
4 结论
综上所述,中山地区高危型HPV总阳性率12.04%,以其他12种分型感染率最高,阳性率为9.08%,以30~39岁组的高危型HPV感染阳性率最高。中山地区高危型HPV基因分型与国内及广东省不同地区在感染率、感染年龄分布、感染型别等方面均有差异性。因此在宫颈癌防治及HPV疫苗研发中,需要结合当地情况开展工作。HR-HPV感染患者阴道微生态的BV、乳酸杆菌、过氧化氢阳性明显增高,葡萄糖苷酶阳性明显降低,但均不是HR-HPV患者的阴道微生态异常的独立风险因素,可能和研究样本量、地域等差异有关,在HPV感染中起协同促进作用。对高危型HPV感染患者合病阴道微生态功能学异常者,积极调节阴道微生态功能,密切追踪感染人群,及早干预以降低宫颈癌变风险。HR-HPV与中医体质有密切关系,对体质偏颇的人群应积极干预以减少HR-HPV感染风险。
参考文献
[1]
LIEBENBERG L,MCKINNON L,YENDE-ZUMA N,et al. HPV infection and the genital cytokine milieu in women at high risk of HIV acquisition[J]. Nat. Commun,2019(10):5227.
[2]WAKABAYASHI R,NAKAHAMA Y,NGUYEN V,et al. The Host-Microbe Interplay in Human Papillomavirus-Induced Carcinogenesis[J]. Microorganisms,2019(7):199.
[3]MARTEL C,PLUMMER M,VIGNAT J,et al.Worldwide burden of cancer attributable to HPV by site, country and HPV type[J]. Int. J. Cancer,2017(141):664-670.
[4]HU Z, ZHU D, WANG W,et al. Genome-wide profiling of HPV integration in cervical cancer identifies clustered genomic hot spots and a potential microhomology-mediated integration mechanism[J].Nat Genet,2015, 47(2):158-163.
[5]SCHIFFMAN M,GLASS A,WENTZENSEN N,et al. A long-term prospective study of type-specific human papillomavirus infection and risk of cervical neoplasia among 20,000 women in the Portland Kaiser Cohort Study[J]. Cancer Epidemiol. Biomarkers Prev, 2011(20):1398-1409.
[6]王琦.中医体质学[M].北京:人民卫生出版社,2005:61.
[7]中华中医药学会.中医体质分类与判定标准(ZZYXH/T1157—2009)[M].北京:中国中医药出版社,2009.
[8]宫迎迎, 周烨, 韩辉,等.济宁地区自然就诊妇女宫颈HPV感染型别调查及HR-HPV持续性感染危险因素分析[J].中华肿瘤防治杂志,2020,27(21):14-18.
[9]GUO Y L,YOU K,QIAO J,et al.Bacterial vaginosis is conducive to the persistence of HPV infection[J].Int J STDAIDS,2012,23(8):581-584.
[10]刘颖惠,余杨, 孙翔.阴道微生态失衡与高危型人乳头瘤病毒相关宫颈病变的关系[J].河南医学高等专科学校学报,2022,1(34):62-66.
[11]宋建东,宋静慧,于聪祥,等. 影响宫颈病变患者HPV转归的多因素分析[J]. 中国实用妇科与产科杂志,2018,34(8):892-897.
[12]BROTMAN R M,SHARDELL M D,GAJER P,et al. Interplay between the emporal dynamics of the vaginal microbiota and human apillomavirus detection [J]. J Infect Dis,2014,210(11):1723 -1733.
[13]韩朝娟,韩燕媚,张关龄,等.海口地区高危型HPV感染现状调查及相关风险因素分析[J].中国计划生育学杂志,2021,29(6):1088-1095.
[14]蔡鹏飞,许泽辉,王敬仁,等.广西柳州地区9810 例人乳头瘤病毒检测结果分析[J].检验医学,2019,34 (3):246-248.
[15]劉灵燕,郭竹英,胡传玺,等.上海市宝山区HPV 基因分型的特征分析[J]. Bengbu Med Coll,2020, 45(3):84-387.
[16]曾建涛,李泉,周丽莉,等.重庆市长寿区高危型HPV感染基因分型特征[J].贵州医药,2021,45(3):463-464.
[17]曹燕飞,姚文香,马菁璟,等.白银地区5年来4151 例女性生殖道HPV分型检测及分析[J].婚育与健康,2021(19):23-24.
[18]武利涛,郭楠,李宝萍,等.北京2183 例女性高危型HPV感染状况分析中国实验诊断学,2019,23 (10):1711-1714.
[19]唐菁娟.佛山和广州女性宫颈细胞HPV基因分型分析[J].医学信息,2019,32(12):139-141.
[20]LEE J E,LEE S,LEE H,et al.Association of the vaginalmicrobiota with human papillomavirus infection in a Koreantwin cohort[J].PLOS ONE,2013,8(5):e63514.
[21]王迎,孔凡雪,游珂,等.高危型 HPV 感染与阴道微生态检测的相关性分析[J].中国生育健康杂志,2022,33(2):169-171.
[22]魏东林. 持续高危型 HPV 感染和妇女阴道微生态的关系研究[J]. 临床医学研究与实践,2019,4(7): 68-69,72.
[23]GILLET E,MEYS J F,VERSTRAELEN H,et al. Bacterial vaginosis is associated with uterine cervical human papillomavirus infection:a meta-analysis [J]. Bmc Infect Dis,2011,11(1):10.
[24]王鹏程.人乳头瘤病毒感染的多因素分析及与阴道微生态的相关性[J].中国性科学,2021,30(9):77-79.
[25]潘颖,盛华芳,康玲.高危型人乳头状瘤病毒感染与阴道菌群的相关性研究[J].第三军医大学学报,2016,38(13):1559-1564.
[26]陈媛.高危型HPV感染同阴道微生态环境及宫颈癌前病变的相关性分析[J].临床医学2021(47):134-135.
[27]吴小梅,吉昌兰,杨慧,等.阴道微生态异常与高危型HPV感染的相关性[J].中外医学研究,2021,19(8):87-89.
[28]王琳.高危型人乳头瘤病毒感染与中医体质的相关性研究[D].北京:北京中医药大学,2015.
[29]刘静.宫颈HR—HPV感染与中医体质及阴道免疫微环境的关系[D].北京:北京中医药大学,2012.
(收稿日期:2023-02-13 编辑:杜玲玉珊)
