水貂缓慢葡萄球菌和奇异变形杆菌混合感染的病原分离与鉴定
2024-01-08王晓旭林哲旭鲍坤徐超王凯英刘志杰
王晓旭,林哲旭,鲍坤,徐超,王凯英,刘志杰※
(1.中国农业科学院特产研究所,吉林 长春 130112;2.吉林省东丰县梅花鹿科技服务中心,吉林 东丰 136300)
缓慢葡萄球菌(Straphylococcus lentus)属于凝固酶阴性葡萄球菌,曾被认为不具有致病性,但越来越多的资料表明该菌可引起人类和多种动物发病,尤其是新生儿、免疫力低下的人群和动物更容易致病,是一种不可忽视的人兽共患致病菌[1,2]。该菌感染人可以引起人的慢性鼻窦炎[3],此外还可感染猪、鹅和羊等多种动物。刘富来等[4]报道,佛山市某养猪场因缓慢葡萄球菌感染,引起全场猪发病,死亡率达23%,主要症状为体温升高和呼吸道症状。朱思明等[5]报道,缓慢葡萄球菌可以引起雏鹅发病死亡,发病率为100%,死亡率为89%,死亡后雏鹅以肝脏显著肿大并出血、肺脏广泛出血坏死等多种内脏器官广泛出血现象。该菌还可以引起山羊、仓鼠、鸭子及眼镜蛇等感染,多以肝脏肿大、肺脏水肿和脾脏坏死为主要特征[6,7]。
奇异变形杆菌(Proteus mirabilis)是革兰氏阴性菌,具有鞭毛和菌毛,广泛存在于水、土壤以及动物和人类肠道菌群中。奇异杆菌是一种条件致病菌,通常对人无致病力[8]。然而,当机体免疫力减弱时,可引起严重疾病,如膀胱炎、败血症、腹膜炎和脑膜炎等[9,10]。奇异杆菌是引起人类尿道感染的第三大常见原因,仅次于肺炎克雷伯氏菌和大肠杆菌。据报道,奇异变形杆菌在不与任何其他病原体混合感染的情况下,可引起鱼类的大规模死亡[11]。此外,奇异变形杆菌感染也可引起禽类的繁殖障碍[12]、牛和家禽的腹泻[13]以及狗的慢性外耳炎[14]。
近年来,缓慢葡萄球菌感染水貂的报道较少,朱丽霞等[15]报道缓慢葡萄球菌感染水貂后出现肺炎和肾脏肿大等病变,Schwarz 等[16]在泌尿系统和周围环境中分离出具有多种耐药性的缓慢葡萄球菌。而水貂发生奇异变形杆菌感染的报道却日益增多,其发病率和死亡率均较高,剖检可见肺脏炎症、肾脏、脾脏及肝脏显著肿大[17-20]。目前,尚未见缓慢葡萄球菌和奇异变形杆菌混合感染引起水貂发病的报道。缓慢葡萄球菌和奇异变形杆菌作为人兽共患细菌病病原,不仅在养殖业上造成严重的经济损失,还有感染人类的风险,因此,应引起重视。2021 年辽宁省大连市某养殖场送检病死水貂,发病率在30%左右,死亡率在10%左右,共同特点均为先发生趾间溃烂,之后引起死亡。本研究通过对病原菌的分离,确定病原菌为缓慢葡萄球菌和奇异变形杆菌混合感染,筛选敏感药物,为我国水貂细菌性疾病早期的科学诊断和治疗工作提供了一定理论参考。
1 材料与方法
1.1 材料
1.1.1 样品采集 无菌采取死亡水貂趾间溃烂分泌物和内脏器官,带回实验室,置4 ℃冰箱中保存,备用。小鼠购自辽宁长生生物技术有限公司。小鼠为封闭群小鼠(SPF),品种为KM鼠,日龄为5 周龄,体重为(18±2)g。
1.1.2 主要试剂 Ex Taq DNA 聚合酶、pMD18-T 载体、E.coli DH5感受态细胞购自宝生物工程(大连)有限公司;药敏纸片购自杭州微生物试剂有限公司;DNA提取试剂盒、胶回收试剂盒购自AXYGEN 公司;胰酪胨大豆肉汤培养基购于青岛海博生物技术有限公司;PCR 引物由生工生物工程(上海)有限公司合成;革兰氏染色液购于天根生化科技(北京)有限公司;厌氧产气袋、厌氧培养罐购于三菱瓦斯化学株式会社。
1.2 方法
1.2.1 临床症状和病理变化 通过临床症状和病理剖检,了解水貂的临床症状和病理变化。
1.2.2 病原菌分离和16S rRNA 分子鉴定 无菌挑取趾间溃烂分泌物和水貂肺脏、肝脏、脾脏及肾脏样品,在胰蛋白胨大豆肉汤固体培养基上划线,置于37 ℃培养24~72 h,挑取可疑菌落接种于胰蛋白胨大豆肉汤液体培养基。根据GenBank 已发表的细菌16S rRNA 基因设计通用引物,上游T1:5'-AGAGTTTGATC(A/C)-3',下游T2:5'-GGACTAC(A/T/C)AGGGTATCTAAT-3。反应条件:95 ℃预变性5 min;95 ℃变性45 s,55 ℃退火45 s,72 ℃延伸50 s,30个循环;最后72 ℃延伸10 min。
1.2.4 生化鉴定 按照王建科等报道的方法进行操作[17]。
1.2.5 分离菌的致病性试验 将纯化的菌株接种液体培养基,37 ℃培养48 h,BalB/C 小鼠腹腔注射分离菌株,每株菌株接种6只小鼠,菌液浓度均调整为1×109cfu/mL[15],每只小鼠注射300L 菌液,对照组小鼠注射生理盐水,连续观察3 d 记录小鼠死亡情况。
1.2.6 药敏试验 药敏试验根据美国临床标准委员会(NCCLS)推荐的方法进行。
1.2.7 分离菌株16S rRNA 基因同源性分析及发育树的构建 测序结果在GenBank 数据库中进行BLAST 比对分析,选出20 个与分离菌株测序结果相近的序列(参考菌株信息见表1),用DNAStar 软件对序列进行同源性比对分析,用Mega 6.0 软件构建系统发育树。
表1 缓慢葡萄球菌和奇异变形杆菌参考菌株信息Table 1 Reference strain information of and
表1 缓慢葡萄球菌和奇异变形杆菌参考菌株信息Table 1 Reference strain information of and
2 结果
2.1 临床症状和病理变化
发病初期水貂表现出趾间红肿,少量出血,采食、体温均正常,随时间推移趾间出现破溃、出血、糜烂的症状,有时会引起整只爪肿胀,如不及时治疗病貂会出现精神沉郁,食欲减退或废绝,体温升高,多数于几日内死亡。
发病集中主要表现在肺脏和肾脏。肺出血、肿胀,气管、支气管内呈现有粉红色的泡沫状液体;肾脏肿大、充血和出血,见图1。
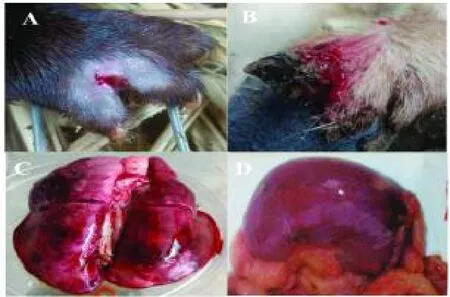
图1 水貂临床症状和病理变化Fig.1 Clinical symptoms and pathological changes of mink
2.2 细菌分离及形态特征
一种菌落大小均匀,呈白色或微黄色,不透明,形状为隆起的圆形,光滑湿润,边缘整齐。革兰氏染色镜检可见阳性、呈单个、成对和多个聚集的球菌。另一种游散生长,出现明显的迁徙现象,细菌可以蔓延成扩散的波纹状薄膜,革兰氏染色镜检可见阴性、中等大小杆菌,多单在,少数成对或短链排列,见图2。
2.3 生化鉴定
分离得到的革兰氏阳性菌分解七叶苷、山梨醇、水杨苷、甘露醇、蔗糖;不分解乳糖、核糖、阿拉伯糖、木糖和10%NaCl胰胨水;具有氨基酸脱羧酶活性;无赖氨酸尿素酶和脱羧酶活性,不分解西蒙氏枸盐酸盐、动力硝酸盐和丙二酸盐。分离得到的革兰氏阴性菌发酵蕈糖和葡萄糖,产酸产气,不发酵麦芽糖、果糖、乳糖、蔗糖、山梨醇和甘露醇,尿素酶、触酶和MR 试验阳性。V-P、吲哚、七叶苷和氧化酶试验阴性,三糖铁斜面阴性,底层阳性,产生H2S。根据《伯杰细菌鉴定手册》(第8 版),确定分离菌符合缓慢葡萄球菌和奇异变形杆菌的生化鉴定特性。
2.4 16S rRNA基因扩增
由图3 可知,以提取细菌基因组为模板,采用T1、T2 引物进行PCR 扩增,琼脂糖电泳可见约780 bp 处有一条特异的条带,与预计扩增产物片段大小完全相符,且无杂带。

图3 分离菌株16S rRNA 基因PCR 鉴定结果Fig.3 16S rRNA gene amplification results of the isolated strain
2.5 细菌毒理试验
攻毒小鼠在48 h 内死亡,对照组小鼠无变化。死亡小鼠剖检可见肺脏有出血点,肾脏和肝脏均肿大、出血。将小鼠内脏无菌涂板进行细菌分离鉴定,鉴定结果为分离菌株和攻毒菌株培养特性和染色特性一致,16S rRNA 基因鉴定确定分离菌株和攻毒菌株为同一株菌株。
2.6 药敏试验
分离菌株药敏试验结果显示,缓慢葡萄球菌对氨基糖苷类抗生素中丁胺卡那、庆大霉素、卡那霉素和新霉素敏感;四环素类抗生素只对米诺环素敏感;喹诺酮类抗生素只对氧氟沙星敏感;-内酯胺类抗生素中对羧苄西林和哌拉西林敏感。奇异变形杆菌对-内酯胺类抗生素中对羧苄西林、哌拉西林、头孢氨苄、头孢唑林、头孢拉定、头孢呋辛、头孢他啶和头孢曲松敏感;对氨基糖苷类抗生素中丁胺卡那、庆大霉素、卡那霉素和新霉素敏感;喹诺酮类抗生素只对氧氟沙星敏感,见表2。
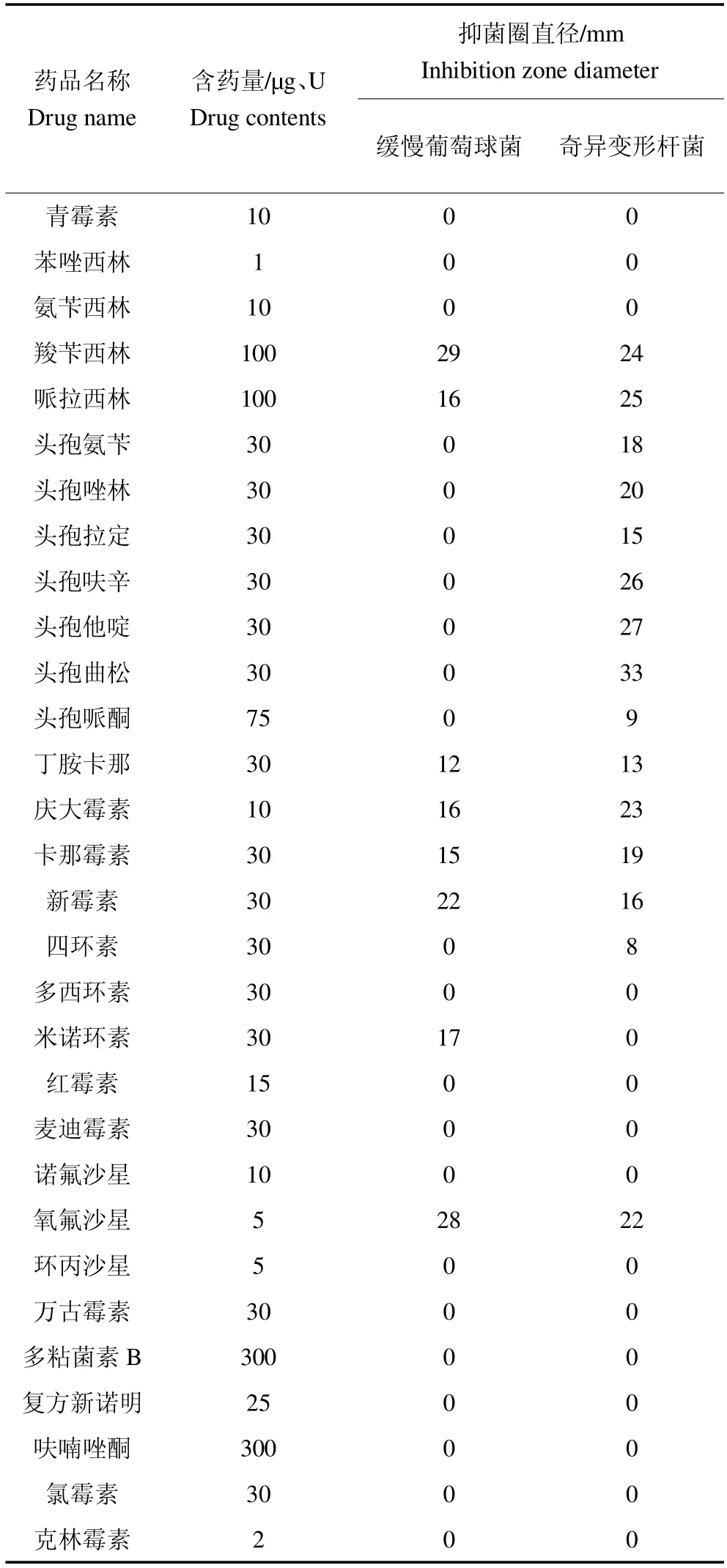
表2 药敏试验Table 2 Drug sensitivity test bacteriostatic zone test
2.7 分离株16S rRNA基因同源性分析及进化树构建
将PCR 产物进行测序,测序结果发现,缓慢葡萄球菌分离菌株与GenBank 中其他20 个缓慢葡萄球菌同源性在98%以上,与菌株1b 的同源性最高,为99.85%,但是菌株的来源不详,而与高盐环境中116SS2 菌株的同源性最低,为98.94%;奇异变形杆菌分离菌株与GenBank 中其他20 个奇异变形杆菌同源性在99%以上,与菌株R7、F22、F3、R1、G1 的同源性最高,为99.93%,而与菌株R10 的同源性最低,为99.51%,见图4 至图7。

图4 缓慢葡萄球菌与参考菌株16S rRNA 序列的进化树分析Fig.4 Phylogenetic tree based on 16SrRNA sequences of and other reference strains
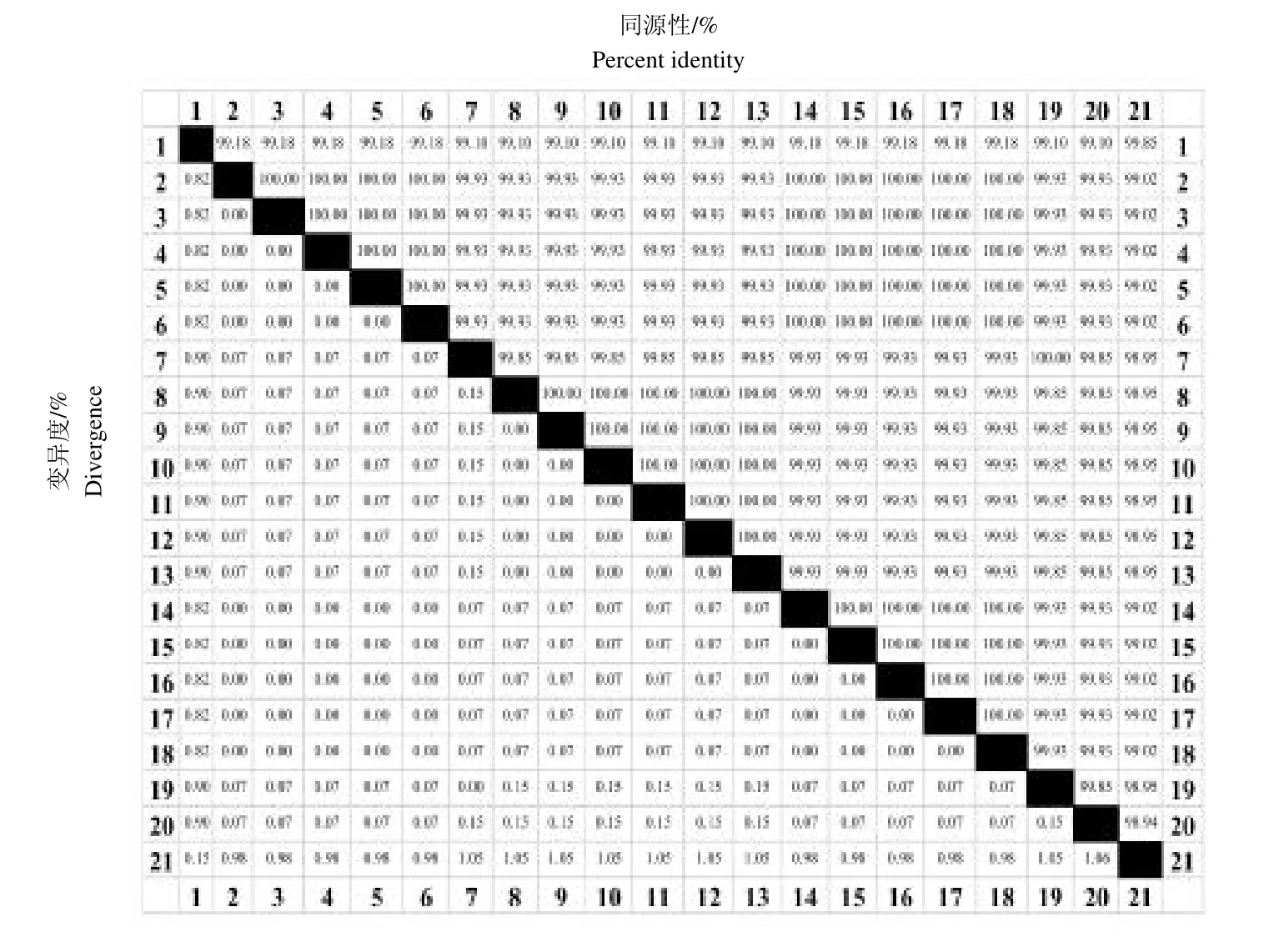
图6 缓慢葡萄球菌与参考菌株16S rRNA 序列同源性分析Fig.6 Homology analysis based on 16SrRNA sequences of and other reference strains
3 讨论
近年来,关于缓慢葡萄球菌和奇异变形杆菌感染人和动物的报道逐渐增多,两种致病菌对人和动物健康构成新的威胁[21,22]。本实验室从送检死亡水貂的趾间糜烂病灶、肺脏、脾脏和肾脏中分离得到2 株病原菌,采用细菌形态学观察、生化鉴定和分子生物学方法进行鉴定,结果表明分离得到的缓慢葡萄球菌和奇异变形杆菌为致病菌,小鼠致病性试验结果表明二者均有较强致病性。在趾间和各脏器中分离到相同的病原菌,进而推断,缓慢葡萄球菌和奇异变形杆菌首先引起水貂爪子病变,没有进行及时治疗,致使其进入血液,引起菌血症,最终导致动物死亡。
应用细菌高度保守的16S rRNA基因序列分析对细菌进行鉴定已经是国际上通用的鉴定技术[23],因此本研究采用通用引物对分离菌株的16S rRNA部分基因进行了扩增和测序,经过同源性比对及系统发育树构建,从分子水平上确定分离的2 株菌为缓慢葡萄球菌和奇异变形杆菌。同源性比对结果显示,缓慢葡萄球菌与b1 株的同源性最高,为99.85%,而与RCB409、RCB408 及RCB406 等株同源性最低,为98.95%,系统发育树结果显示,分离株与b1 在同一分支,但b1菌株来源不详,分支最远的是RCB409 和RCB408 等菌株,均来自蝙蝠粪便。奇异变形杆菌与R1、G1 和F3等菌株同源性最高,为99.93%,这些菌株均来源于毛皮动物,有趣的是与分支最远的R10 菌株也来自毛皮动物,所以推测奇异变形杆菌的亲缘关系与种属特异性有关系,造成这一结果可能与该菌有多种血清型有关。
缓慢葡萄球菌和奇异变形杆菌作为人兽共患病原菌,可对人类和动物的健康造成极大的威胁。本试验对分离的2 株病原菌用30 种抗生素进行药敏试验,结果显示缓慢葡萄球菌对其中的8 种抗生素敏感,氨基糖苷类比例最高,主要是丁胺卡那、庆大霉素、卡那霉素和新霉素,表明分离病原菌对多种抗生素均有较高的抗性,与朱丽霞等[15]报道的水貂感染缓慢葡萄球菌的药敏结果一致。但与朱富来等[4]报道的猪源缓慢葡萄球菌药敏试验结果不一致,与朱思明[5]报道的鹅源的药敏试验结果也不一致。奇异变形杆菌对14 种抗生素敏感,主要集中在-内酯胺类和氨基糖苷类抗生素,与王建科等[17]报道的貂源奇异变形杆菌药敏试验结果一致,与石同瑞[18]和王丽萍[19]报道的药敏试验结果差异较大,综合参考近年来人和动物缓慢葡萄球菌、奇异变形杆菌的药敏试验结果发现[15,19],2 种病原菌对绝大多数抗生素均有耐药性,且宿主不同,其耐药性也不同。近年来,抗生素的过度使用,造成了菌株耐药性的增加和多重耐药菌株的出现,给水貂养殖造成巨大的经济损失。因此,养殖过程中若发生细菌性疾病,首先要进行药敏试验,选择敏感药物,必要时可联合用药,以增强杀菌效果,减少水貂的发病和死亡。
4 结论
本研究在死亡水貂趾间溃烂病灶和内脏组织中均分离到相同病原菌,经16S rRNA 基因序列比对和系统进化分析,感染的病原菌为缓慢葡萄球菌和奇异变形杆菌,二者均有较强致病性和多重耐药性。
