自主神经对房水流出通道的调控作用△
2024-01-08韩佳伶徐丽娟冮晓睿梁远波
韩佳伶 徐丽娟 冮晓睿 周 涛 梁远波
青光眼是全球不可逆盲的首要原因[1]。据Tham等[2]统计,全球40~80岁人群青光眼患病率为3.54%,截至2020年,患者人数为7 600万,预计2040年将增至1.118亿。眼压是青光眼发生发展的关键因素,房水分泌和流出的调节是维持眼压在正常范围内的重要生理过程[3],但其调控机制目前尚未十分明确。随着研究的深入,有证据表明小梁网- 施莱姆管(SC)区域存在自主神经纤维,且可能具有调控房水流出的作用[4-5]。其中交感神经激活可能主要引起SC扩张、周长增加,房水流出阻力减少及眼压降低;而副交感神经的作用则相反[6-8]。为全面了解目前自主神经对眼压的调控研究进展,现就自主神经在房水生成及传统流出通道的调控作用做一概述。
1 自主神经对房水生成的影响
房水主要通过3种机制由睫状体上皮不断产生:主动分泌、扩散和超滤,平均产生速率为2.0~2.5 μL·min-1;产生的房水起着稳定眼部形态结构、运输神经递质、提供营养及去除代谢产物的作用[9]。睫状突的血流供应与房水的分泌有重要联系,这些血管同时受交感神经及副交感神经的支配(表1):

表1 眼部自主神经来源及分布
交感神经为来自颈上交感神经节的去甲肾上腺素能神经纤维,主要介导睫状体血管收缩;副交感神经通过翼腭神经节的节后神经纤维调控睫状体血流,刺激面神经引起翼腭神经节激活释放神经递质血管活性肠肽(VIP),导致睫状体血管舒张和血流量增加[10-11]。
Kiel等[12]研究发现,将麻醉后的兔子平均动脉压分别设定在40、55、70、80 mmHg(1 kPa=7.5 mmHg)时,睫状体血流灌注[保持在(58.01±0.97)灌注单位(P.U.)]及房水产生速率[约(3.08±0.08)μL·min-1]均无明显变化;但当睫状体血流灌注下降至低于40 P.U.(其基线水平的74%)时,睫状体血流灌注与房水产生速率呈线性函数关系式下降;以上研究提示当睫状体的血流灌注低于一定临界值时,房水的生成速率下降;这可能与房水产生机制中的主动分泌需要消耗的能量供应不足有关;进一步研究表明,睫状体血流灌注对房水生成速率的影响主要由氧气含量介导,睫状体血流灌注减少引起氧气含量减少到临界水平以下时,睫状体血流最大氧含量不能提供足够的腺苷三磷酸来维持离子运输,因此引起房水主动分泌下降,但血液氧含量过高也会抑制房水的生成,这一过程中可能存在某种反馈通路,起到精准调控房水产生速率的作用,但目前尚未完全阐明。总之,在一定的睫状体血流灌注范围内,自主神经引起的睫状体血管收缩与舒张对房水产生速率的影响并不显著,其对于眼压的调控主要通过调控房水流出通道发挥作用。
2 自主神经对房水流出的影响
2.1 自主神经在房水流出通道的分布
房水流出主要有2条途径:小梁网-SC途径,也称为传统流出途径,介导60% ~ 80%的房水流出;葡萄膜巩膜途径则引流20% ~ 40%的房水[13]。基于引流房水的主导作用,研究者主要聚焦于小梁网-SC途径,探究其房水流出的调控机制[14]。为明确自主神经在房水流出通道是否有分布,研究者通过自主神经标志物对人眼小梁网-SC区域的自主神经进行鉴定,发现人眼小梁网-SC区域均存在交感及副交感神经,而感觉神经纤维仅分布于小梁网周围[4-5],见图1。该研究结果为人眼小梁网-SC区域自主神经分布提供了间接佐证。此外,罗朝霞[15]通过大鼠顺行神经示踪,观察到小梁网-SC区域交感神经纤维由同侧颈交感神经节发出;而直接电刺激大鼠颈上交感神经节可观察到SC周长及横截面积减小,眼压升高;小梁网-SC区域交感神经递质表达增多。上述实验结果显示,来自颈上交感神经节的交感神经末梢分布至小梁网-SC区域,而颈交感神经节兴奋可通过小梁网-SC区域的交感神经纤维缩短SC周长,减小SC横截面积(SCAR),增加房水流出阻力,升高眼压。另外大鼠眼压随昼夜节律改变时,小梁网-SC区域的自主神经也呈现不同兴奋状态,如在全黑暗环境中,小梁网及SC附近交感神经纤维标志物多巴胺β羟化酶(DβH)表达上升,眼压升高[16]。上述实验通过对房水流出通道附近神经纤维标志物的测定,证明了人眼及大鼠眼小梁网-SC区域存在自主神经分布。但是对于小梁网-SC区域自主神经分布的直接证据仍有待进一步补充,如电镜下人眼小梁网-SC区域周围自主神经分布的发现还未见报道,这是未来值得深入探究的一个方向。
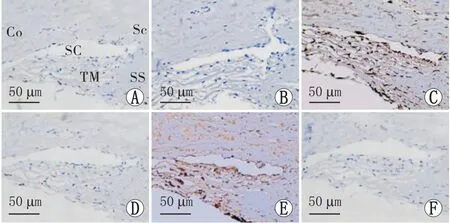
A:小梁网-SC组织DβH免疫组化染色;B:小梁网-SC组织TH免疫组化染色;C:小梁网-SC组织VIP免疫组化染色;D:小梁网-SC组织CGRP免疫组化染色;E:小梁网-SC组织VGluT2免疫组化染色;F:阴性对照。Co:角膜;Sc:巩膜;SC:Schlemm管;TM:小梁网; SS:巩膜突。图1 自主神经标志物在人小梁网-SC的表达(图片来源:季娉婷,华中科技大学,2020.)
2.2 自主神经对房水流出通道的调控作用
Chen等[6]发现,冷刺激实验中受试者全身交感神经兴奋,平均动脉压及平均眼部灌注压均升高;此时SCAR增加[(6 283.9±2 696.2)μm2比(10 422.0±3 643.8)μm2,P<0.001],眼压下降[(16.9±1.9)mmHg比(15.2±2.7)mmHg,P<0.001]。Li等[7]则观察到受试者在运动期间收缩压、舒张压、血浆儿茶酚胺和瞳孔直径均显著升高,同时平均SCAR和SC周长显著增加,眼压显著下降。此外,Yan等[17]的研究结果也显示,有氧运动会引起SC扩张及眼压下降。上述实验提示,交感神经可能参与了传统房水流出途径的调控,即交感神经兴奋时SC扩张、SC周长增加,房水流出阻力减少,眼压降低。
除受交感神经调控作用外,研究人员发现房水流出通道也受副交感神经调控。Chen等[8]在饮水试验中观察到受试者全身副交感神经兴奋(心率减慢及心率变异性的高频指数升高等);同时,SCAR下降[(6 521±1 360)μm2比(5 180±1 455)μm2,P<0.001],眼压升高[(14.9±2.7)mmHg比(18.4±3.3)mmHg,P<0.001]。其他研究者也观察到了类似结果[18-19]。而Chen等[20]的拟微重力实验则进一步佐证了失重状态下眼压升高与全身副交感神经兴奋引起SCAR下降有关。Sun等[21]的实验中,受试者在Valsalva动作第二阶段(即屏气时)可观察到全身交感神经兴奋,同时伴随SCAR显著增加及眼压显著增高等表现;在第四阶段(即恢复正常呼吸),受试者全身副交感神经激活,眼压恢复至基线水平,而SCAR则未见明显变化。上述实验结果显示,副交感神经兴奋时伴随眼部SC面积减小及眼压升高。不同实验眼部灌注压改变有所区别,其中饮水试验平均动脉压及眼部灌注压升高可能与血容量大量增加所致,但其对于房水生成量并无影响。上述实验提示,与交感神经兴奋时相反,副交感神经兴奋主要引起眼部SCAR减小,房水流出阻力增加,眼压升高。
以上实验均为活体进行,通过不同方式刺激全身自主神经系统,对眼部SC的形态及眼压进行分析,揭示了自主神经对房水流出通道及眼压的影响。值得注意的是,上述实验与前述电刺激颈交感神经引起交感神经激活时房水流出通道及眼压改变的结果相反,笔者推测可能与全身交感神经兴奋引起眼部其他组织结构(如睫状体)收缩对小梁网-SC区域牵拉有关。全身交感神经兴奋对局部房水流出通道的调控机制似乎更为复杂。另外,上述实验局限在于房水流出通道形态改变不能明确是由自主神经对小梁网-SC区域的直接调控作用产生还是源于间接的睫状体或虹膜牵拉。因此,仍需深入实验探究自主神经对小梁网-SC区域的调控机制。
3 自主神经对房水流出通道的调控机制
3.1 交感神经调控机制
交感神经主要分泌去甲肾上腺素、神经肽Y、腺苷三磷酸等神经递质,其中去甲肾上腺素由DβH催化多巴胺合成,主要起血管收缩作用[15]。交感神经激活可通过去甲肾上腺素与α肾上腺素能受体结合阻断内皮依赖性和血流介导的一氧化氮(NO)释放[22]。NO通过催化酶溶性鸟苷酸环化酶,刺激环化鸟苷单磷酸的产生,继而激活蛋白激酶G来介导小梁网及SC的扩张,降低眼压[23-24]。即交感神经激活可能通过抑制NO的产生,起到抑制SC及小梁网扩张的作用,从而增加房水流出阻力,使眼压升高。但这一机制无法解释在临床试验中观察到的全身交感神经兴奋引起的小梁网-SC扩张及眼压下降这一现象。
值得注意的是,当全身交感神经兴奋时,肾上腺素分泌量也会增加,但其降低眼压的作用机制还未明确。β2肾上腺素能受体在SC内皮细胞中表达[6]。研究发现,异丙肾上腺素与SC内皮细胞上的β2肾上腺素能受体的结合可促进SC内皮细胞的软化[25-26]。Ye等[27]给予健康受试者局部1%肾上腺素滴眼,观察到SC直径增加,SCAR增加,小梁网宽度增加,眼压也随之下降。Xu等[28]发现小梁网具有产生内源性VIP并通过旁分泌方式调控SC的功能;该研究通过肾上腺素模拟交感神经兴奋状态,在体内外实验中观察到,伴随交感神经兴奋,小梁网中内源性VIP分泌增加,即交感神经兴奋可能通过促进内源性VIP分泌影响下游通路,扩张塌陷的SC来降低眼压。因此全身交感神经兴奋时,虽然眼部去甲肾上腺素释放使房水流出阻力增加,但同时可能通过肾上腺素刺激内源性VIP分泌增加,促进SC及小梁网的扩张,综合效应达到眼压降低的效果。此外,交感神经激活可释放协同递质神经肽Y,神经肽Y具有强大的中枢和外周生物学效应,在心血管系统中也是一种重要的血管收缩递质[29]。但现有的研究仍未明确其在眼部对小梁网及SC的调控作用。
3.2 副交感神经调控机制
VIP是一种由28个氨基酸残基组成的神经肽,属于胰高血糖素/分泌素超家族,通过3个G蛋白偶联受体发挥神经元信号转导、平滑肌松弛和血管舒张等作用[30]。有研究发现,局部给予VIP可通过激活VIP受体2重调SC内皮细胞中F-肌动蛋白的正常分布,降低细胞刚度,扩展塌陷的SC并降低眼压;该作用通路可能通过腺苷酸环化酶/蛋白激酶A的刺激,蛋白激酶A诱导RAS同源基因家族成员A在Ser-188位点的磷酸化,并抑制RAS同源基因家族成员A/Rho相关蛋白激酶信号通路,从而减少细胞应力纤维的形成[31-33]。在外周神经系统中,VIP由副交感神经节后纤维释放,且实验表明小梁网及SC与血管类似,仅表达VIP受体2,可能与血管受副交感神经的舒张作用有关[34-35]。但小梁网-SC区域分布的副交感神经纤维激活时是否通过VIP对小梁网及SC进行调控仍不明确。此外,在脉络膜血流的调控中,副交感神经通过节后胆碱能神经纤维刺激内皮细胞上的M3受体产生血管舒张作用,同时促进内皮型NO的产生和释放,加强了血管的舒张[10]。但在小梁网-SC区域的副交感神经是否具有上述调控机制仍待实验的进一步探究。
4 结束语
眼压的升高是青光眼进展的重要危险因素。作为房水流出的主要通路,小梁网-SC区域调控房水流出及维持眼压平衡的机制仍未被完全揭示。上述研究中,交感神经或副交感神经的激活通过改变小梁网-SC区域的形态引起房水流出阻力的改变。而自主神经的调控机制主要以其释放的神经递质发挥作用。维持自主神经功能的稳态,对于青光眼的发生发展可能具有重要意义。对自主神经以小梁网-SC区域为靶器官进行眼压调控机制的阐明,为未来青光眼的治疗及临床药物的开发提供了新思路。因此,进一步深入研究自主神经对房水流出通道的调控作用具有重要意义。
