电针通过调控TLR4介导的炎症信号通路改善糖尿病干眼大鼠角膜炎症的机制研究△
2024-01-08傅张倚天万咪咪赖思华孙心怡李小颖高卫萍
傅张倚天 万咪咪 赖思华 孙心怡 李小颖 高卫萍
干眼是糖尿病常见的并发症,目前研究已明确将糖尿病列为干眼发生的危险因素之一[1]。糖尿病干眼发病与炎症密切相关[2],糖尿病干眼患者眼表的炎症会导致角膜上皮屏障破坏及角膜神经损伤[3-4],造成患者眼部干涩感、烧灼感及异物感等不适症状[5]。Toll样受体4(TLR4)是介导炎症反应的关键环节[6],广泛参与糖尿病及其相关并发症的发生发展,且在小鼠模型中被证实参与并加速了干眼的发病[7]。研究表明,电针能通过调节TLR4介导的炎症信号通路,减轻糖尿病大鼠机体的炎症反应[8],但电针对糖尿病干眼的作用鲜见报道。因此,本研究旨在观察电针对糖尿病干眼大鼠眼表体征的影响,比较角膜TLR4、磷酸化核因子-κB P65 (P-NF-κB P65)、白细胞介素(IL)-1β及IL-18的表达变化,探讨电针能否通过调控TLR4介导的炎症信号通路改善糖尿病干眼大鼠角膜的炎症,为临床电针治疗糖尿病干眼提供一定理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
健康雄性SD大鼠50只,鼠龄7周龄,体质量180~240 g,由南京中医药大学动物实验中心提供[SCXK(苏)2019-001]。动物被安置在南京中医药大学附属医院基础药理实验室,环境温度为(21±2)℃,相对湿度为40%~60%,可自由饮水和进食。动物实验符合国家实验动物福利伦理的有关规定,经南京中医药大学附属医院伦理委员会批准(批号:2022NL-KS093)。
1.1.2 主要试剂及仪器
链脲佐菌素(STZ;S0130,Sigma公司,美国);TLR4抗体(GB11519,Servicebio公司,中国);IL-18抗体(10663-1-AP,Proteintech公司,中国);P-NF-κB P65(Ser536)抗体(bs-0982R,Bioss公司,中国);IL-1 Beta抗体(AF4006,Affinity公司,中国);β-Tubulin (10094-1-AP,Proteintech公司,中国)。针灸针具(0.18 mm×13.00 mm,苏州医疗器械厂,中国);电针仪(华佗牌SDZ-II B型,苏州医疗器械厂,中国);Cochet-Bonnet角膜知觉仪(8630-1490-29-Aesthesiometer12/100,Luneau公司,法国)。
1.2 方法
1.2.1 糖尿病干眼模型造模
随机选取32只大鼠先予高糖高脂饲料(猪油+蔗糖+胆固醇+胆酸盐+普通饲料,质量比例:10.0%20.0%2.5%1.0%66.5%)饲养 4周后开始造模,腹腔注射含10 g·L-1STZ的柠檬酸缓冲液,STZ的剂量为30 mg·kg-1,在15 min内注射完毕[9]。注射后第3、7、9、11天相同时间段各测1次,连续3次随机血糖测量≥16.7 mmol·L-1,视为2型糖尿病大鼠模型造模成功[10]。然后待大鼠泪液分泌每20 s<7 mm、泪膜破裂时间(BUT)<5 s、角膜荧光素钠染色(FL)阳性,即认为糖尿病干眼模型成功建立[11]。最终,32只大鼠第12周成功诱导糖尿病干眼模型25只,4只大鼠不能诱导模型,2只大鼠死亡,成功率78%。
1.2.2 干预方法及分组
第12周糖尿病干眼模型成立,将造模成功的糖尿病干眼大鼠随机分成模型组、电针组、假针刺组、氟米龙组,共4个实验组,每组6只。另选取6只正常雄性SD大鼠作为空白组,用以对照。空白组予普通饲料饲养,其他4组继续予高糖高脂饲料饲养。模型组不做干预处理。电针组选取大鼠双侧“睛明”“攒竹”“丝竹空”“太阳”“瞳子髎”针刺,电针接“攒竹”“瞳子髎”,每次15 min,每天1次。电针仪参数为:疏密波,频率2 Hz/20 Hz,脉冲宽度0.2 ms,强度1 mA。假针刺组穴位刺激处同电针组,但用钝头针点刺治疗,不刺入以避免得气。氟米龙组大鼠双眼滴1 g·L-1氟米龙滴眼液,分别在每天8点钟、13点钟、18点钟进行干预,每天3次,每次1滴。各组干预时间均为2周。
1.2.3 随机血糖检测
分别在造模前、造模后、干预2周后采集大鼠尾尖静脉全血,利用快速血糖仪检测随机血糖浓度。
1.2.4 干眼相关指标检测
造模前、造模后、干预后各组大鼠均行BUT、FL、泪液分泌实验(PRT)、角膜机械知觉阈值(CTT)检测。其中,(1)BUT:生理盐水湿润荧光素钠试纸后轻触大鼠双眼下穹隆,使大鼠眨眼数次,荧光素钠均匀分布在角膜后睁眼,在手持式裂隙灯下记录第 1个角膜干燥斑出现的时间。(2)FL:角膜荧光素钠染色方法同上,在角膜中心做垂直和水平两条线将角膜划分为4个象限,手持裂隙灯下观察每个象限染色情况并评分,4个象限评分相加即为单目荧光染色分数。每个象限评分标准:无染色记为0分;点状染色少于30个记为1分;点状染色超过30个但无融合记为2分;点状染色超过30个且融合成片记为3分。(3)PRT:将酚红棉线末端向后折叠,将其放置于大鼠下眼睑穹隆部的外1/3处,辅助大鼠闭眼并保持20 s,取出线,测量泪液浸湿酚红后浸入线上的长度。(4)CTT:使用Cochet-Bonnet角膜知觉仪测量,将尼龙线调节至60 mm,尖端垂直轻触大鼠角膜的中心区域,进行3次重复刺激,如果有2次触发眨眼反射,则尼龙线的长度代表大鼠角膜机械知觉阈值。如果大鼠眨眼反射不满足上述条件,则将尼龙线依次递减5 mm,重复上述操作,直到满足条件为止。
1.2.5 HE染色观察大鼠角膜上皮细胞变化
干预2周后,各组大鼠均随机取3只吸入异氟烷(2 L·min-1)深度麻醉后,用40 g·L-1多聚甲醛灌注,取大鼠左眼角膜组织,进行石蜡包埋、切片。将切片置于载玻片后60 ℃烘烤,待水干后室温放置 30 min,进行HE染色,光学显微镜观察角膜组织形态学的变化。
1.2.6 免疫荧光组织化学染色法观察大鼠角膜组织中TLR4的表达
取1.2.5中灌流固定后的大鼠右眼角膜组织,进行石蜡包埋、切片。脱蜡后用 PBS 液洗涤,羊血清封闭,TLR4抗体(1500)4 ℃孵育过夜,Cy3标记山羊抗兔抗体(1600)室温孵育1 h。切片取出,组织染核后洗涤,用荧光淬灭密封剂密封。在荧光显微镜下观察、拍照。观察各组大鼠角膜组织中TLR4的表达。
1.2.7 Western blot检测大鼠角膜组织中TLR4、P-NF-κB、IL-1β及IL-18的表达
干预2周后,各组剩余3只大鼠吸入异氟烷(2 L·min-1)深度麻醉,断颈处死,即刻取出大鼠左眼角膜组织,-80 ℃保存备用。取角膜组织,提取蛋白、测定蛋白浓度;制胶、上样、电泳、转膜,用50 g·L-1的BSA封闭1 h;加入TLR4(11 000)、IL-18(15 000)、IL-1β(11 000)、P-NF-κB p65(11 000)及β-Tubulin(110 000)抗体4 ℃孵育过夜;加入山羊抗兔抗体(13 000)或山羊抗鼠抗体(13 000)室温孵育1 h,洗膜后加ECL显影、定影。凝胶成像分析系统上摄像分析,计算出目的蛋白条带相对灰度值。
1.3 统计学处理
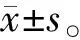
2 结果
2.1 各组大鼠随机血糖检测结果
造模前,各组大鼠随机血糖比较,差异均无统计学意义(均为P>0.05)。造模后及干预后,各实验组大鼠与空白组大鼠相比,随机血糖均显著升高,差异均有统计学意义(均为P<0.01)(表1)。
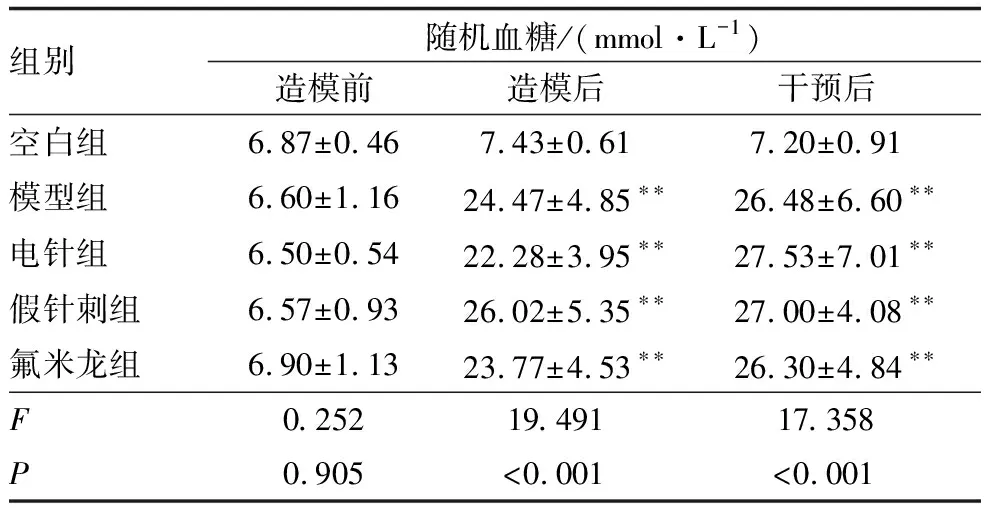
表1 各组大鼠造模前、造模后及干预后大鼠随机血糖比较
2.2 各组大鼠干眼相关指标检测结果
干眼相关指标检测结果显示,造模后,与空白组比较,各实验组大鼠BUT、泪液分泌量、CTT均下降,FL评分均升高,差异均有统计学意义(均为P<0.01);干预后,模型组大鼠FL评分、BUT、泪液分泌量、CTT分别为(8.17±2.79)分、(3.17±1.17) s、(4.00±1.26) mm、(20.83±5.85) mm。与模型组比较,电针组大鼠FL评分[(4.00±1.41)分]降低,BUT[(5.50±1.05)s]、泪液分泌量[(9.33±1.51)mm]及CTT[(34.17±5.85)mm]均升高,差异均有统计学意义(均为P<0.05);干预后,氟米龙组大鼠泪液分泌量为(6.33±1.63)mm,CTT为(25.00±6.32)mm,与氟米龙组比较,电针组大鼠泪液分泌量及CTT均升高,差异均有统计学意义(均为P<0.05)(表2)。
2.3 各组大鼠角膜HE染色结果
角膜HE染色显示,模型组和假针刺组大鼠角膜表面不光滑,角膜上皮细胞增厚且排列紊乱;电针组及氟米龙组大鼠角膜表面光滑,角膜上皮细胞排列整齐(图1)。
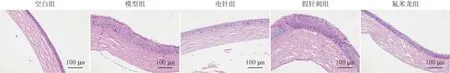
图1 各组大鼠干预2周后角膜HE染色结果
2.4 各组大鼠角膜TLR4阳性表达荧光强度比较
干预后,各组大鼠角膜TLR4阳性表达平均荧光强度结果显示(图2),与空白组(83.0±4.1)比较,各实验组大鼠角膜TLR4表达均升高(模型组:139.2±7.2,电针组:103.2±13.0,假针刺组:139.2±5.5,氟米龙组:105.4±14.6),差异均有统计学意义(均为P<0.05);与模型组比较,电针组及氟米龙组大鼠角膜TLR4表达均降低,差异均有统计学意义(均为P<0.01)。
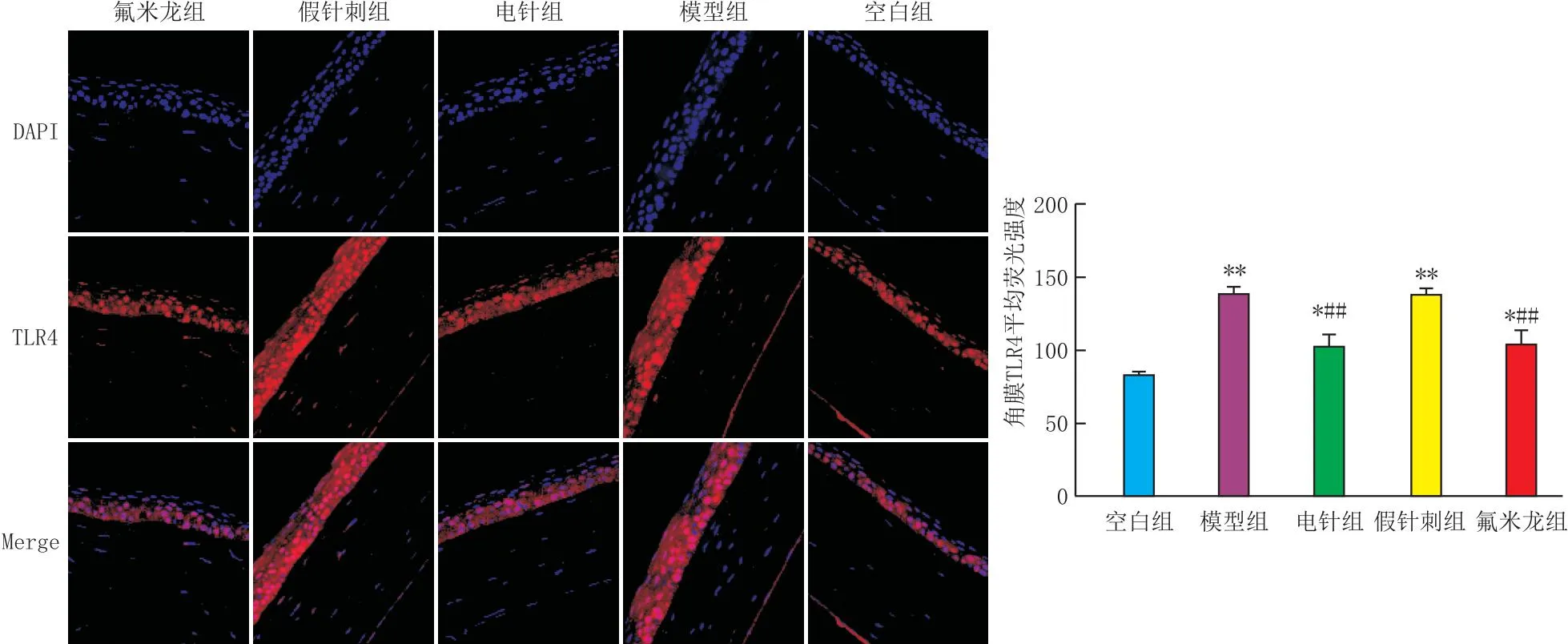
与空白组比较,*P<0.05,**P<0.01;与模型组比较,##P<0.01。图2 各组大鼠干预2周后角膜TLR4阳性表达平均荧光强度比较
2.5 各组大鼠角膜TLR4、P-NF-κB P65、IL-1β和IL-18 Western blot检测结果比较
干预后,与空白组(TLR4:0.8±0.2,P-NF-κB P65:0.7±0.1,IL-1β:0.5±0.3,IL-18:0.2±0.1)比较,模型组与假针刺组大鼠角膜TLR4(1.2±0.1,1.2±0.2)、P-NF-κB P65(1.3±0.1,1.2±0.1)、IL-1β(1.0±0.2,0.9±0.1)及IL-18(1.0±0.1,0.8±0.1)蛋白表达均增加,差异均有统计学意义(均为P<0.05);与模型组比较,电针组与氟米龙组角膜TLR4(0.9±0.1,0.8±0.1)、P-NF-κB P65(0.8±0.1,0.7±0.1)、IL-1β(0.5±0.2,0.5±0.2)和IL-18(0.3±0.1,0.4±0.2)蛋白表达均降低,差异均有统计学意义(均为P<0.05)(图3)。

与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与电针组比较,△P<0.05,△△P<0.01。图3 各组大鼠干预2周后角膜TLR4、P-NF-κB P65、IL-1β和IL-18蛋白表达
3 讨论
炎症是糖尿病干眼的重要发病机制。高血糖、晚期糖基化终未产物积累、氧化应激及NF-κB信号通路的激活会引起持续的促炎反应,持续的炎症反应会损伤眼表组织和影响泪膜稳态[12-13]。角膜上皮损伤是糖尿病干眼炎症的主要病理特征之一,炎症常导致角膜上皮细胞的减少及角膜神经损伤[14]。角膜神经损伤会降低角膜敏感性,导致眨眼频率降低,泪液蒸发过快从而加重干眼[15]。此外,高血糖会导致泪膜高渗,角膜结构(包括角膜上皮和角膜缘)暴露于泪膜高渗环境会导致一连串的炎症反应,进一步加重眼表炎症[16]。因此,抑制角膜的炎症反应对于治疗糖尿病干眼至关重要。
TLR4能介导慢性炎症性疾病,是预防和控制糖尿病及相关并发症的新兴靶点之一[17]。NF-κB作为TLR4的下游效应因子,是眼表炎症和疾病的重要枢纽,可介导多种炎症过程并促进细胞炎症基因的表达[18]。在葡萄糖水平高的部位,TLR4会在细胞表面表达上调,与髓样分化因子(MyD88)结合,刺激下游 NF-κB 磷酸化,并促进其核转移,随后促炎细胞因子和趋化因子(如IL-1β、IL-18等)表达上调,从而产生炎症反应[19-20]。
目前临床上常用于糖尿病干眼的滴眼液有人工泪液与类固醇激素滴眼液[21]。人工泪液没有直接的抗炎作用,治标不治本;类固醇激素滴眼液长期使用后,会产生眼压升高、白内障等不良反应[22-23]。因此,针对糖尿病干眼需要探寻有效且安全的治疗策略。
中医学中,糖尿病干眼归属于“白涩病”“消渴症”的范畴 。糖尿病干眼病位在目,多因肺、脾、肝、肾各脏腑阴虚化火,上攻于目,津液亏损所致[24]。针刺可促进经络循环,缓解眼表炎症,提高泪液分泌,从而达到持久疗效[25-26]。本实验选取“睛明”“攒竹”“丝竹空”“太阳”“瞳子髎”等眼周穴位进行研究干预。睛明穴作为五脉交会穴,与丝竹空穴及攒竹穴配伍使用,可加强清热明目之功;太阳穴作为经外奇穴之一,可与瞳子髎穴共同主治眼目疾患。诸穴合用,可达到滋阴清热,活络明目的效果。
本研究成功建立2型糖尿病干眼大鼠模型,并观察了电针对其的治疗作用。本研究结果显示,电针能提高2型糖尿病干眼大鼠的BUT、CTT及泪液分泌量,同时显著降低其FL评分。干预后,与氟米龙组相比,电针组大鼠CTT、泪液分泌量均增加,提示电针改善糖尿病干眼大鼠的角膜知觉与促进泪液分泌的效果可能优于氟米龙,体现出电针治疗糖尿病干眼的优势。此外,免疫荧光组织化学染色法和Western blot检测结果表明,电针能降低糖尿病干眼大鼠角膜中TLR4、P-NF-κB、IL-1β及IL-18的表达,说明电针能有效改善糖尿病干眼大鼠眼表的炎症。
4 结论
电针可以改善2型糖尿病干眼大鼠的眼表体征,并抑制角膜中TLR4、P-NF-κB P65、IL-1β及IL-18的表达,其作用机制可能与电针调控TLR4介导的炎症信号通路,从而抑制糖尿病干眼大鼠眼表炎症相关。电针可能是未来治疗糖尿病干眼有效且安全的策略,本实验不足之处在于未使用TLR4的拮抗剂和激动剂,电针对TLR4介导的炎症信号通路的调控作用还需进一步探索与证实。
