灵芝酸A 对人非小细胞肺癌PC-9 细胞增殖和凋亡的影响及其机制
2024-01-05任爱华鞠欣达柳骜飞刘永超刘岩峰
任爱华, 鞠欣达, 柳骜飞, 刘永超, 刘岩峰
(1. 北华大学基础医学院解剖教研室,吉林 吉林 132013; 2. 北华大学基础医学院免疫教研室,吉林 吉林 132013)
肺癌是全球癌症发病率和死亡率较高的恶性肿瘤,非小细胞肺癌(non small cell lung cancer,NSCLC)是我国肺癌患者死亡的主要类型[1]。肿瘤组织中丰富的血液供应为肿瘤的生长和转移提供必需的营养物质和氧气,因此在NSCLC 治疗中以抗血管生成治疗作为研究热点[2]。血管内皮生长因子(vascular endothelium growth factor, VEGF)是一种促血管生成因子,JABARI 等[3]认为:VEGF 在肺癌、乳腺癌、胃癌和结直肠癌等实体瘤组织中表达增加,参与肿瘤血管密度和浸润转移等特性的形成。诸兰艳等[4]发现:抗VEGF 药物与化疗结合可以改善NSCLC 患者的预后。VEGF 是血管生成的主要介质,可直接靶向肿瘤细胞促进肿瘤生长和转移[5]。20世纪90年代初,SEMENZA等[6]在缺氧诱导的细胞核提取物中发现缺氧诱导因子(hypoxiainducible factor,HIF)-1α 和HIF-1β,其中HIF-1α 具有主要活性。HIF-1α 作为一种常见的转录因子,广泛存在于缺氧状态下的哺乳动物体内[7-8]。HIF-1α 在缺氧环境下通过调控下游血管生长因子表达参与癌组织中血管生成过程[9]。研究[10-13]显示:HIF-1α 具有促进癌细胞增殖和侵袭等生物活性的作用,提示肿瘤细胞增殖和肿瘤血管生成与HIF-1α 及VEGF 有密切关联。HIF-1α 具有提高机体免疫力和降血压及血脂的保健作用,还可能具有抗肿瘤作用[14]。
灵芝又称仙草,灵芝中抗肿瘤活性成分包括多糖和三萜类化合物等,而三萜类化合物具有杀伤骨肉瘤、结肠癌和肝癌等肿瘤细胞的作用[15]。灵芝酸A(ganoderic acid A,GAA)是灵芝三萜类化合物中的一种。研究[16]显示:GAA 具有抗肿瘤作用。目前GAA 对NSCLC 的影响尚未完全阐明。本研究以NSCLC PC-9 细胞为研究对象,探讨GAA 对NSCLC 细胞增殖、迁移和凋亡的影响,并阐明其对VEGF 信号通路的调控作用,为NSCLC的治疗提供依据。
1 材料与方法
1.1 细胞、药物、主要试剂和仪器NSCLC PC-9 细胞购自美国ATCC 公司。GAA,纯度为98%,用DMSO 溶解,规格为每支20 mg,购自中国食品药品检定研究院。噻唑蓝(methyl thiazolyl tetrazolium,MTT)、兔抗人VEGF 单克隆抗体、兔抗人β-actin,胎牛血清、青霉素、庆大霉素、磷酸盐缓冲液(phosphate buffered saline,PBS)、胰蛋白酶、二甲基亚砜和DMEM 培养基(上海玉博生物科技有限公司),Transwell 小室实验试剂盒(北京优尼康生物科技有限公司),RNA 提取试剂盒(上海生物工程公司),实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)试剂盒(长沙赢润生物技术有限公司)。流式细胞仪(型号NovoCyte 2040R,美国ACEA 公司),PCR 仪(型号ABI7300,美国Thermo 公司),凝胶成像系统(型号Tanon5200,上海天能科技有限公司)。
1.2 细胞培养和分组将NSCLC PC-9 细胞置于含100 U·mL-1青霉素、100 mg·L-1庆大霉素和10% 胎牛血清的DMEM 培养基中,37 ℃、5%CO2培养箱中孵育,0.25%胰酶消化液消化传代,每3 d 传代1 次。取对数生长期细胞,采用不同剂量GAA 处理细胞,将细胞分为对照组(未加GAA)、低剂量GAA 组(0.1 mmol·L-1GAA)和高剂量GAA 组(0.5 mmol·L-1GAA)。
1.3 MTT 法检测各组PC-9 细胞增殖率取对数生长期PC-9 细胞,消化后以每孔1×104个细胞的密度接种于96 孔细胞培养板中,于37 ℃、5%CO2条件下孵育24 h,细胞贴壁后,弃培养液,将各组PC-9 细胞分别培养24、48 和72 h 后,弃培养液,各孔加入5 mg·L-1MTT 溶液20 μ L,继续孵育4 h,弃上清液,加入150 μL 二甲亚砜,避光振荡10 min,采用酶标仪于波长490 nm 处检测吸光度(A)值,实验共重复3 次,取3 次平均值,计算各组细胞增殖率。细胞增殖率=(实验组A 值-空白组A 值)/(对照组A 值-空白组A 值)×100%。
1.4 流式细胞术检测各组PC-9 细胞凋亡率将处于对数生长期PC-9 细胞以每孔1×106个细胞的密度接种于6 孔细胞培养板中,每孔加入细胞培养液2 mL,各组PC-9 细胞培养48 h,加入0.25%胰蛋白酶消化后制成单细胞悬液,加入1 mL 70%乙醇固定过夜,1 500 r·min-1离心5 min,弃上清,加入PBS 缓冲液洗涤细胞。加入5 μL Annexin Ⅴ-FITC 和 5 μL PI 染液混匀,37 ℃条件下避光染色30 min,采用流式细胞仪检测并计数细胞,计算各组细胞凋亡率。细胞凋亡率=凋亡细胞数/(凋亡细胞数+正常细胞数)×100%。
1.5 细胞划痕实验检测各组PC-9 细胞划痕愈合率将处于对数生长期PC-9 细胞以每孔1×106个细胞的密度接种于6 孔细胞培养板中,待细胞生长至约80%融合,采用20 μL 移液枪头沿无菌格尺于每孔中央部横向划痕,弃培养液,PBS 缓冲液洗涤,0 和24h观察各组细胞划痕面积,拍照记录,计算各组细胞划痕愈合率。细胞划痕愈合率=(划痕后0 h 划痕面积-划痕后24 h 划痕面积)/划痕后0 h 划痕面积×100%。
1.6 Transwell 小室实验检测各组PC-9 细胞迁移细胞数将处于对数生长期PC-9 细胞以培养液洗涤,调整细胞密度为1×106mL-1细胞悬液,于Transwell 小室的上室中加入200 μL 细胞混悬液,于下室中添加100 μL DMEM 培养基和10%胎牛血清。各组细胞由上室向下室聚集,培养24 h 后,下室细胞固定、结晶紫染色并于光镜下计数膜下细胞。于下室内采用显微镜随机选择5 个视野计数细胞并取平均值,计算各组PC-9 细胞迁移细胞数。
1.7 RT-qPCR 法检测各组PC-9 细胞中HIF-1α 和VEGF mRNA 表达水平取对数生长期PC-9 细胞,培养48 h 后经0.25%胰酶消化。所有引物均由云南博尚生物有限公司设计并合成。VEGF 上游引物:5′-GGACAAGTCACCACAGGA-3′,VEGF下游引物:5′-GGAGAAAATCAAGTCGTG-3′,片段长度142 bp;HIF-1α 上游引物:5′-AGCCAGACGATCAGCTAC-3′,HIF-1α 下游引物:5′-TGTGGTAATCCATCATCC-3′,片段长度167 bp;β-actin 上游引物:5′-GACTACCTCATGAAGGTC-3′,β-actin 下游引物:5′-GATCCACATCTGCTGGAA-3′,片段长度500 bp。反应条件:95 ℃、4 min 预变性,92 ℃、30 s,55 ℃、60 s,70 ℃、15 min,30个循环,70 ℃延伸10 min。采用2—△△Ct法计算目的基因表达水平。每组实验重复3 次
1.8 Western blotting 法检测各组PC-9 细胞中HIF-1α 和VEGF 蛋白表达水平取对数生长期PC-9 细胞,培养48 h 后经0.25%胰酶消化,加入细胞裂解液,冰上孵育30 min,4 ℃、1 500 r·min-1离心10 min,按试剂盒说明书操作测定蛋白总浓度,每孔上样量30 g。将蛋白样品沸水浴中5 min 变性后加入上样孔,电泳,300 mA 转膜30 min 至PVDF 膜,PBS 缓冲液HIF-1α 和VEGF 一抗稀释(1∶1 000),二抗室温孵育1 h,鉴定膜上的特定蛋白,凝胶成像系统拍照,采用Image J 软件分析蛋白条带灰度值,以β-actin 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。每组实验重复3 次。
1.9 统计学分析采用SPSS 17.0 统计软件进行统计学分析。各组PC-9 细胞增殖率、细胞凋亡率、细胞划痕愈合率、迁移细胞数、细胞中HIF-1α 和VEGF mRNA 及蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组PC-9 细胞增殖率与对照组比较,处理24 h 后,低剂量GAA 组细胞增殖率降低,但差异无统计学意义(P>0.05);处理48 和72 h 后,低剂量GAA 组细胞增殖率均降低(P<0.05);处理24、48 和72 h,高剂量GAA 组细胞增殖率均降低(P<0.05)。与低剂量GAA 组比较,处理24、48 和72 h,高剂量GAA 组细胞增殖率均降低(P<0.05)。见表1。

表1 各组PC-9 细胞增殖率Tab.1 Proliferation rate of PC-9 cells in various groups(n=6,x±s,η/%)
2.2 各组PC-9 细胞凋亡率与对照组(9.34%±1.54%) 比较,低剂量GAA 组PC-9 细胞凋亡率(12.51%±1.42%)略升高,但差异无统计学意义(P>0.05)。与对照组和低剂量GAA 组比较,高剂量GAA 组细胞凋亡率(21.23%±1.96%)升高(P<0.05)。见图1。
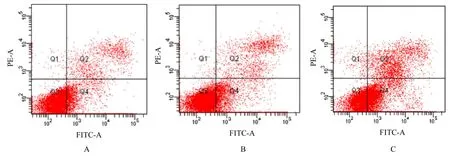
图1 流式细胞术检测各组PC-9 细胞凋亡率Fig. 1 Apoptotic rates of PC-9 cells in various groups detected by flow cytometery
2.3 各组PC-9 细胞划痕愈合率与对照组(38.15%±3.13%)比较,低剂量GAA 组PC-9 细胞划痕愈合率(30.98%±4.22%)降低,但差异无统计学意义(P>0.05)。与对照组和低剂量GAA 组比较,高剂量GAA 组细胞划痕愈合率(8.67%±2.14%)降低(P<0.05)。见图2。

图2 各组细胞划痕愈合情况Fig. 2 Scratch healing of cells in various groups
2.4 各组PC-9 细胞迁移细胞数与对照组(196.25 个±5.83 个)比较,低剂量GAA 组PC-9细胞的迁移细胞数(176.59 个±7.20 个) 减少,但差异无统计学意义(P>0.05)。与对照组和低剂量GAA 组比较,高剂量GAA 组PC-9 细胞迁移细胞数(108.71 个±5.28 个) 减少(P<0.05)。见图3。
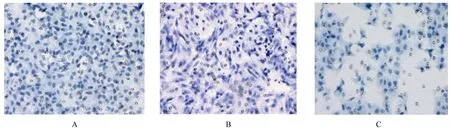
图3 Transwell 小室实验检测各组PC-9 细胞迁移情况(结晶紫,×200)Fig. 3 Migration of PC-9 cells in various groups detected by Transwell chamber assay (Crystal violet,×200)
2.5 各组PC-9 细胞中HIF-1α 和VEGF mRNA 表达水平与对照组比较,低剂量GAA 组PC-9 细胞中HIF-1α 和VEGF mRNA 表达水平降低,但差异无统计学意义(P>0.05),高剂量GAA 组PC-9细胞中HIF-1α 和VEGF mRNA 表达水平降低(P<0.05)。与低剂量GAA 组比较,高剂量GAA组PC-9 细胞中HIF-1α 和VEGF mRNA 表达水平降低(P<0.05)。见表2。

表2 各组PC-9 细胞中HIF-1α 和VEGF mRNA 表达水平Tab. 2 Expression levels of HIF-1α and VEGF mRNA in PC-9 cells in various groups(n=6,x±s)
2.6 各组PC-9 细胞中HIF-1α 和VEGF 蛋白表达水平与对照组比较,低剂量GAA 组PC-9 细胞中HIF-1α 和VEGF 蛋白表达水平降低,但差异无统计学意义(P>0.05);与对照组和低剂量GAA 组比较, 高剂量GAA 组PC-9 细胞中HIF-1α 和VEGF 蛋白表达水平降低(P<0.05)。见图4。
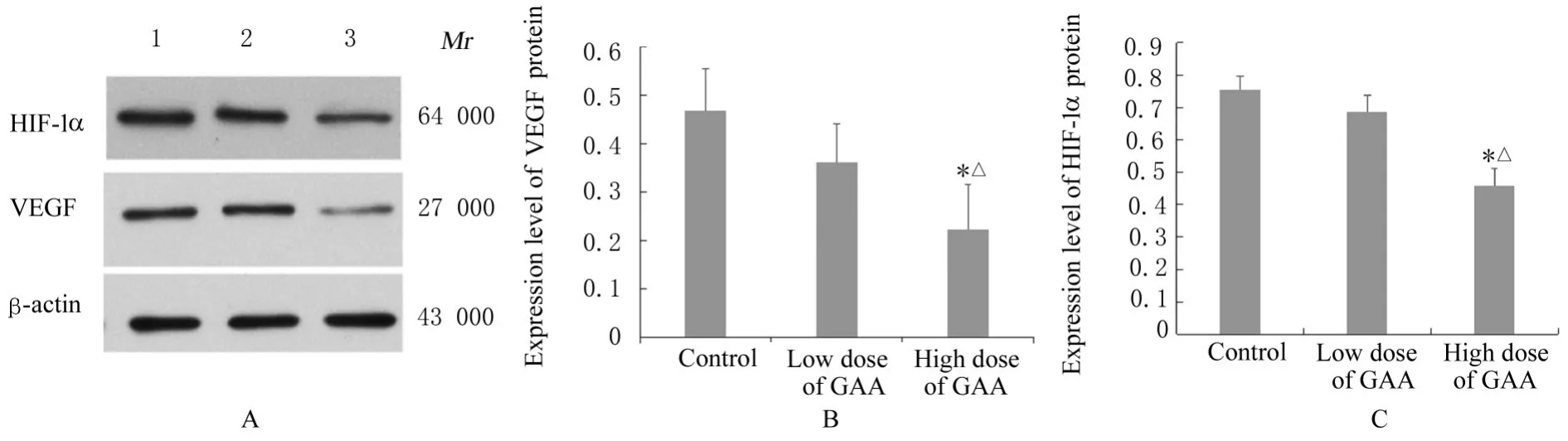
图4 各组PC-9 细胞中HIF-1α 和VEGF 蛋白表达电泳图(A)和直条图(B、C)Fig. 4 Electrophoregram (A) and histograms(B, C) of expressions of HIF-1 α and VEGF proteins in PC-9 cells in various groups
3 讨 论
肺癌是最常见的恶性肿瘤之一,其中以NSCLC 最为常见[17]。HIF-1α 参与调节肿瘤细胞的多种生物学活性,包括肿瘤细胞周期、肿瘤血管形成、肿瘤细胞代谢及肿瘤细胞转移和侵袭[18]。JIN 等[19]发现:在鳞状细胞肺癌中HIF-1α 显著高表达。研究[20]显示:在肿瘤的发生发展过程中,VEGF 对血管内皮细胞增殖、迁移和血管重建发挥重要作用,其对于肿瘤血管形成更为关键,因此VEGF 阻止血管的生成可以作为肿瘤防治中重要的研究方向。由此可见,HIF-1α 和 VEGF 可能是肺癌血管生成的重要因素。研究[21-22]显示:灵芝具有抗肿瘤和提高机体免疫力等作用。GAA 具有抑制乳腺癌、胶质瘤、骨肉瘤和前列腺癌等肿瘤的生物活性、 增殖及侵袭能力, 促进肿瘤细胞凋亡[23-25]。
本研究结果显示:高剂量GAA 对NSCLC PC-9 细胞增殖抑制作用明显,低剂量GAA 在48 h和72 h 抑制细胞增殖作用逐渐显现,表明低剂量GAA 延长作用时间也可抑制细胞增殖。采用流式细胞术检测细胞凋亡情况,结果显示:高剂量GAA 促进PC-9 细胞凋亡,与MTT 法检测结果一致;Transwell 小室实验结果显示:高剂量GAA 可抑制PC-9 细胞迁移能力,低剂量GAA 对于抑制PC-9 细胞增殖和细胞迁移及促进凋亡作用并不明显,提示GAA 对肿瘤生物活性的抑制作用与剂量有关,这与林晓萌等[24]的研究结果一致。本研究结果显示:低剂量GAA 对PC-9 细胞中HIF-1α 和VEGF mRNA 及蛋白表达无下调作用,而高剂量GAA 可明显抑制PC-9 细胞中HIF-1α 和VEGF mRNA 及蛋白表达。HIF-1α 和VEGF 在NSCLC组织中的表达与疾病发生发展、转移、预后和治疗有关联[26]。高剂量GAA 可抑制肿瘤细胞的生物活性,可能与其下调HIF-1α 和VEGF mRNA 及蛋白表达有关。
综上所述,高剂量GAA 可抑制PC-9 细胞增殖,促进其凋亡,其机制可能与调控VEGF 和HIF-1α mRNA 及蛋白表达有关。
