lncRNA GPRC5D-AS1 对地塞米松诱导小鼠成肌细胞肌萎缩的抵抗和再生作用及其机制
2024-01-05张瑞鹏
张瑞鹏, 李 杰
(吉林大学第一医院干部病房,吉林 长春 130021)
肌萎缩是指肌肉的体积和质量减小及肌肉正常功能受损,其发生主要与肌肉蛋白质代谢异常、肌细胞异常凋亡和肌肉及血管再生困难等有关[1]。研究[2]显示:肌萎缩与铁死亡之间有密切关联,铁超载破坏了线粒体的功能和形态,导致肌肉萎缩。研究[3]显示:在肌萎缩动物模型和患者的肌肉中均存在铁积累。非必要铁积累会引起铁代谢或线粒体功能紊乱,与骨骼肌萎缩有关联[4]。LU 等[5]通过高剂量地塞米松建立的骨质疏松小鼠模型进一步证实了铁死亡与骨质疏松症的关系。过量使用糖皮质激素也可能通过p62-Keap1-核因子-红细胞2 相关因子2 (nuclear factor erythroid 2-related factor 2,Nrf2)通路引发铁死亡[6]。因此,铁死亡是肌萎缩发生的原因之一。
长链非编码RNA (long non-codingRNA,lncRNA) 广泛存在于动植物细胞中,能够与DNA、RNA 或蛋白质相互作用,调控生物体的各项生理过程。研究[7]显示:在骨骼肌和肌肉萎缩细胞模型中,lncRNA GRPC5D-AS1 可能是引起肌萎缩及衰老相关疾病的关键RNA。在肺癌中,lncRNA GRPC5D-AS1 在自噬、代谢、丝裂原活化蛋 白 激 酶 (mitogen-activated protein kinase,MAPK)途径和Janus 激酶(Janus kinase,JAK)/信号传导及转录激活蛋白(signal transducer and activator of transcription,STAT)途径均有调控作用[8]。前期研究[9]证实:lncRNA GPRC5D-AS1可能参与骨骼肌肌肉萎缩。因此,本研究探讨lncRNA GPRC5D-AS1 对地塞米松诱导的小鼠成肌细胞肌萎缩的抵抗和再生作用,并阐明其可能的作用机制,为临床治疗和新药研发提供参考。
1 材料与方法
1.1 细胞、主要试剂和仪器小鼠成肌细胞C2C12细胞(北京北纳创联生物科技有限公司)。地塞米松(美国Med Chemexpress 生物科技公司),胎牛血清、DMEM 培养基和双抗(美国Gibco 公司),噻唑蓝(methyl thiazolyl tetrazolium,MTT)细胞增殖和细胞毒性检测试剂盒(北京百瑞极生物有限公司),TRIzol 总RNA 提取试剂和PrimeScript™RT Master Mix 试剂盒(日本TaKaRa 公司),引物合成由湖南艾克瑞生物公司完成,铁离子(Fe2+)试剂盒和丙二醛(malondialdehyde,MDA) 试剂盒(武汉Elabscienc 公司), 活性氧(reactive oxygen species,ROS) 检测试剂盒(上海翌圣生物公司)、长链脂酰辅酶A 合成酶(long-chain acylcoenzyme A synthetase,ACSL)4、溶质载体家族7成员 11 (solute carrier family 7 member 11,SLC7A11)、谷胱甘肽过氧化酶4 (glutathione peroxidase 4, GPX4)、 甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH) 和辣根过氧化物酶 (horseradish peroxidase,HRP) 标记的山羊抗兔二抗(英国Abcam 公司),lncRNA GRPC5D-AS1-OE (广东Ribobio 生物技术公司有限公司)。高速冷冻离心机(美国 Beckman Coulter 公司),光学显微镜和激光共聚焦显微镜(日本 Olympus 公司),全波长酶标仪(美国MD 公司),电泳检测系统(美国BioRad公司),超薄切片机(Leica UC7)(奥地利维也纳徕卡仪器有限公司),透射电子显微镜HT7700(日本日立仪器公司), 150 目方华膜铜网(AZH150)(北京中镜科仪技术有限公司)。
1.2 细胞培养和肌萎缩模型构建将C2C12 细胞置于含10%胎牛血清和1%青-链霉素的DMEM 培养基中,于37 ℃、5% CO2的恒温培养箱中常规培养,定期观察,每3 d 更换1 次培养基,当细胞融合度达85% 以上时,更换为含0、25、50、75、100、 200 和400 mg·L-1地塞米松的DMEM 培养基,分别培养24、48 和72 h 后,加入0.25%胰蛋白酶消化。取对数生长期细胞,以每孔5×103个细胞的密度接种至96 孔细胞培养板中,每孔100 μL。每孔加入20 μL MTT 试剂,继续孵育4 h。孔中加入二甲基亚砜(dimethyl sulfoxide, DMSO),37 ℃烘箱中孵育0.5 h。采用酶标仪检测波长490 nm 处各孔吸光度(A)值,计算细胞存活率。细胞存活率=(实验孔A 值-空白孔A 值)/(对照孔A 值-空白孔A 值)×100%。根据不同浓度地塞米松诱导不同时间后C2C12 细胞的存活率筛选最佳作用剂量和时间。采用实时荧光定量PCR(real-time quantitative PCR, RT-qPCR) 法检测C2C12 细胞中lncRNA GPRC5D-AS1 表达水平,以验证肌萎缩模型。
1.3 细胞分组和转染取生长状态良好的C2C12细胞分为正常组、模型组、lncRNA GRPC5DAS1-NC 组(转染lncRNA GRPC5D-AS1-NC) 和lncRNA GRPC5D-AS1-OE 组 (转 染 lncRNA GRPC5D-AS1-OE)。正常组细胞常规培养,其余各组细胞采用100 mg·L-1地塞米松诱导构建肌萎缩细胞模型,出现明显的细胞萎缩、细胞体积减小和形态改变即为造模成功[10]。lncRNA GRPC5DAS1-OE 由广东Ribobio 生物技术公司有限公司合成。选取对数生长期C2C12细胞,以每孔1×105个细胞的密度接种至24 孔细胞培养板中,每孔1 mL。 采用 Lipofectamine 2000 分别将lncRNA GRPC5D-AS1-NC 和lncRNA GRPC5D-AS1-OE 转染至对应组中。
1.4 RT-qPCR 法检测各组细胞中lncRNA GRPC5D-AS1 表达水平采用TRIzol 试剂提取各组总RNA,按照试剂盒说明书操作,逆转录为cDNA,进行RT-qPCR 反应。反应条件: 95 ℃、5 min,95 ℃、15 s,55 ℃、15 s,72 ℃、1 min,72 ℃、5 min,共30 个循环。采用2-ΔΔCt法计算各组细胞中lncRNA GRPC5D-AS1 表达水平。引物序列见表1。
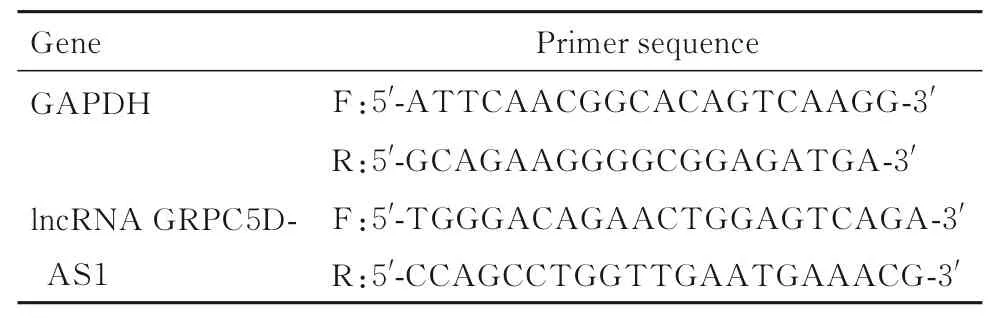
表1 引物序列Tab.1 Primer sequences
1.5 流式细胞术检测各组细胞中ROS 水平选取各组对数生长期细胞,制备为200 μL细胞悬液,接种于6 孔细胞培养板中培养。加入C11 BODIPY 581/591 染液,37 ℃、5% CO2培养箱中孵育0.5 h。弃去培养液,消化并收集细胞, 250 μL 磷酸盐缓冲液(phosphate buffer saline,PBS) 重悬,采用流式细胞仪检测各组细胞中ROS 水平。
1.6 酶 联 免 疫 吸 附 试 验(enzyme-linked immunosorbent assay,ELISA)法检测各组细胞中MDA、Fe2+和GPX4 水平各组细胞给药处理后,消化并收集细胞,按照试剂盒操作说明书操作,采用酶标仪分别于波长532、593 和450 nm 处检测吸光度(A) 值,以A 值代表各组细胞中MDA、Fe2+和GPX4 水平。
1.7 透射电镜观察各组细胞线粒体超微结构表现各组细胞置于2.5%戊二醛中固定2~4 h,磷酸漂洗液漂洗3 次,1%锇酸4 ℃固定2 h;双蒸水漂洗3 次后乙醇梯度脱水,环氧丙烷过渡,812 树脂梯度渗透后包埋,60 ℃聚合,采用Leica UC7 型超薄切片机进行半薄定位和超薄切片,醋酸双氧铀和柠檬酸铅双染色,透射电镜观察各组细胞超微结构表现。
1.8 免疫荧光法检测各组细胞中成肌分化蛋白(myogenic differentiation protein,MyoD)表达情况选取各组细胞,4 ℃孵育MyoD一抗(1∶100)过夜,次日Hank’s平衡盐溶液(Hank’s balanced salt solution,HBSS)常温洗涤3次,四甲基罗丹明异硫氰酸酯(tetramethylrhodamine isothiocyanate,TRITC)标记荧光二抗(1∶5 000) 室温下孵育1 h,HBSS 洗涤细胞2 次,DAPI(1∶10 000) 室温下孵育5 min,HBSS洗涤细胞3次,荧光显微镜下观察并拍照,红色代表MyoD 表达,蓝色代表细胞核。
1.9 Western blotting 法检测各组细胞中铁死亡相关蛋白ACSL4、SLC7A11 和GPX4 蛋白表达水平收集并裂解细胞,进行蛋白定量,上样、转膜和封闭,4 ℃一抗孵育过夜,ACSL4、SLC7A11 和GPX4 抗体稀释比例为1∶1 500,GAPDH 抗体稀释比例为1∶2 000。次日二抗(1∶5 000) 孵育。采用凝胶成像仪成像,采用Image J 软件分析蛋白条带灰度值,以GAPDH 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.10 统计学分析采用SPSS 17.0 统计软件进行统计学分析,采用 Graphpad 9.4.1 软件绘制统计图。各组细胞存活率,细胞中lncRNA GRPC5DAS1 表达水平,细胞中GPX4、Fe2+和MDA 水平,ACSL4、SLC7A11 和GPX4 蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用独立样本t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 肌萎缩模型验证与0 mg·L-1地塞米松比较,25、50 和75 mg·L-1地塞米松诱导的C2C12 细胞存活率无明显变化;200 和400 mg·L-1地塞米松诱导的C2C12 细胞存活率较低,无法用于后续实验。因此,选用100 mg·L-1地塞米松进行后续实验。与诱导0 h 比较,诱导24 h 后C2C12 细胞存活率无明显变化;诱导72 h 后C2C12 细胞存活率较低;因此,选用诱导时间为48 h。见表2 和3。RT-qPCR 法检测结果显示:与正常C2C12 细胞(1.002±0.090) 比较,100 mg·L-1地塞米松诱导48 h 后C2C12 细胞中lncRNA GPRC5D-AS1表达水平(0.359±0.010)降低(P<0.05),证实lncRNA GPRC5D-AS1 在肌萎缩模型中具有调控作用。
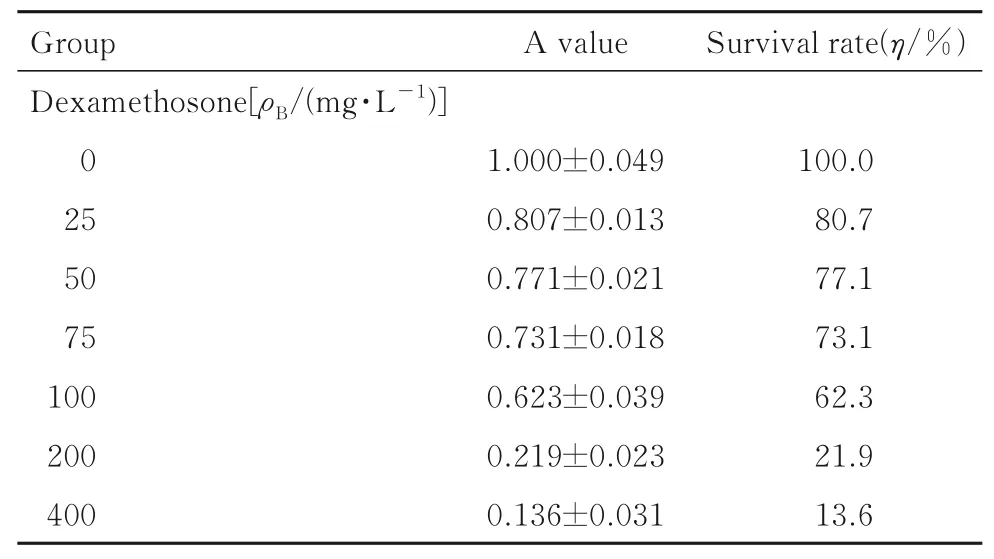
表2 不同剂量地塞米松作用后C2C12 细胞存活率Tab. 2 Survival rates of C2C12 cells after treated with different doses of dexamethasone(n=5)
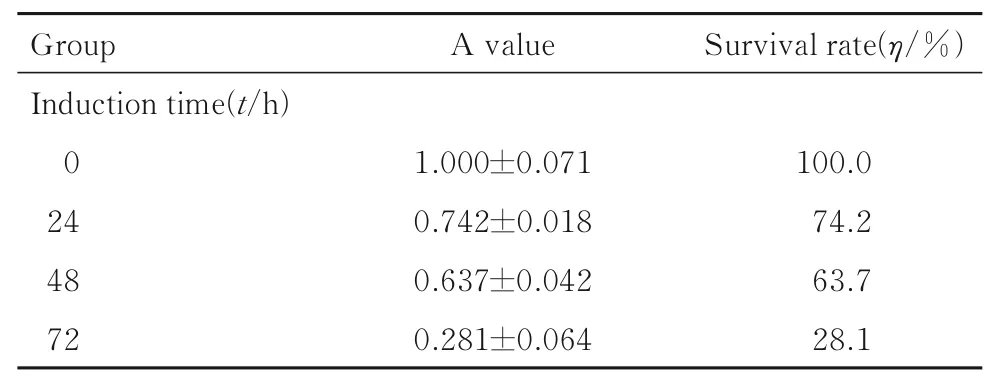
表3 作用不同时间后C2C12 细胞存活率Tab. 3 Survival rates of C2C12 cells after treated for different time(n=5)
2.2 各组细胞中lncRNA GRPC5D-AS1 表达水平与正常组比较, 模型组细胞中lncRNA GRPC5D-AS1 表达水平降低(P<0.05)。与模型组和lncRNA GRPC5D-AS1-NC 组比较,lncRNA GRPC5D-AS1-OE 组细胞中lncRNA GRPC5DAS1 表达水平升高(P<0.05)。模型组和lncRNA GRPC5D-AS1-NC 组细胞中lncRNA GRPC5DAS1 表达水平比较差异无统计学意义(P>0.05)。见图1。
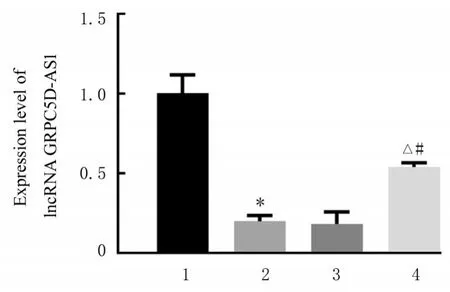
图1 各组细胞中lncRNA GRPC5D-AS1 表达水平Fig. 1 Expression levels of lncRNA GRPC5D-AS1 in cells in various groups
2.3 各组细胞中ROS 水平与正常组比较,模型组细胞中ROS 水平升高(P<0.05)。与模型组和lncRNA GRPC5D-AS1-NC 组 比 较, lncRNA GRPC5D-AS1-OE 组细胞中ROS 水平降低(P<0.05)。模型组和lncRNA GRPC5D-AS1-NC 组细胞中ROS 水平比较差异无统计学意义(P>0.05)。见图2。
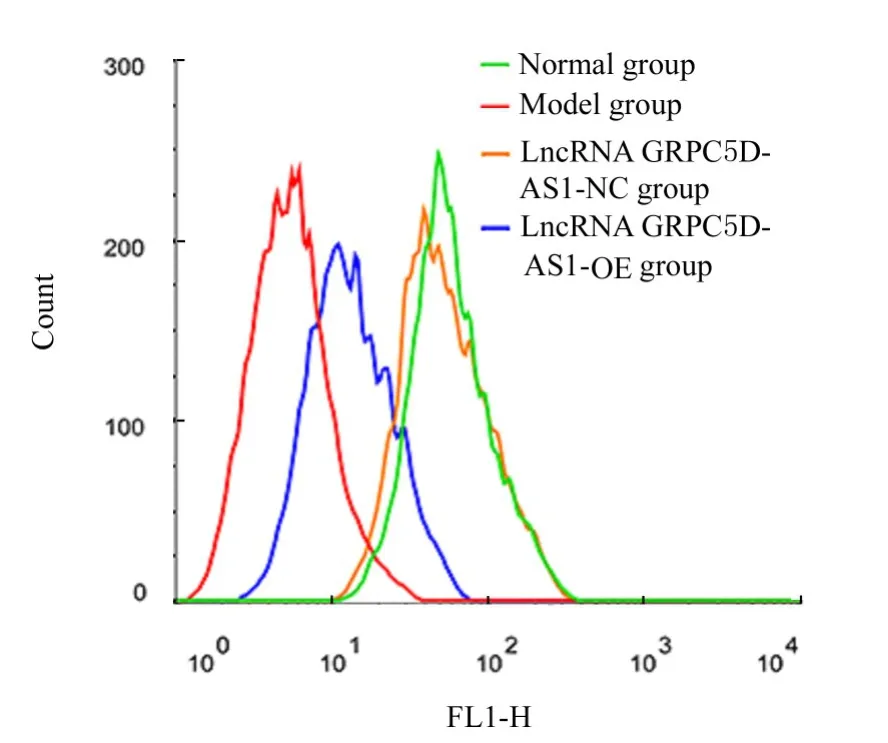
图2 流式细胞术检测各组细胞中ROS 水平Fig. 2 Levels of ROS in cells in various groups detected by flow cytometry
2.4 各组细胞中GPX4、Fe2+和MDA 水平与正常组比较,模型组细胞中Fe2+和MDA 水平升高(P<0.05),GPX4 水平降低(P<0.05)。与模型组和lncRNA GRPC5D-AS1-NC 组比较,lncRNA GRPC5D-AS1-OE 组细胞中Fe2+和MDA 水平降低(P<0.05),GPX4 水平升高(P<0.05)。模型组和lncRNA GRPC5D-AS1-NC 组细胞中GPX4、Fe2+和MDA 水平比较差异无统计学意义(P>0.05)。见表4。
表4 各组细胞中GPX4、Fe2+和MDA 水平Tab. 4 Levels of GPX4、Fe2+ and MDA in cells in various groups[n=3,±s,ρB/(ng·L-1)]

表4 各组细胞中GPX4、Fe2+和MDA 水平Tab. 4 Levels of GPX4、Fe2+ and MDA in cells in various groups[n=3,±s,ρB/(ng·L-1)]
*P<0.05 vs normal group; △P<0.05 vs model group;#P<0.05 vs lncRNA GPRC5D-AS1-NC group.
?
2.5 透射电镜观察各组细胞线粒体超微结构表现正常组细胞外形圆整,大小正常,膜上绒毛丰富,线粒体细胞器形态正常;模型细胞中线粒体数量减少,胞浆颗粒化,线粒体结构模糊肿胀并出现典型铁死亡相关现象;lncRNA GRPC5D-AS1-NC组细胞中线粒体数量和体积均增加,线粒体嵴数量增加,线粒体结构清晰;lncRNA GRPC5D-AS1-OE 组细胞中线粒体数量有所增加,胞浆颗粒化现象减少,线粒体结构较清晰。见图3。
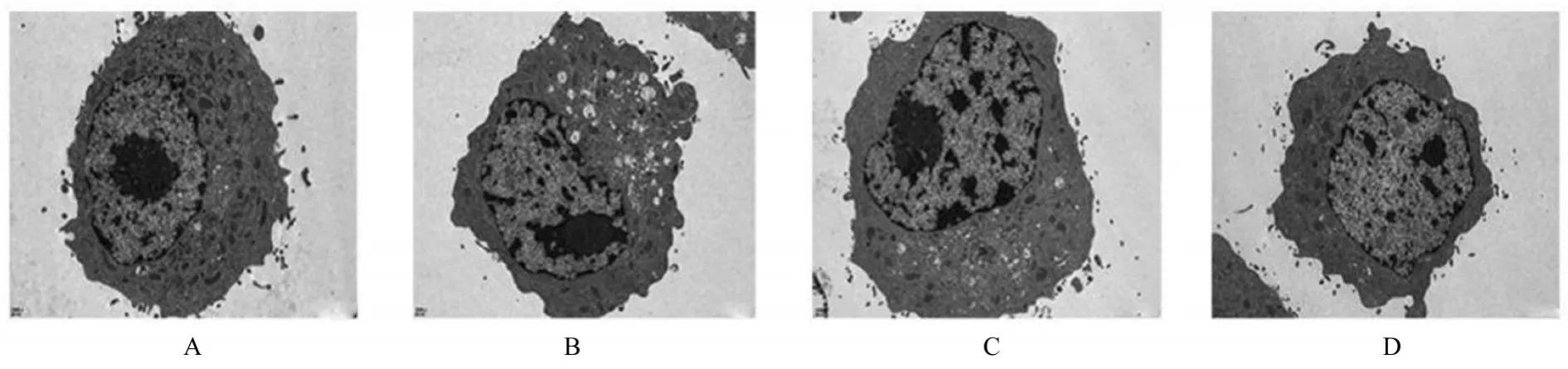
图3 透射电镜观察各组细胞中线粒体超微结构表现(×2 500 )Fig. 3 Ultrastructure morphology of mitochondrial in cells in various groups observed by transmission electron microscope(×2 500)
2.6 各组细胞中MyoD 表达情况与正常组比较,模型组细胞中MyoD 表达量减少,细胞发生肌萎缩。与模型组和lncRNA GRPC5D-AS1-NC 组比较,lncRNA GRPC5D-AS1-OE 组细胞中MyoD 表达量明显增加,细胞肌萎缩现象缓解,成肌细胞再生较多。见图4。
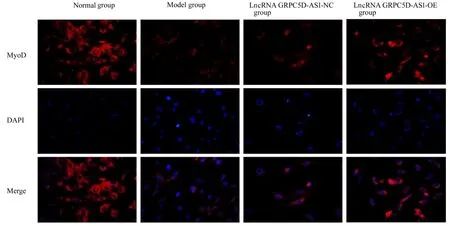
图4 免疫荧光法检测各组细胞中MyoD 表达情况(×400)Fig. 4 Expression of MyoD in cells in various groups detected by immunofluorescence(×400)
2.7 各组细胞中ACSL4、SLC7A11 和GPX4 蛋白表达水平与正常组比较,模型组细胞中ACSL4蛋白表达水平升高(P<0.05), SLC7A11 和GPX4 蛋白表达水平降低(P<0.05)。与模型组和lncRNA GRPC5D-AS1-NC 组 比 较, lncRNA GRPC5D-AS1-OE 组细胞中ACSL4 蛋白表达水平降低(P<0.05),SLC7A11 和GPX4 蛋白表达水平升高(P<0.05)。模型组和lncRNA GRPC5DAS1-NC 组细胞中ACSL4、SLC9A11 和GPX4 蛋白表达水平比较差异无统计学意义(P>0.05)。见图5。
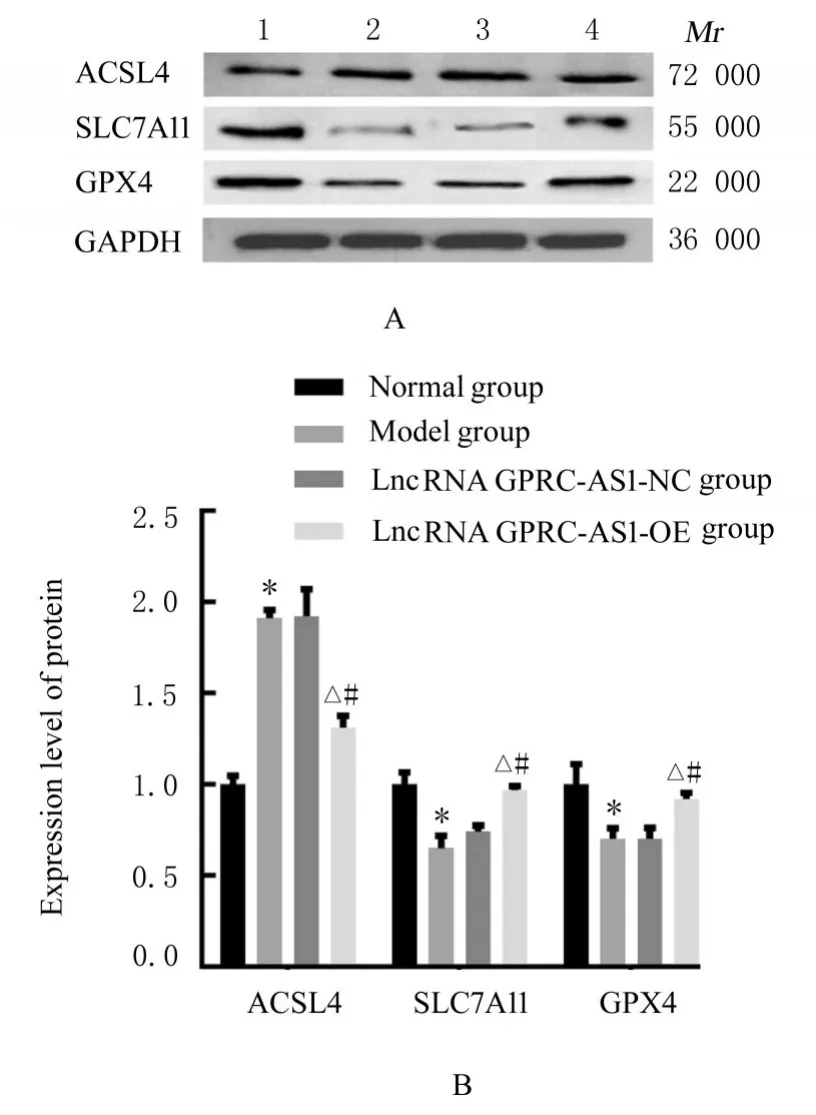
图5 Western blotting 法检测各组细胞中ACSL4、SLC7A11 和GPX4 蛋白表达电泳图(A)和直条图(B)Fig. 5 Electrophoregram(A) and histogram(B) of expressions of ACSL4,SLC7A11 and GPX4 proteins in cells in various groups detected by Western blotting method
3 讨 论
地塞米松由于其强大的抗炎和抗休克的功能在医学领域广泛使用。然而长期服用地塞米松会伴随肌肉萎缩等不良反应,且肌肉萎缩一旦发生则难以逆转。骨骼肌质量和功能的完整性对维持肌肉骨骼系统的正常功能和代谢稳态至关重要。本课题组前期研究[7]证实:lncRNA AC004797.1、lncRNA PRKG1-AS1 和lncRNA GRPC5D-AS1 是骨骼肌衰老的关键 lncRNA。 lncRNA PRKG1-AS1 和lncRNA GRPC5D-AS1 可缓解地塞米松诱导的肌萎缩和细胞衰老现象[7]。
由于地塞米松的广泛使用,铁相关的骨骼肌疾病成为研究热点。研究[11]显示:肌萎缩症与铁死亡之间有密切关联。研究[9,12]显示:在去神经诱导的骨骼肌萎缩模型中可检测到线粒体中ROS 水平升高,且在肌肉质量缺失前已有升高趋势。提示线粒体中ROS 水平可能是影响肌萎缩发生的重要因素。铁死亡是以铁依赖性细胞内脂质ROS(lipid-ROS,L-ROS)积累为主要特征的细胞死亡方式,主要表现为细胞精细结构中出现较小的线粒体,线粒体膜收缩,线粒体嵴减少或消失,外膜断裂,细胞核形态变化不明显[13-15]。本研究结果显示:肌萎缩模型中,线粒体数量减少,且线粒体嵴减少或消失并伴随线粒体结构肿胀,与铁死亡典型的精细结构变化一致;过表达lncRNA GRPC5DAS1 后,线粒体形态变化缓解。流式细胞术检测结果显示:与肌萎缩模型组比较,过表达lncRNA GRPC5D-AS1 后细胞中ROS 水平降低,提示lncRNA GRPC5D-AS1 可调节铁死亡抵抗地塞米松所致的肌萎缩现象。
SLC7A11 作为铁死亡的最关键的上游调节因子之一,研究[16]显示:SLC7A11 驱动铁死亡抗性,在多种疾病中发挥重要调控作用。SLC7A11不仅是铁死亡的有效靶标,也可在多种疾病的治疗中发挥重要作用[17-20]。SLC7A11 蛋白表达下调,通过抑制半胱氨酸代谢通路导致细胞内胱氨酸水平降低和谷胱甘肽(glutathione,GSH)生物合成耗竭,进一步抑制GPX4 蛋白活性,导致脂质过氧化物堆积,最终诱导细胞发生铁死亡[21-24]。研究[12-13,25]显示:铁离子在触发P53-SLC7A11 介导的肌肉铁死亡中发挥关键作用,并表明靶向铁积累和铁死亡可能是治疗肌少症的治疗策略。ACSL4是ACSL 家族中一员,在体内催化合成脂酰CoA作为脂肪酸分解代谢的第一步反应。ACSL4 可活化长链多不饱和脂肪酸以参与膜磷脂的合成。其中,ACSL4 将花生四烯酸和肾上腺酸分别合成为花生四烯酰CoA 和肾上腺酰CoA,使二者参与磷脂酰乙醇胺或磷脂酰肌醇等带负电膜磷脂的合成。膜上的长链多不饱和脂肪酸在RSL3 等因素的诱导下被氧化,从而引发细胞铁死亡[26-28]。通过抑制ACSL4 使肌肉细胞中GPX4 蛋白表达水平升高,脂质过氧化产物减少,改善横纹肌溶解症的发生发展[23]。
本研究结果显示:在地塞米松诱导的肌萎缩细胞模型中,SLC7A11 蛋白表达水平降低,抑制GPX4 表达,使ACSL4 表达水平升高,造成脂代谢异常,细胞中ROS 水平升高及Fe2+和MDA 水平降低,诱发铁死亡;过表达lncRNA GRPC5D-AS1能够刺激SLC7A11 表达进而激活GPX4,抑制ACSL4 蛋白表达,激活脂代谢,降低细胞中ROS水平,抑制铁死亡,提示lncRNA GRPC5D-AS1可通过SLC7A11/GPX4/ACSL4 信号轴抑制地塞米松引起的铁死亡现象。
肌源性调节家族(myogenic regulatory family,MRF)在调节肌肉细胞中的基因转录、细胞生长周期和分化等方面发挥作用。MyoD 作为MRF 家族中的一员,是一种骨骼肌特异性bHLH 转录因子,参与肌肉分化和修复[29]。研究[30]显示:MyoD 可严格控制肌肉干细胞增殖和分化间的平衡,并可作为维持肌肉生长和修复所需的细胞因子。 本研究结果显示:地塞米松作用后,细胞铁死亡加剧,肌萎缩细胞模型中MyoD 表达减少,造成修复再生障碍;过表达lncRNA GRPC5D-AS1可抵抗地塞米松诱导的铁死亡,促进MyoD 表达,激活成肌细胞再生。
综上所述,地塞米松作用C2C12 细胞后,细胞发生铁死亡,成肌细胞再生障碍,lncRNA GPRC5D-AS1 可介导SLC7A11/GPX4/ACSL4 信号通路抑制地塞米松引起的铁死亡,促进成肌细胞再生。
