聚岩藻多糖对小鼠巨噬细胞分泌炎症因子的影响及其机制
2024-01-05周雪冰林千千李艳春
周雪冰, 林千千, 李艳春
(吉林大学第一医院小儿呼吸科,吉林 长春 130021)
近年来,呼吸道病毒引起机体炎症因子风暴的机制成为研究热点。研究[1]显示:非典型肺炎病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)、中东呼吸系统综合征冠状病毒(respiratory syndrome coronavirus in the Middle East,MERS-CoV)、SARS-CoV2 和甲型流感病毒H1N1 等呼吸道病毒具有传染性强和高致病性等特点,可导致重症呼吸道感染,严重者会产生呼吸衰竭,其病情进展与病毒和机体免疫系统相互作用后所致的过度炎症性免疫反应诱发细胞因子风暴有关。因此,通过调节免疫反应辅助治疗呼吸道感染,特别是预防病情进展方面的研究受到广泛关注。
细胞因子风暴涉及多种炎症因子,如白细胞介素6 (interleukin-6, IL-6)、 肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、单核细胞趋化因子1(monocyte chemoattractic facter-1,MCP-1)、巨噬细胞炎性蛋白(macrophage inflammatory protein)-1α 和MIP-1β 等。聚岩藻多糖是一类主要由L-岩藻糖和硫酸酯基团构成的多糖,主要来源于褐藻和海洋无脊椎生物,其生物活性与多糖的相对分子质量及化学结构有密切关联[2-3]。研究[4]显示:聚岩藻多糖具有抗炎、抗肿瘤、抗氧化、抗病毒、抗菌、免疫调节、降血糖和降血脂等多种生物活性,在医药领域有较大的应用潜力。不同的原料及提取分离纯化的方法对其结构均有一定影响,进而影响其生物活性。巨噬细胞是来源于造血系统的免疫细胞,在维持组织稳态和炎症反应中起关键作用,可执行必要的组织特异性功能并保护机体免受感染[5]。关于聚岩藻多糖对巨噬细胞分泌炎症因子IL-6 和TNF-α 及趋化因子的影响尚未完全阐明。本研究以脂多糖(lipopolysaccharide,LPS) 刺激的RAW264.7 细胞为体外模型,探讨聚岩藻多糖对巨噬细胞分泌炎症因子IL-6 和TNF-α 及趋化因子MCP-1、MIP-1α 和MIP-1β 的影响,并阐明其免疫调节作用。
1 材料与方法
1.1 细胞、主要试剂和仪器小鼠RAW264.7 细胞购自中国科学院上海生命科学研究院细胞库。LPS 购自美国Sigma 公司, 10% 胎牛血清和DEME 培养基购于美国Gibco 公司,聚岩藻多糖由吉林省中科晶恒医药科技有限责任公司李帆博士自山东明月海藻集团购置原料后加工、制备并赠予,IL-6、TNF-α、MCP-1 和MIP-1β 等酶联免疫吸附试 验 (enzyme-linked immunosorbent assay,ELISA) 试剂盒购自美国Cloud-Clone Crop 公司,MIP-1α ELISA 试剂盒购自美国Bio-techne 公司。Epoch 2 酶标仪购自美国Bio-Tek 公司。
1.2 细胞培养和分组RAW264.7 细胞培养于含10%胎牛血清的DMEM 培养基,置于37 ℃、5%CO2恒温培养箱中,取对数生长期细胞用于后续实验。将RAW264.7 细胞分为对照组(DMEM 培养基培养)、LPS 组(给予400 μg·L-1LPS) 和LPS+聚岩藻多糖组(给予400 μ g·L―1LPS 和100 mg·L-1聚岩藻多糖)。
1.3 CCK-8 法检测各组RAW264.7 细胞存活率取对数生长期RAW264.7 细胞,以每孔1×106个细胞的密度接种于96 孔细胞培养板,每组6 个复孔,并设计调零孔。于培养12~16 h 后于待测孔中加入10 μL CCK-8 试剂,混匀后置于37 ℃、5%CO2培养箱中培养4 h。去除孔内气泡,采用酶标仪于波长450 nm 处测定各孔吸光度(A)值,计算各组细胞存活率。细胞存活率=(实验组A 值-空白组A值)/(对照组A值-空白组A值)×100%。
1.4 ELISA 法检测各组RAW264.7 细胞培养上清中炎症因子水平取对数生长期的RAW264.7 细胞,以每孔1×106个细胞的密度接种于96 孔细胞培养板,待细胞贴壁后弃去上清液,分别加入400 μg·L-1LPS 或100 mg·L-1聚岩藻多糖单独或联合孵化16 h,离心后收集上清液,采用ELISA 法检测各组细胞培养上清中IL-6、MCP-1、MIP-1α、MIP-1β 和TNF-α 水平,单位均为ng·L-1。以上操作均严格按照试剂盒说明书进行。
1.5 统计学分析采用GraphPad Prism 8.0 统计软件进行统计学分析。各组细胞存活率和各组细胞培养上清中IL-6、TNF-α、MCP-1、MIP-1α 及MIP-1β 水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用Turkey 检验法。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组RAW264.7 细胞存活率与对照组比较,LPS 组和LPS+聚岩藻多糖组细胞存活率均明显升高(P<0.01)。与LPS 组比较,LPS+聚岩藻多糖组细胞存活率明显降低(P<0.01)。见图1。
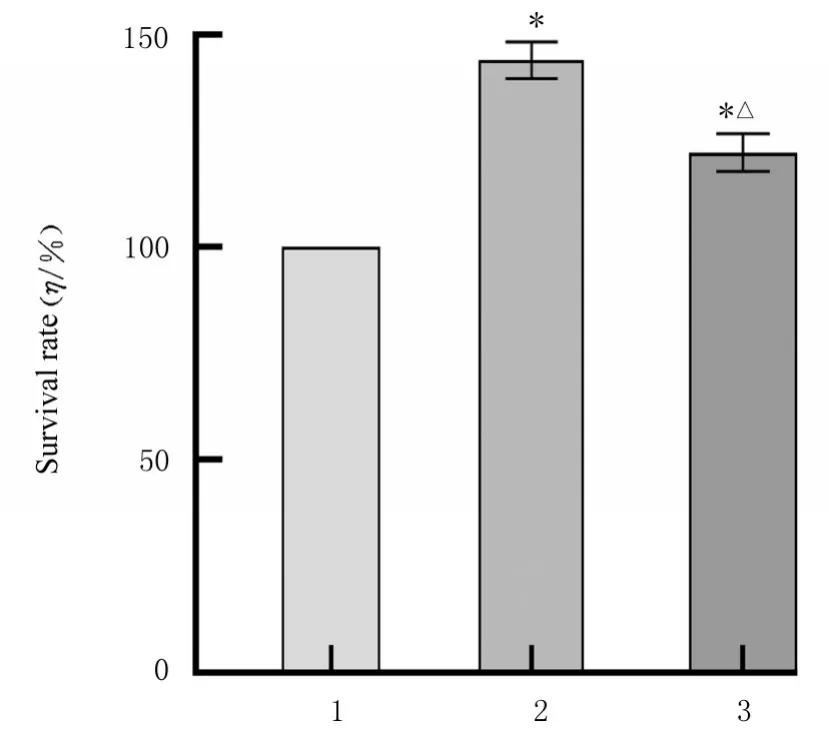
图1 各组细胞存活率Fig. 1 Survival rates of cells in various groups
2.2 各组RAW264.7 细胞培养上清中IL-6 和TNF-α 水平与对照组比较,LPS 组和LPS+聚岩藻多糖组细胞培养上清中IL-6和TNF-α 水平均明显升高(P<0.01)。与LPS 组比较,LPS+聚岩藻多糖组细胞培养上清中IL-6 和TNF-α 水平均明显降低(P<0.01)。见图2。

图2 各组细胞培养上清中IL-6(A)和TNF-α(B)水平Fig. 2 Levels of IL-6(A) and TNF-α(B) in culture supernatant of cells in various groups
2.3 各组RAW264.7 细胞培养上清中MCP-1、MIP-1α 和MIP-1β 水平与对照组比较,LPS 组和LPS+聚岩藻多糖组细胞培养上清中MCP-1、MIP-1α 和MIP-1β 水平均明显升高(P<0.01)。与LPS 组比较,LPS+聚岩藻多糖组细胞培养上清中MCP-1、MIP-1α 和MIP-1β 水平均明显降低(P<0.01)。见图3。
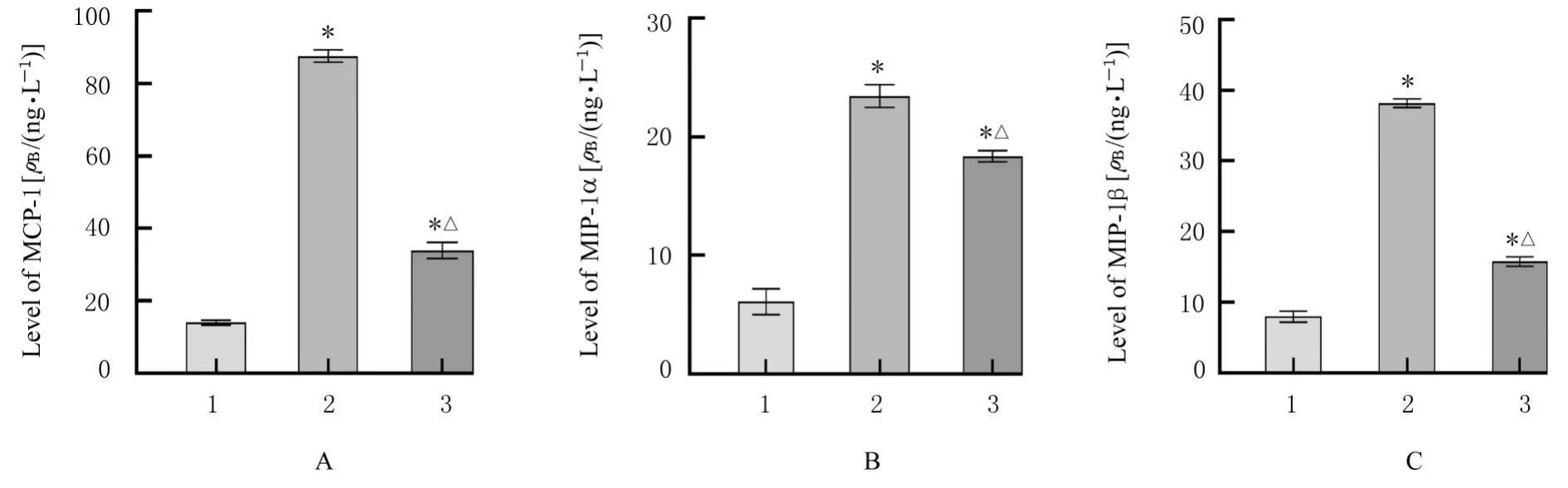
图3 各组细胞培养上清中MCP-1(A)、MIP-1α(B)和MIP-1β(C)水平Fig. 3 Levels of MCP-1(A), MIP-1α(B), and MIP-1β(C) in culture supernatant of cells in various groups
3 讨 论
细胞因子风暴是一种全身系统炎症反应,与传染性和非传染性疾病有关,可由感染和药物等多种因素诱发,是阻碍重症呼吸道病毒感染恢复并导致其进展为急性呼吸窘迫综合征和多器官衰竭乃至死亡的关键因素[6-8]。IL-6 和TNF-α 是细胞因子风暴中重要的细胞因子,聚岩藻多糖对IL-6 和TNF-α分泌的影响目前尚未完全阐明。由褐藻裙带菜中纯化的褐藻糖胶可促进人类中性粒细胞和自然杀伤细胞(natural killer cell,NK) 的活化及促炎细胞因子IL-6、IL-8 和TNF-α 产生,并延迟其自发凋亡[9-10]。但体外细胞系和动物模型的体内实验[6]均证实聚岩藻多糖可减少IL-6 和TNF-α 的分泌,减轻炎症反应。研究[11-12]显示:由褐藻中纯化的多糖可降低LPS 刺激后的RAW264.7细胞系分泌IL-6和TNF-α,多糖可能通过下调核因子κB (nuclear factor kappa-B,NF-κB) 和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK) 信号通路而发挥作用。
趋化因子是一类结构相似和具有趋化功能的小分子细胞因子,组织损伤时趋化因子表达增加,大部分趋化因子被认为是促炎因子[13]。促炎趋化因子的释放导致中性粒细胞、单核细胞/巨噬细胞和淋巴细胞等免疫系统细胞聚集到感染部位,而微环境中细胞浸润的类型和丰度对细胞因子风暴反馈回路的发展至关重要[14-16]。MCP-1、MIP-1α 和MIP-1β均为趋化因子CC 家族成员。研究[17]显示:与健康对照组比较,新型冠状病毒感染(Corona Virus Disease 2019,COVID-19) 患者血清中MCP-1、MIP-1α 和MIP-1β 水平升高, 且入住ICU 后COVID-19 患者具有更高水平的MCP-1 和MIP-1α。研究[18]显示:与对照组比较,COVID-19 患者支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)样本中MCP-1、MIP-1α 和MIP-1β 水平明显升高,同时还观察到MCP-1 受体CCR2 和MIP-1α 受体CCR5 等趋化因子受体的转录增加。MIP-1α 和MIP-1β 水平的变化还与肺部其他疾病有关联,矽肺患者血清中MIP-1α 和MIP-1β 水平较正常健康者升高,重症肺炎患者和多发伤所致急性呼吸窘迫综合征并发肺部感染患者血清中MIP-1α 水平均升高,且与疾病严重程度有关联[19-21]。
目前关于聚岩藻多糖对趋化因子MCP-1、MIP-1α 和MIP-1β 影响的研究较少。研究者[22]通过构建放射性肺损伤的小鼠模型,采用聚岩藻多糖干预发现聚岩藻多糖可降低小鼠胸水中MCP-1 的表达。BUIJSERS 等[23]在实验性肾小球肾炎小鼠模型中证实聚岩藻多糖能够降低实验小鼠血浆中MCP-1 水平。HUWAIT 等[24]在人单核THP-1 巨噬细胞的体外实验中证实聚岩藻多糖能够显著降低MCP-1 的水平。研究[25-27]显示:从海地瓜和美国海参中提取的聚岩藻多糖能够有效改善胰岛素抵抗小鼠的肝脏炎症反应,降低MIP-1 水平。本研究应用RAW264.7 小鼠巨噬细胞系在体外实验中证实,聚岩藻多糖可降低巨噬细胞对趋化因子MCP-1 分泌的影响,且能够降低巨噬细胞中MIP-1α和MIP-1β趋化因子的分泌。
综上所述,聚岩藻多糖可降低小鼠巨噬细胞对炎症因子IL-6、TNF-α、MCP-1、MIP-1α和MIP-1β分泌的影响,具有减轻细胞因子风暴的潜能,可能成为临床上调节重症肺炎免疫功能的备选物质,为聚岩藻多糖的临床应用提供实验依据。
