TIGIT 和PD-1/PD-L1 双重阻断途径在肿瘤免疫治疗中的研究进展*
2024-01-04王顺娜高浏璐郑晓凤邢国静王丽菲邵慧娟于晓辉综述张久聪审校
王顺娜 高浏璐 郑晓凤 邢国静 王丽菲 邵慧娟 于晓辉 综述 张久聪 审校
组织细胞表面的程序性死亡蛋白配体-1(programmed death-ligand 1,PD-L1)通过与淋巴细胞表面的程序性死亡蛋白-1(programmed death-1,PD-1)结合可发挥抑制淋巴细胞功能,从而诱导活化的淋巴细胞凋亡,发挥自身免疫耐受的作用。然而PD-L1 在多种肿瘤细胞表面也均有表达,其与存在于相应淋巴细胞表面的PD-1 结合后可通过抑制淋巴细胞并抑制细胞因子的释放,诱导淋巴细胞凋亡,进而导致肿瘤细胞发生免疫逃逸。因此,阻断PD-1/PD-L1 通路可以增强淋巴细胞活性以达到肿瘤免疫治疗的效果。而T细胞免疫检查点的发现和抑制检查点的单克隆抗体的成功开发可以很大程度上提高抗肿瘤免疫治疗的疗效。当前,在众多免疫治疗靶点中最具研发前景和潜力的免疫受体酪氨酸抑制基序(immunoreceptor tyrosinebased inhibition motif,ITIM)结构域(T cell immunoglobulin and ITIM domain,TIGIT)已被证实在限制肿瘤的适应性免疫和固有免疫方面发挥着关键作用。但单一免疫检查点抑制剂的使用具有获得性耐药以及免疫相关不良事件等局限,而联合应用针对与肿瘤微环境相关的其他免疫检查点抑制剂可成为改善这种治疗局限的主要途径之一。因此,双重免疫检查点抑制剂的协同应用可以有效缓解抗肿瘤免疫治疗耐药性,从而显著提高免疫治疗的疗效,延长患者的生存期。
1 TIGIT
1 型脊髓灰质炎病毒受体的抑制性受体 TIGIT是一种存在于T 细胞和NK 细胞表面的主要免疫检查点分子,其功能分区包含一个免疫球蛋白可变结构域(IgV)、一个跨膜结构域和一个免疫受体酪氨酸抑制基序[1]。研究表明,TIGIT 在多种肿瘤中均有表达,包括急性髓系白血病、黑色素瘤、多发性骨髓瘤和非小细胞肺癌等肿瘤中表达均有上调[2]。活化的T 细胞,包括调节性CD4+T 细胞、效应性CD8+T 细胞、调节性T 细胞(regulatory cells,Tregs )以及NK 细胞等这些细胞表面均表达有共抑制受体TIGIT[3]。TIGIT 拥有多个配体,自身可与其他抑制和刺激性受体竞争或共享相同的配体,其中包括CD155、CD113、CD112[4]。在人类和小鼠中,CD155 均被确定为TIGIT 的物理配体,主要在T 细胞、B 细胞、巨噬细胞和树突状细胞上表达,在神经系统、肾和肠等非造血组织中也呈弱表达状态[4]。此外,作为一种免疫调节分子的CD155 可在自身免疫中发挥双重作用,其不仅在人类恶性肿瘤中多呈现过表达状态,还可与共刺激分子CD226 以及共抑制分子TIGIT、CD96 相互结合发挥效应[5]。一方面,由于TIGIT 与CD155 的亲和力更高,其可同CD226 通过竞争结合作用结合CD155,从而抑制CD226 激活;另一方面,TIGIT 能直接以顺式方式同CD226 结合,直接破坏CD226 的同二聚体,阻碍CD226 与CD155 的结合,进而抑制其信号转导[6]。因此,CD155/CD226 与CD155/TIGIT 或CD155/CD96之间的平衡对维持正常的NK 和T 细胞功能起着重要作用(图1)。
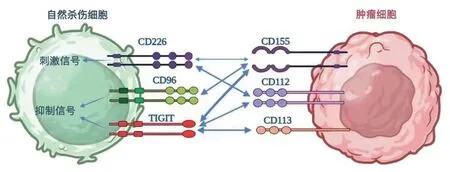
图1 TIGIT 配体及相互作用
2 PD-1/PD-L1
PD-1 属于CD28 超家族,是一种跨膜受体,在维持体内平衡和抑制肿瘤免疫反应方面发挥着重要作用。PD-1 在活化的免疫细胞上表达,主要包括T 细胞、自然杀伤(natural killer,NK)细胞、B 细胞、巨噬细胞、树突状细胞(dendritic cell,DC)和单核细胞,其细胞质结构域分别参与ITIM 和免疫受体酪氨酸转换基序(immunoreceptor tyrosin-based switch motif,ITSM)的形成[7]。PD-L1 和程序性死亡蛋白配体-2(programmed death-ligand 2,PD-L2)是PD-1 的配体,二者在抗原呈递细胞(antigen-presenting cell,APC)和肺癌、肾癌、黑色素瘤、卵巢癌等多种癌症细胞上均有表达[7]。其中PD-L1 主要表达在DC 及巨噬细胞上,在上皮细胞和内皮细胞等非免疫细胞中也可见PD-1/PD-L1 的表达,其在肿瘤和髓系细胞上也可大量表达,诱导T细胞凋亡和免疫抑制从而实现肿瘤逃逸,这是一种潜在的肿瘤治疗靶点[8]。而PD-L2 的表达则较为有限,主要局限于造血细胞,如DC、巨噬细胞、骨髓源性肥大细胞、活化的T 细胞、Th2 细胞和B 细胞[9]。癌细胞上的PD-L1 与T 细胞上的PD-1 相互结合触发负信号,诱导T 细胞凋亡,降低免疫细胞的活性,从而阻断了免疫细胞对肿瘤细胞的攻击,从而使癌细胞逃避免疫监视和破坏。
在大多数情况下,PD-1/PD-L1 轴通过APC 与肿瘤免疫逃逸或肿瘤细胞表面PD-L1 介导的PD-1 产生抑制CD8+T 细胞和阻断PD-1/PD-L1 连接的作用,从而恢复抗肿瘤适应性免疫应答[7]。PD-1 与CD8+T细胞的结合可在包括初始到效应细胞的分化、细胞毒性、增殖和生存等阶段的慢性感染和肿瘤进展过程中发挥抑制性作用[10]。PD-1/PD-L1 的相互作用可防止组织炎症的发生,有助于维持稳态,其中PD-L1 在肿瘤中的免疫逃逸中起重要作用。通常情况下PD-1/PD-L1 复合体形成后,PD-1 胞浆尾部的ITSM 和ITIM 被磷酸化,吸收Src 同源2 结构域的蛋白酪氨酸磷酸酶1/2(Src homology 2 domain-containing protein tyrosine phosphatase 1/2,SHP-1/SHP-2),使得T细胞受体(T cell receptor,TCR)和CD28 近端信号分子(如ZAP70、PKCθ 和其他激酶)被去磷酸化,抑制下游信号通路如PI3K/AKT 和Ras-MEK-ERK 通路的失活[11](图2)。于T 细胞来讲,通过PD-1/PD-L1信号,TCR 和共刺激信号级联被抑制,导致T 细胞增殖减少,并逐渐失去其效应功能。对B 细胞而言,PD-1/PD-L1 可下调B 细胞受体信号,导致ITIM/ITSM中磷酸化的酪氨酸残基招募SHP-1/SHP-2,并最终导致B 细胞功能的丧失[12]。因此,阻断上述通路将有助于恢复T/B 细胞的功能,阻止肿瘤的发生发展。

图2 PD-1/PD-L1 通过多条信号通路抑制T 细胞功能
3 单免疫检查点抑制剂抗肿瘤免疫
3.1 TIGIT 在抗肿瘤治疗中的作用机制
虽然所有共抑制受体都具有抑制T 细胞活化的能力,但其在效力、表达动力学以及它们改变的细胞信号通路方面都有所不同。对于TIGIT 而言,它的作用机制类似于共抑制检查点细胞毒性T 淋巴细胞相关抗原-4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4),CTLA-4 通过与丝氨酸-苏氨酸蛋白磷酸酶2A(protein phosphatase 2A,PP2A)相互作用,通过含有SHP-2 的磷酸酶Src 同源区-2 介导并抑制磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)下游信号,此过程依赖于TCR 的激活[13]。TIGIT 可以直接作用调控TCR 的表达来抑制CD8+T 细胞增殖和活化,因为TIGIT 可以参与诱导TCR 受体和包含TCR 复合物分子的下调。TIGIT 发挥肿瘤免疫治疗的机制主要有以下几点:1)TIGIT 可以减少CD8+T 细胞中TCR 诱导的ERK 信号传导来抑制 T 细胞增殖和功能[14]。2)TIGIT 还可抑制NK 细胞的功能,在与CD155结合后可通过免疫球蛋白尾部酪氨酸(immunoglobulin tail tyrosine,ITT)样基序启动主要抑制信号,而次要抑制信号主要由ITIM 基序介导[15]。其中ITT样基序在Grb2 和β-抑制蛋白招募阻碍磷酸肌醇3 激酶和MAPK 信号传导的肌醇磷酸酶-1(SHIP-1),SHIP-1 可损害TRAF6 和NF-κB 的活化,抑制NK 细胞产生干扰素(IFN-γ)。而ITIM 基序可被Src 家族激酶磷酸化后募集并激活包含SH2 在内的蛋白质,将抑制性受体信号传递给NK 细胞从而削弱其杀伤功能,干扰NK 细胞释放溶解颗粒。此外,具核梭杆菌的Fap2 蛋白可以直接与TIGIT 结合,抑制NK 细胞。3)TIGIT 能够抑制CD155 介导的CD226 激活。CD226 是表达与各个免疫细胞中的共刺激因子,能够与CD155 和LFA-1 结合,参与TCR 信号通路的激活和T 细胞和NK 细胞肿瘤识别。CD226 通过与CD155 结合,触发FOXO1 的磷酸化,FOXO1 是一种负向调节NK 细胞归巢和效应功能的转录因子,磷酸化的FOXO1 从细胞核转运到细胞质,通过泛素化降解,使正常细胞杀伤NK 细胞成为可能[16]。同样,CD226 介导的FOXO1 失活可促进T 细胞存活、归巢、增殖和分化。TIGIT 除了发挥上述直接抑制作用外,还可以通过作用于肿瘤微环境发挥间接抑制作用,其主要作用机制:1)成熟的DC 能激活T 细胞,而未成熟的DC 可能导致T 细胞对免疫治疗无反应和/或耐受。TIGIT 可以通过触发CD155 诱导DC 获得不成熟的耐受性表型,导致IL-10 分泌升高,同时IL-12 产生降低[17]。由于IL-10 可以阻止APC 上调参与抗原呈递的分子,因此IL-10 对抑制免疫反应至关重要,从而直接抑制T 细胞增殖和IFN-γ 等免疫刺激细胞因子的合成。2)TIGIT 还可增强Tregs 的免疫抑制功能,TIGIT 位点甲基化水平降低以及与Foxp3 结合导致Tregs 表达TIGIT 的水平升高,高表达TIGIT 的Tregs 又可以诱导IL-10 和纤维蛋白原样蛋白2(Fgl2)的产生并作用于T 细胞从而发挥抑制性作用。3)除了对DC 和Tregs 的作用外,巨噬细胞中TIGIT/CD155通路的激活也可以通过c-Maf 核易位增加IL-10 的转录并降低IFN-γ,同时帮助巨噬细胞切换到抗炎M2细胞因子谱。4)肿瘤微环境中的髓源系抑制细胞(myeloid-derived suppressor cells,MDSCs)在抑制肿瘤免疫反应中也起着关键作用。这些细胞多表现为CD155 和PD-L1 水平的升高,这意味着它们抑制肿瘤免疫的作用可能通过TIGIT/ CD155 和PD-1/PDL1 通路触发的反向信号被放大(图3)。

图3 TIGIT 在抗肿瘤治疗中的作用机制
3.2 PD-1/PD-L1 在抗肿瘤治疗中的作用机制
PD-L1 与PD-1 的结合可降低免疫细胞的活性,从而便于癌细胞逃避免疫监视和破坏杀伤,因此阻断PD-L1 与PD-1 的结合是PD-1/PD-L1 抑制剂的理论机制,可恢复T 细胞的功能,增强对癌细胞的杀伤[8]。抗PD-1/PD-L1 抗体在肿瘤方面的治疗现已得到大众的认可。T 细胞的活化需要双重信号激活,第1 个信号由主要组织相容性复合体呈递抗原与TCR 的结合激活,第2 个信号由共刺激和共抑制信号共同组成[18]。T 细胞上的PD-1 与肿瘤细胞或抗原呈递细胞(antigen-presenting cells,APCs)上的PD-L1 相结合,可有效抑制T 细胞活化,甚至导致T 细胞凋亡,减少细胞因子的产生从而使肿瘤逃避免疫监视。PD-1/PD-L1 抑制剂通过分别与PD-1 或PD-L1 的结合,阻止PD-1 与PD-L1 间的相互作用,可恢复免疫细胞的识别能力和杀伤作用,避免肿瘤细胞的免疫逃逸。因此,在抗肿瘤免疫中分别应用抗PD-1/ PD-L1 抗体,使之各自拥有对应的配体,从而使T 细胞避免免疫抑制,重新发挥自身的抗肿瘤作用,抑制肿瘤生长。
3.3 单免疫检查点抑制剂抗肿瘤免疫的局限性
TIGIT、淋巴细胞激活基因3(lymphocyte activation gene-3,LAG-3)和T 细胞活化的V 域免疫球蛋白抑制因子(V-domain Ig suppressor of T cell activation,VISTA)等共抑制分子的上调,是许多患者T 细胞功能障碍和抗PD-1/ PD-L1 治疗产生耐药性的重要因素[19]。抑制TIGIT 不仅可以增强CD8+T 细胞的细胞毒性,还可以增强NK 细胞的抗肿瘤免疫,因此阻断TIGIT 是一种很有前景的免疫疗法。癌细胞PDL1 与T 细胞上的PD-1 结合触发负信号,诱导T 细胞凋亡,损害免疫能力,从而使癌细胞逃避免疫监视和破坏[8]。阻断PD-L1 与PD-1 的结合是PD-1/PD-L1 抑制剂的理论机制,可以消除这种负信号,恢复T 细胞的功能,促进癌细胞的杀伤。针对PD-1/PD-L1 通路的抗体现已被用于治疗多种类型的癌症,如黑色素瘤[20]、肺癌[21]等。虽然针对该通路的抗体在少数经历抗癌免疫恢复和长期缓解的患者中取得了成功,但总的来说PD-1/PD-L1 阻断的反应率仍然很低[22]。这主要是由于其缺乏有效的生物标志物、免疫相关毒性以及先天和获得性耐药,使得PD-1/PD-L1 抗体的治疗效果也受到限制[23-24]。
4 阻断TIGIT 与PD-1/PD-L1 双重途径协同增强抗肿瘤作用
单免疫检查点抑制剂抗肿瘤免疫的局限使越来越多的研究转向双重免疫检查点抑制剂协同抗肿瘤的机制研究。目前许多机制的研究均有助于缓解抗PD-1/PD-L1 治疗中的耐药现象,如T 细胞排斥和耗竭、局部免疫功能障碍、新抗原或PD-L1 的丢失及信号缺陷,以及一些非免疫因素包括代谢、表观遗传学和微生物群均可能成为缓解耐药的有效途径[19]。然而,维博利单抗(抗TIGIT 单抗)和替瑞利尤单抗(TIGIT单抗)单药治疗显示客观缓解率(objective response rate,ORR)为0[25],但另有研究表明联合应用替瑞利尤单抗和阿替利珠单抗(PD-L1 单抗)的总体ORR 为37%,PD-L1 TPS >50%亚组的ORR 为66%,超过了单独应用阿替利珠单抗的疗效[26]。基于以上研究发现,应用双检查点抑制可有效地增强抗肿瘤免疫的疗效。TIGIT 通常与PD-1 在多种T 细胞上共表达,有研究证实阻断PD-1 可使CD8+T 细胞上的TIGIT 表达增加1.5 倍[27]。在与TIGIT 共表达的抑制剂受体中,PD-1 是优先共表达的,同时TIGIT 也是PD-1+CD8+T 细胞上最常见的共表达免疫检查点受体。Johnston 等[28]研究发现TIGIT 的表达与CD8+T 细胞的浸润以及PD-1 在这些细胞上的表达有强相关性。Banta 等[29]研究表明CD226 表达对于PD-1/PD-L1 或TIGIT 共阻断的有效性是必要的,当PD-1 和TIGIT 共表达时,磷酸化CD226 的数量远少于二者单独表达时,因此TIGIT 的存在阻碍了单独的PD-1/PD-L1 抑制剂完全激活CD226,只有将TIGIT 与PD-1/PD-L1 共同阻断才能完全激活CD226。因此,双重阻断TIGIT 和PD-1 有可能成为一种新的有效抗肿瘤免疫方式。
这一结果同样在动物模型中也得到了证实,Thibaudin 等[30]研究发现联合阿替利珠单抗(PD-L1单抗)和替瑞利尤单抗(TIGIT 单抗)在结直肠癌中可激活肿瘤浸润淋巴细胞免疫应答的能力,二者联合使用可以激活46%的结直肠癌样本中的T 细胞。Hung等[31]在颅内肿瘤小鼠模型上的研究显示,与对照组和单药组相比抗PD-1 和抗TIGIT 双重治疗可显著提高小鼠的生存率。Zhao 等[32]的研究同样发现淋巴瘤小鼠中PD-1 和TIGIT 的高表达与嵌合抗原受体T 细胞免疫疗法(chimeric antigen receptor T-cell immunotherapy,CAR-T)治疗后晚期白血病复发密切相关。在结直肠癌的研究中发现TIGIT 与PD-1 在小鼠和人的肿瘤抗原特异性CD8+T 细胞和CD8+肿瘤浸润淋巴细胞上共表达[33]。另一项针对非小细胞肺癌患者的研究表明PD-L1/TIGIT 双重阻断剂可作为PD-L1 阳性非小细胞肺癌的一线治疗药物,这与单独应用PD-L1阻断剂相比其临床疗效更为显著[34]。在大肠癌和胶质母细胞瘤小鼠模型中,TIGIT和PD-1/PD-L1 双重阻断剂也被证实可以发挥协同抑制肿瘤生长的作用[35-36]。
双重阻断TIGIT 与PD-1/PD-L1 的临床疗效在近年来的临床试验中也得到了进一步验证。作为首个报告联合抗TIGIT 和抗PD-1/PD-L1 药物有效性和安全性的Ⅱ期随机对照试验,CITYSCAPE 将135 例非小细胞肺癌患者随机分配接受替瑞利尤单抗或安慰剂加阿替利珠单抗治疗。结果显示,替瑞利尤单抗联合阿替利珠组在总人群中的无进展生存期(progression-free survival,PFS)显著延长(HR=0.62,95%CI:0.42~0.91)[26]。ARC-7 Ⅱ期试验结果也同样表明,就ORR和PFS 而言,联合用药优于单独使用赛帕利单抗。其中45 例接受domvanalimab,赛帕利单抗和etrumadenant 3 种药物联合组治疗的患者中位PFS 为10.9 个月,ORR 为40%。44 例接受domvanalimab 和赛帕利单抗两种药物联合组治疗的患者中位PFS 为12.0 个月,44 例接受单一赛帕利单抗治疗的患者的ORR 仅为27%[37]。因此,PD-1/PD-L1 和TIGIT 双重阻断与单独使用单检查点抑制剂相比,其在增强抗肿瘤免疫的疗效、提高生存率、减少复发等方面均具有显著的抗肿瘤疗效,可作为一种有效的临床抗肿瘤作用靶点。
5 结语
本文就免疫检查点PD-1/ PD-L1、TIGIT 在抗肿瘤免疫治疗中作用机制进行总结,虽然目前检查点抑制剂在抗肿瘤治疗中有着较为明显的治疗疗效,但单一免疫检查点抑制剂存在缺乏有效的生物标志物、免疫相关毒性以及先天和获得性耐药等局限性,导致相应的单克隆抗体治疗效果也受到了一定的限制。而国内外多项实验研究均证实,双重阻断免疫检查点抑制剂的应用可以有效增强抗肿瘤免疫的疗效、减少耐药、提高生存率、减少复发,而这其中最有代表性的就是双重阻断TIGIT 和PD-1/PD-L1。因此双重阻断TIGIT 和PD-1 有可能作为一种更为有效的新型抗癌治疗方法。尽管双重阻断免疫检查点抑制剂在临床应用中显示出了较好的临床效果,但双重阻断的具体作用机制还尚未明确,这可能与PD-1 和TIGIT 通过不同的机制共同调节CD226 有关,其他的具体作用机制还有待于进一步的探索与发现。
本文无影响其科学性与可信度的经济利益冲突。
