磷酸化EZH2 在头颈部鳞癌中的表达特征及对化疗敏感性的影响*
2024-01-04星博凡王宇刘超周倩倩张睿哲徐芳泉任玉周旋
星博凡 王宇 刘超 周倩倩 张睿哲 徐芳泉 任玉 周旋
头颈部肿瘤是全球第六大常见的恶性肿瘤,发生于口腔、鼻咽、口咽、下咽部、喉以及鼻组织。其中,头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)是头颈部恶性肿瘤最常见的病理类型。HNSCC 是一种侵袭性强、预后差的疾病[1],60%以上的HNSCC 患者在确诊时已经处于局部晚期或转移阶段。近年尽管在治疗方式上取得了显著的进步,但HNSCC 患者的5 年生存率仍低于50%[2]。因此亟需开发HNSCC 肿瘤治疗的新靶点。
Zeste 同源增强子(enhancer of Zeste homolog 2,EZH2)是多梳抑制复合体2(polycomb repressive complex 2,PRC2)的催化亚基,在细胞核内催化组蛋白甲基化,从而介导靶基因的转录抑制[3]。翻译后修饰是蛋白质功能的重要调控机制,在肿瘤的发生和发展中具有重要作用。研究表明,EZH2 可以发生多种翻译后修饰,包括磷酸化、泛素化、甲基化、糖基化等[4],改变EZH2 的酶活性、蛋白稳定性和亚细胞定位进而影响EZH2 的功能[5-7]。其中,第21 位点丝氨酸(S21)的磷酸化是EZH2 重要的翻译后修饰。目前,已发现p-EZH2S21在多种肿瘤(如前列腺癌、胶质母细胞瘤和肺癌[8-10]等)的肿瘤生长、干性和耐药等方面发挥作用。然而,在HNSCC 中p-EZH2S21的功能尚不明确。因此,本研究旨在探索HNSCC 中磷酸化EZH2 的表达特征及其对化疗敏感性的影响。
1 材料与方法
1.1 临床资料
1.1.1 临床组织标本及病例资料 选取2018 年1 月至2021 年3 月天津医科大学肿瘤医院HNSCC 患者组织标本及临床资料53 例。整理患者临床信息,包括患者年龄、性别、吸烟饮酒史、肿物大小、T 分期、N 分期、AJCC 分期、组织学分级及淋巴结转移情况。所有标本的采集均经过被研究对象或其家属知情同意,并通过本院伦理委员会批准(批号:Ek2020212)。
1.1.2 细胞系与培养条件 人舌鳞癌细胞系SCC15、SCC25 及UM1,人咽鳞癌细胞系Fadu,人咽头癌胸水转移细胞Detroit 562 均购自美国典型生物资源保藏中心。SCC15、SCC25 及UM1 细胞系使用DMEM/F12培养基;Fadu 及Detroit 562 使用DMEM 培养基,添加10%胎牛血清和1%青霉素-链霉素双抗,在37℃,5%CO2恒温培养箱中培养。
1.1.3 试剂和仪器 DMEM/F12、DMEM 培养基、胎牛血清和青霉素-链霉素双抗均购自美国Gibco 公司。空白对照载体(Vector)、EZH2 野生型(EZH2-WT)和EZH2 S21 位点突变型(EZH2-S21A,即EZH2第21 位氨基酸丝氨酸突变为丙氨酸)慢病毒购自天津舍为斯生物技术有限公司。免疫组织化学试剂盒购自北京中杉金桥公司。多克隆兔抗人p-EZH2S21抗体购自江苏亲科生物研究中心有限公司;单克隆兔抗人EZH2 抗体和单克隆鼠抗人Ki-67 抗体购自美国Cell Signaling Technology 公司;单克隆鼠抗人GAPDH 抗体购自武汉三鹰生物技术有限公司;多克隆兔抗人HIF-1α 抗体购自美国Gene Tex 公司;单克隆兔抗人p-STAT3Y705抗体购自英国Abcam 公司。BCA 蛋白浓度测定试剂盒购自美国Thermo Fisher Scientific 公司。顺铂(cisplatin,DDP)和5-氟尿嘧啶(5-fluorouracil,5-FU)购自美国Selleck 公司。CCK8 试剂购自北京Biosharp 公司。
1.2 方法
1.2.1 稳转细胞系的构建转染与筛选 常规消化细胞,计数,吸取5×104细胞接种于6 孔板,贴壁后使用,转染Vector、EZH2-WT 与EZH2-S21A 慢病毒,72 h后采用嘌呤霉素筛选。
1.2.2 Western blot 实验 取处于对数生长期的细胞,使用IP 裂解液提取细胞总蛋白。采用BCA 法测定蛋白吸光度。加入SDS-PAGE 上样缓冲液,100℃金属浴使蛋白变性。10% SDS-PAGE 电泳后转膜至已预先活化的PVDF 膜。用5% 脱脂牛奶或牛血清白蛋白封闭1 h。TBST 溶液清洗3 遍后,一抗4℃孵育过夜。使用带有辣根过氧化物酶的二抗室温孵育1 h。使用ECL 发光液曝光图像。
1.2.3 免疫组织化学实验 HNSCC 石蜡组织切片在65℃烘箱烤片3 h,经脱蜡,水化,抗原修复,阻断内源性过氧化物酶,封闭后加入一抗4℃孵育过夜。复温后加入二抗,DAB 显色,核复染,脱水,封片后在显微镜下观察并采集图像。染色强度分为:无着色、浅黄、深黄、深棕,分别计为0~3 分;染色范围分为0~25%、25%~50%、50%~75%、75%~100%,分别计为1~4 分。染色强度与范围的乘积为总分。总分≥6 分为高表达,<6 分为低表达,Ki-67 表达测定方法:每张免疫组织化学切片任意选取5 个高倍镜视野(×400),统计每个视野阳性细胞数目,计算5 个视野阳性细胞数目平均值。Ki-67 阳性表达百分率=阳性表达细胞数/视野内总细胞数。以Ki-67 阳性表达百分率<20%为低表达,≥20%为高表达。
1.2.4 CCK8 实验 将对数生长期的细胞进行常规消化、计数,按2×103/孔接种细胞于96 孔板。于37℃5%CO2恒温培养箱中培养24 h。将DDP 和5-FU 浓度倍比稀释后加入96 孔板中,每孔加入200 μL 溶液。每个药物浓度设置3 个复孔,于37℃ 5%CO2恒温培养箱中培养48 h。加入CCK8 溶液1 h 后测定450 nm吸光度值。采用GraphPad Prism v9.0 计算IC50 值。
1.2.5 平板克隆实验 将对数生长期的细胞进行常规消化,计数,以1×103/孔接种于6 孔板,置于37℃5% CO2恒温细胞培养箱。培养至肉眼可见克隆后PBS 清洗,多聚甲醛固定,结晶紫染色,拍照计数。
1.3 统计学分析
采用GraphPad Prism v9.0 软件对数据进行统计学分析。计量资料以()表示,组间差异比较采用t检验。计数资料采用χ²检验或Fisher 精确检验,以P<0.05 为差异具有统计学意义。
2 结果
2.1 p-EZH2S21 表达与HNSCC 进展相关
本研究对53 例临床HNSCC 组织标本进行免疫组织化学染色。结果显示,与正常鳞状上皮组织相比,p-EZH2S21在肿瘤组织的表达水平升高(图1A)。与无淋巴结转移的肿瘤组织相比,p-EZH2S21在有淋巴结转移的肿瘤组织的表达水平升高(图1B)。与原发灶肿瘤组织相比,p-EZH2S21在淋巴结转移病灶的表达水平升高(图1C)。Western blot 实验显示,肿瘤组织中p-EZH2S21高于正常鳞状上皮组织(图1D)。根据免疫组织化学染色,将p-EZH2S21分为高表达组与低表达组,进行临床特征相关分析。结果显示,p-EZH2S21表达与淋巴结转移、T 分期、N 分期、AJCC 分期及Ki-67呈正相关(均P<0.05),与患者年龄、性别等因素无显著相关性(P>0.05,表1)。上述结果表明p-EZH2S21在HNSCC 发生发展中的重要地位。

表1 p-EZH2S21 表达与HNSCC 临床病理特征的相关性分析 例(%)
2.2 HNSCC 肿瘤组织中p-EZH2S21 与p-STAT3Y705、HIF-1α 表达水平
采用免疫组织化学染色分析HNSCC 肿瘤组织标本中p-STAT3Y705和HIF-1α 表达情况,进一步分析p-EZH2S21和p-STAT3Y705、HIF-1α 表达相关性。结果显示,在HNSCC 肿瘤组织中p-EZH2S21表达水平和p-STAT3Y705(P<0.05)、HIF-1α(P<0.01)表达水平均呈正相关(表2),进一步证实p-EZH2S21在HNSCC 中的重要地位。
2.3 EZH2 通过S21 位点磷酸化对HNSCC 细胞的增殖能力
通过体外实验进一步验证p-EZH2S21在HNSCC发生发展中的作用。使用Western blot 实验检测多个HNSCC 细胞系中p-EZH2S21的表达情况(图2A),其中p-EZH2S21在SCC15 细胞中表达最低,因此,选用SCC15 细胞系构建EZH2 野生型(EZH2-WT)和EZH2 S21 位点突变(EZH2-S21A)稳转细胞系。与空载对照组相比,EZH2-WT SCC15 细胞中EZH2 及p-EZH2S21蛋白水平升高。与EZH2-WT SCC15 细胞相比,EZH2-S21A SCC15 细胞中EZH2 蛋白水平不变,p-EZH2S21蛋白水平降低(图2B)。然后,使用CCK8 实验和平板克隆实验观察EZH2 及EZH2 S21对肿瘤细胞增殖能力的影响。与空载对照组(237±3)相比,过表达EZH2 后细胞活力增强,平板克隆数增多(404.7±9.866),增殖能力增强(t=28.16,P<0.000 1)。与EZH2-WT SCC15 细胞相比,S21 位点突变后,细胞活力减弱,平板克隆数减少(268±10),增殖能力降低(t=16.85,P<0.000 1)。以上结果表明,EZH2 通过S21 影响HNSCC 的增殖能力(图2C,2D)。
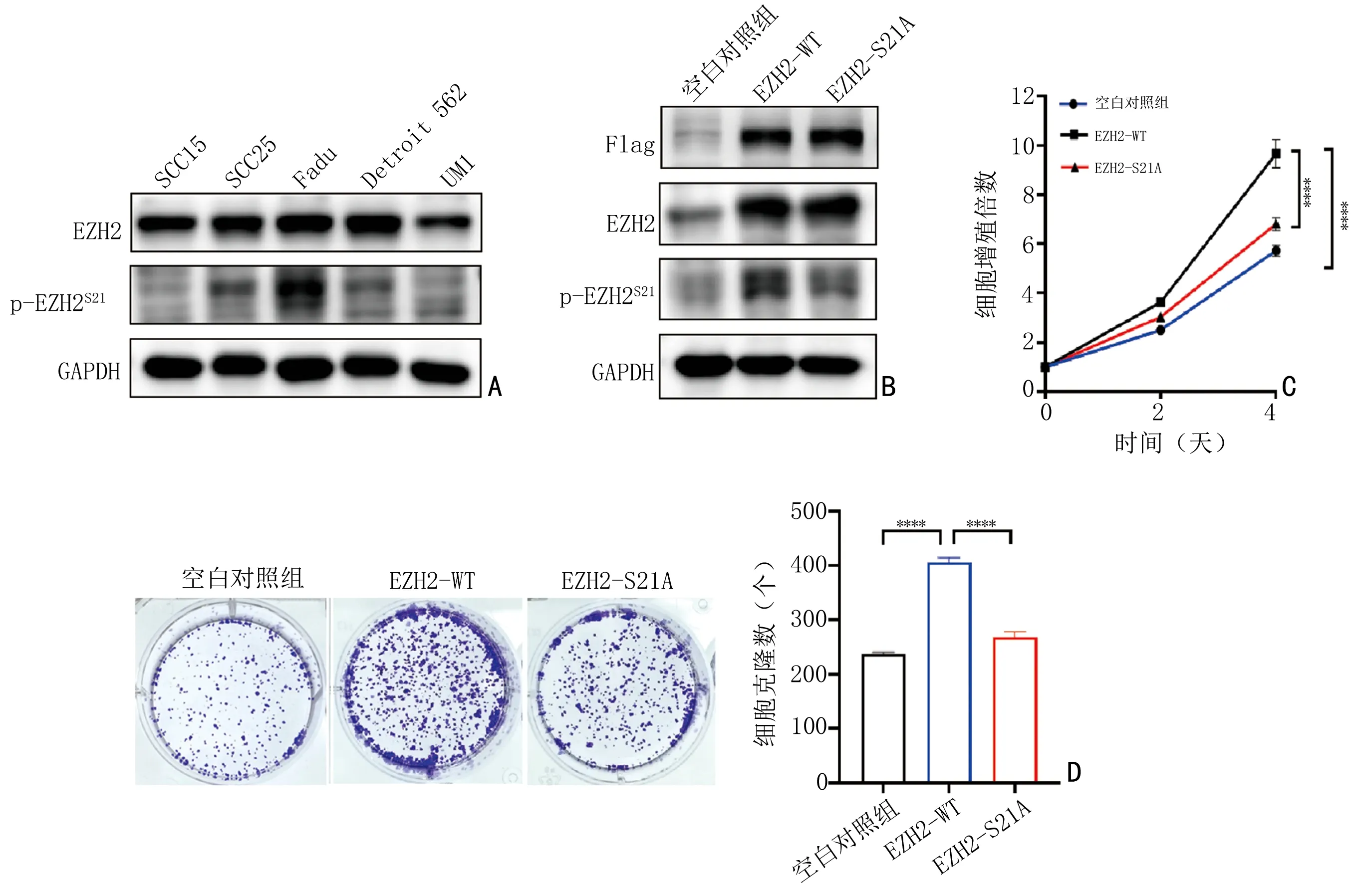
图2 EZH2 通过S21 位点磷酸化促进HNSCC 细胞的增殖能力
2.4 EZH2 通过S21 位点磷酸化影响HNSCC 细胞及对DDP 和5-FU 的关系
细胞增殖与肿瘤治疗敏感性密切相关,因此本研究进一步探讨EZH2 S21 在HNSCC 化学治疗中的作用,观察EZH2 及EZH2 S21 对化疗敏感性的影响。用DDP 或5-FU 处理空白对照、EZH2-WT 及EZH2-S21A SCC15 细胞,进行CCK8 实验和平板克隆实验。结果显示,加入DDP(图3A,3B)或5-FU(图3C,3D)后,与空白对照(DDP:123.7±7.371,5-FU:168.7±3.055;IC50DDP:2.819 μM,IC505-FU:2.687 μM )相比,过表达EZH2 后(DDP:342.7±7.024,5-FU:303.7±6.658;IC50DDP:4.537 μM,IC505-FU:3.754 μM)细胞对DDP或5-FU 的敏感性降低,其对细胞增殖的抑制能力减弱(tDDP=37.26,P<0.000 1;t5-FU=31.92,P<0.000 1)。而S21 位点突变后(DDP:197±4.583,5-FU:188.3±4.726;IC50DDP:3.728 μM,IC505-FU:2.895 μM),细胞恢复对DDP 或5-FU 的敏感性,其对细胞增殖抑制能力增强(tDDP=30.08,P<0.000 1;t5-FU=24.47,P<0.000 1)。上述结果说明EZH2 通过S21 位点磷酸化影响肿瘤细胞对化疗的敏感性。

图3 EZH2 通过S21 位点磷酸化影响HNSCC 细胞对DDP 和5-FU 治疗敏感性
3 讨论
肿瘤的乏氧微环境会激活肿瘤细胞一系列分子信号途径,如HIF-1α 和STAT3[11]。本研究发现p-EZH2S21在HNSCC 患者肿瘤细胞中的表达水平与p-STAT3Y705和HIF-1α 的表达水平呈正相关,因为在肿瘤组织中p-EZH2S21与HIF-1α、p-STAT3Y705均呈高表达。此外,在HNSCC 中p-EZH2S21表达与淋巴结转移、T 分期、N 分期和AJCC 分期呈正相关。体外实验证明EZH2 通过S21 位点磷酸化影响肿瘤细胞对化疗的敏感性。EZH2 在HNSCC 中表达明显升高,并与其恶性生物学行为密切相关。本课题组前期研究发现,HNSCC 肿瘤组织中EZH2 表达高于正常鳞状上皮。抑制EZH2 表达通过影响线粒体内钙离子浓度调控线粒体膜电位反转,影响肿瘤细胞的衰老和凋亡过程[12]。
p-EZH2S21是EZH2 重要的磷酸化形式,在HNSCC、胶质母细胞瘤等多种恶性肿瘤中表达明显增高[8,13]。p-EZH2S21异常激活与多种恶性肿瘤的侵袭转移、化疗耐药及干性密切相关[8,10]。S21 的磷酸化修饰对EZH2 发挥非组蛋白赖氨酸甲基化功能至关重要,p-EZH2S21能促进STAT3 的甲基化并使其转化为激活状态[8]。此外,EZH2 通过调节雄激素受体及相关蛋白的甲基化从而发挥转录激活的作用。其中,S21 位点的磷酸化是EZH2 发挥甲基转移酶所必需的[10]。
目前,EZH2 已成为肿瘤治疗的重要靶点。然而,随着大量肿瘤治疗的研究进展,EZH2 抑制剂表现出一定的耐药性及不良反应。翻译后修饰通过调节蛋白质的结构、空间定位和相互作用从而控制其功能。研究表明,协同靶向EZH2 与其上游PI3K 或AKT 克服了PI3K 或KRAS 特异性突变肿瘤患者对PI3K/AKT靶向治疗的抵抗问题[9,14]。本研究为探讨以p-EZH2S21为核心的翻译后修饰调控网络提供了新思路。然而,临床治疗中尚未研发出针对p-EZH2S21的治疗策略。本研究揭示了EZH2 在HNSCC 发生发展中的机制,即通过S21 位点磷酸化增加化疗敏感性。因此,深入研究p-EZH2S21的功能,开发针对p-EZH2S21的药物或单克隆抗体将为治疗HNSCC 开辟新途径。
本文无影响其科学性与可信度的经济利益冲突。
