胸膜肺炎放线杆菌感染猪肺巨噬细胞相关细胞因子表达水平初探
2024-01-04刘红洋邴新帅王秋东巩俊明朱奕霏王羽辉田喜荣姜艳雪
刘红洋,邵 清,邴新帅,王秋东,巩俊明,朱奕霏,王羽辉,田喜荣,金 哲,姜艳雪
(1. 双辽市动物疫病预防控制中心,吉林双辽 136400;2. 双辽市畜禽屠宰工作服务中心,吉林双辽 136400;3. 双辽市畜牧工作总站,吉林双辽 136400;4. 吉林省动物疫病预防控制中心,吉林长春 130000;5. 双辽市动物检疫站,吉林双辽 136400)
胸 膜 肺 炎 放 线 杆 菌(Actinobacillus pleuropneumoniae,APP)是一种革兰氏阴性短杆菌,可引起呼吸系统传染性疾病,如猪接触性传染性胸膜肺炎,其主要临床特征是出血性纤维素性坏死性肺损伤。APP 具有宿主专一性,猪群中不同年龄以及性别的个体都可被感染,通常多发于12 周龄猪只[1]。目前APP 在全球流行蔓延,严重影响着畜牧业及经济发展。随着养殖业规模化、集约化发展,APP 感染呈暴发性发生,且其往往和其他细菌类呼吸系统病原混合感染,从而大大加剧了危害性[2-3]。APP 可专一性损害猪肺脏组织,肺组织嗜性明显是其重要特点之一。因此,针对APP 与宿主细胞之间相互作用机制的研究显得至关重要,可为今后构建肺损伤模型提供理论基础[4]。
细胞因子(cytokine)是由免疫细胞以及某些非免疫细胞经刺激而合成、分泌的具有广泛生物活性的一类小分子蛋白质,在免疫细胞分化发育、免疫调节、炎症反应、刺激造血中均起到了重要作用[5-6]。炎症反应是机体的一种自我保护机制,当外界病原入侵时,机体发生炎症反应。在此过程中机体产生一系列细胞因子,它们可以诱导机体增强抗病机能,以最快速度清除致炎因子,修复机体受损组织,重新调平机体的内外环境[7-8]。IL-1β 作为促炎症细胞因子,作用十分重要,可以刺激B 淋巴细胞增殖、T 淋巴细胞活化以及免疫球蛋白生成;IL-6 作为一种多效性细胞因子,具有多种生物学活性,可刺激B 淋巴细胞、T淋巴细胞以及胸腺细胞分化,激活巨噬细胞和自然杀伤细胞等,在免疫反应及炎症反应中具有举足轻重的作用。另外,近些年来IL-8 也成为人们关注的焦点。IL-8能够吸引和激活中性粒细胞,又被命名为中性粒细胞激活因子。IL-8 与中性粒细胞接触后会释放一系列活性物质,导致炎症反应发生。本研究通过体外培养猪肺巨噬细胞,以APP 刺激该细胞,在不同时间点提取细胞总RNA,再利用本课题组建立的IL-1β、IL-6、IL-8基因及凋亡相关蛋白caspase-3编码基因(caspase-3)荧光定量PCR 方法,对上述炎症因子进行跟踪观察,发现猪肺巨噬细胞被APP 刺激后可以产生炎症因子,并呈时间依赖性。本研究为进一步探究APP 所引起的猪传染性胸膜肺炎发病机制奠定了基础。
1 材料与方法
1.1 主要试剂
APP 血清5b 型L20 菌株, 购自ATCC 公司;RPMI 1640 培养基,购自Sigma 公司;SYBR Green 荧光定量PCR 试剂盒,购自Roche 公司;MLV 逆转录酶、Trizol 试剂、TaqDNA 聚合酶,均购自Takara 公司;脑心浸液(BHI)、马血清、酵母提取物、NAD 辅酶Ⅰ、葡萄糖以及氯化钠等,均购自北京鼎国生物试剂公司。
1.2 猪肺巨噬细胞分离培养
选择28 日龄健康仔猪,经血清学检测确认猪瘟病毒、猪圆环病病毒、猪口蹄疫病毒、猪伪狂犬病病毒以及猪繁殖与呼吸综合征病毒抗体均为阴性。将仔猪经臂动脉放血致死,对胸腹部进行体表消毒,用手术刀剖开胸腔后小心分离出肺脏,将气管结扎并剪断,然后取出完整肺脏,以无菌生理盐水反复漂洗肺脏表面3~4 次,清除残留血块[9];打开气管结扎处,用漏斗将100~150 mL 无菌冷PBS缓冲液从气管注入肺脏,轻拍肺脏表面并用无菌烧杯回收灌洗液,重复灌洗肺脏2~3 次,将多次回收的灌洗液用低温冷冻离心机1 000 r/min 离心10 min,对收集的沉淀以PBS 缓冲液重悬,洗涤细胞2 次。将细胞以10% RPMI 1640 培养基重悬后,置于5% CO2培养箱中37 ℃培养2 h,确保猪肺巨噬细胞贴壁生长;弃去上清液,以预热后的PBS缓冲液洗涤1 次,继续加入10% RPMI 1640 培养基进行培养。
1.3 引物合成
根 据GenBank 中 猪IL-1β、IL-6、IL-8及caspase-3基因及管家基因β-actin核苷酸序列,设计特异性扩增引物(表1),并将引物序列交付上海生工生物工程有限公司合成。

表1 SYBR Green 荧光定量PCR 引物信息
1.4 APP 培养及计数
从-80 ℃冰箱中取出保存的APP L20 菌株10 µL,将其接种到BHI 液体培养基中,然后放入恒温摇床200 r/min 37 ℃培养6~8 h;用接种环蘸取菌液,在BHI 固体培养基表面划线后放入恒温培养箱37 ℃培养12 h;挑取单个菌落至液体BHI培养基中,放入恒温摇床200 r/min 37 ℃继续培养6~8 h 活化菌种;用分光光度计测定菌液OD 值,经倍比稀释后进行菌落计数。
1.5 APP 感染猪肺巨噬细胞
将1.2 中分离培养的猪肺巨噬细胞以5×105个/孔的量接种至24 孔细胞培养板,待细胞完全贴壁后,立即以预热的PBS 缓冲液洗涤细胞1 次;加入无抗10% RPMI 1640 培养基,再加入APP L20 菌株(MOI = 10),37 ℃孵育1 h;加入终质量浓度为50 µg/mL 的庆大霉素,37 ℃作用1 h,然后加入无抗10% RPMI 1640 培养基继续培养;分别在感染后3、6、9、12 和24 h 收取细胞,每孔加入500 µL Trizol,于-80 ℃冰箱保存备用。
1.6 感染细胞总RNA 提取
从-80 ℃冰箱中取出经APP 感染后不同时间点收取的细胞,按照说明书逐步提取细胞总RNA,并用紫外分光光度计测定RNA 含量。
1.7 RT-PCR 扩增
1.7.1 cDNA 合成 在反应体系中加入RNA 5 µL、5×M-MLLV 反转录Buffer 4 µL、dNTP 2 µL、M-MLV 1 µL、Oligo dT 1 µL,最后用DEPC 水补足至20 µL。反应程序:37 ℃温浴1 h,然后95 ℃金属浴5 min 灭活反转录酶,保存于-20 ℃冰箱备用。
1.7.2 普通PCR 检测 以制备的cDNA 为模板,对IL-1β、IL-6、IL-8、caspase-3及β-actin基因进行PCR 扩增,扩增产物经琼脂糖凝胶电泳鉴定,判断能否扩增出清晰的目的条带。
1.8 SYBR Green 荧光定量PCR 检测
经普通RT-PCR 鉴定可扩增出清晰的目的条带后,再进行荧光定量PCR 检测。20.0 µL 扩增体系:cDNA 1.0 µL,SYBR Green PCR Master Mix 10.0 µL,引物F/R(浓度均为400 nmol/L)各0.4 µL,ddH2O 8.2 µL。反应程序:95 ℃预变性3 min;95 ℃ 15 s,60 ℃ l min,40 个循环。每组分别重复检测3 次,同时设置阴性对照(不加cDNA),在荧光定量PCR 仪上进行反应。
1.9 统计分析
检测结果以平均数±标准差表示,采用SPSS 20.0 软件进行统计学分析,用t检验对两组数据进行比较分析,P<0.05,为差异有统计学意义。
2 结果
2.1 RT-PCR 扩增
以APP 感染后3 h 的细胞cDNA 为模板,用特异性引物进行普通PCR 扩增。结果(图1)显示:扩增产物片段大小与目的基因一致,且没有形成杂带和引物二聚体等,符合实时荧光定量PCR 扩增条件。因此,可使用该引物对APP 感染后不同时间点的猪肺巨噬细胞cDNA 进行定量分析。

图1 IL-1β、IL-6、IL-8、β-actin、caspase-3 基因PCR 扩增结果
2.2 扩增曲线及熔解曲线分析
APP 感染后不同时间点猪肺巨噬细胞cDNA的荧光定量PCR 扩增结果(图2)显示,IL-1β、IL-6、IL-8及caspase-3基因扩增曲线平滑,平台期较为平坦,且Ct 值均处于可用范围之内(20~35);对于4 种扩增基因,均得到了理想的单一峰型熔解曲线,位置均与预期相符。由此可见,目的基因扩增的特异性较好。
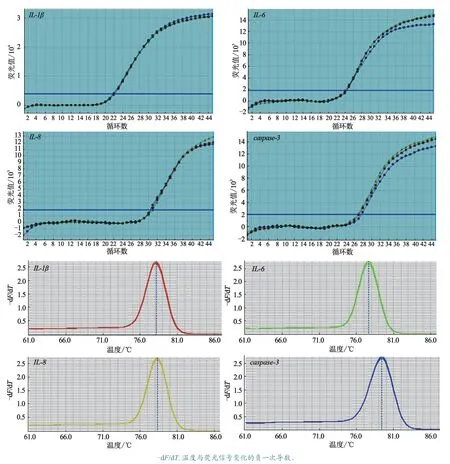
图2 IL-1β、IL-6、IL-8 及caspase-3 扩增曲线和熔解曲线
2.3 荧光定量PCR 结果分析
猪肺巨噬细胞经APP 感染后不同时间点的IL-1β、IL-6、IL-8、caspase-3基因表达水平变化情况如图3 所示。IL-1β产生于炎症反应发生的初期,在APP 感染后9 h 表达量显著上升(P<0.01),12 h 时达到高峰,随后表达量开始下降;IL-6、caspase-3表达量显著上升期晚于IL-1β,均在感染后12 h 显著上升(P<0.001),分别在感染后12、24 h 达到高峰;IL-8表达量在感染后9 h 呈现显著上升(P<0.05),12 h 时达到高峰。结果表明,APP 可以引起猪肺巨噬细胞凋亡,并且凋亡发生在感染后9~12 h。巨噬细胞的凋亡为APP 在宿主体内增殖感染创造了条件。

图3 IL-1β、IL-6、IL-8、Caspase-3 基因在APP 感染后不同时间点表达量变化情况
3 讨论
APP 在我国已经成为严重阻碍畜牧业及经济发展的病原菌之一。为从源头上遏制APP 的流行蔓延,必须针对其免疫机制以及致病机理进行深入研究[10]。作为早期炎症细胞因子,IL-1β、IL-6、IL-8在介导炎症反应过程中都具有至关重要的作用。在炎症反应发生时,检测这些炎症细胞因子表达量的变化可为后续构建肺损伤模型提供理论依据,并且对动物疫病诊疗有重大意义[11]。本研究旨在探索经APP 感染后的猪肺巨噬细胞胞内炎症因子表达水平变化情况,以期为后续研究提供理论依据。SYBR Green 染料法对细胞因子表达水平检测的结果显示,在APP 感染早期,猪肺巨噬细胞呈现出强烈的炎症反应,炎症细胞因子表达水平随时间变化呈上升趋势。猪肺巨噬细胞在体外经APP感染后会出现一系列敏感反应,可以充分利用这一现象构建细胞模型。此外,细胞因子mRNA 水平的上升在一定程度上可以反映细胞因子表达水平,但不能代表活性细胞因子水平。因此,本课题组将针对这一问题开展胞外细胞因子表达水平定量分析,进而对APP 的致病机制进行深入探索。
当肺炎发生时,肺支气管上皮细胞和肺泡细胞能够分泌细胞因子IL-1β 和TNF-α,两者结合后可在炎症反应发生时起到级联放大作用。其中,IL-1β 主要由单核巨噬细胞产生,能够参与机体造血、内分泌调节以及炎症反应等。当炎症发生时,炎性细胞大量合成IL-1β,其定向游走至炎症反应部位,进而加重炎症反应[12-13]。IL-1β 是主要的促炎细胞因子,主要功能是刺激T 淋巴细胞活化、B淋巴细胞增殖以及免疫球蛋白生成[14]。本研究发现,在APP 感染猪肺巨噬细胞12 h 后,3 种细胞因子编码基因中IL-1β表达量最高,与未感染细胞相比,其表达量上升近50 倍。由此可以推断,猪肺脏经APP 感染后所分泌的IL-1β 在促进炎症反应进一步加重过程中发挥作用。
同样作为一种细胞因子,IL-6 在体液免疫过程中发挥着举足轻重的作用。IL-6 参与免疫效应细胞分化,能够刺激B 淋巴细胞分化成浆细胞,在免疫效应发生时再由浆细胞分泌免疫球蛋白,进而参与机体体液免疫[15]。相关研究[16]表明,在感染猪繁殖与呼吸综合症病毒的第1~3 周内,猪血清中IL-6 浓度显著增高,猪外周血单核细胞和猪肺泡巨噬细胞中IL-6mRNA 以及蛋白表达水平均明显升高。本试验对经APP 感染的猪肺巨噬细胞中IL-6基因表达水平进行检测,发现在感染初期IL-6表达量升高,表明其在机体免疫反应过程中起着重要作用。
相关研究[17]发现,人的阻塞性肺炎多以气管、肺实质以及肺血管的慢性炎症为典型特征,肺部发生感染时被激活的炎性细胞释放多种介质,主要包括白三烯B4(LTB4)、IL-8 以及TNF-α 等,这些介质在破坏肺结构的同时可促进中性粒细胞产生炎症反应。本研究发现,感染APP 早期猪肺巨噬细胞中IL-8基因表达水平显著上升约13 倍,这为后期进一步探究APP 导致的猪出血性纤维素性坏死性肺损伤典型症状的机理提供了理论依据。
相关研究[18-19]表明,在细胞凋亡过程中活化的caspase-8 可直接激活下游效应caspase(包括caspase-3、caspase-6 以及caspase-7),同时使信号向下游传递,最终导致细胞凋亡。本研究结果显示,APP 感染后猪肺巨噬细胞中caspase-3基因表达水平缓慢上升,在感染后24 h 表达量达到最高,这提示APP感染后胞内凋亡相关信号通路被激活,促使caspase-3 活化进而导致在感染末期细胞出现凋亡现象。caspase-3 活化常被作为细胞凋亡的一个重要指标,但caspase-3 表达量的高低仅能从侧面反映细胞凋亡程度。由于本研究处于初探阶段,试验存在局限性,没有对caspase-3 的切割进行定量检测,后续将对caspase 家族蛋白凋亡级联反应进行深入研究。综上,本研究对APP 感染后猪肺巨噬细胞中3 种炎性细胞因子及caspase-3的基因表达水平进行了检测分析,为进一步探究猪纤维素性胸膜肺炎的发病机理奠定了基础,更为后续构建肺损伤模型提供了理论依据,对动物疫病诊疗具有重要意义。
