Collagen V在推拿促进长期大负荷运动大鼠肌肉干细胞自我更新中的作用研究*
2024-01-03张瑞驰靳松林李伦宇阿衣留布丁海丽
张瑞驰,靳松林,李伦宇,阿衣留布,丁海丽
(成都体育学院,四川 成都 610041)
超负荷原则是现代运动训练体系的主要原则,人体不断适应增加的运动负荷,从而使身体机能和运动能力得到提升[1]。在此过程中,若运动负荷长时间过度超出机体承受能力,可能会导致骨骼肌损伤发生,损伤又需要足够的时间修复[2],但实际情况下训练与损伤修复的时间平衡点往往难以把控。若损伤未愈仍持续大负荷运动,可导致机体组织损伤进一步累积并迁延[3],影响运动表现。竞技体育中,推拿常被应用于运动员训练及赛后的肌肉疲劳恢复和损伤治疗,效果显著。目前,现有研究在免疫调节[4]、蛋白合成/分解代谢[5-6]和细胞外基质[7]等方面进行了探究,证实推拿以力学形式作用于损伤或疼痛部位软组织,从而达到缓解症状和促进组织修复的效果[8]。但其具体作用分子机制仍不清晰,有待进一步探讨。
肌卫星细胞(Muscle Satellite Cells, MSC)具有干细胞特性,即肌肉干细胞,是成体骨骼肌再生修复的主要细胞类型,通常处于静息状态[9]。当骨骼肌遭受损伤性刺激时,MSC 被激活并大量增殖,以满足机体干细胞需求,这一过程中,部分激活和增殖的MSC 会重新退回静息状态以维持骨骼肌再生潜能,影响损伤修复[10]。V 型胶原蛋白(Collagen V,COLV)由MSC 分泌并通过作用于MSC 表面降钙素受体介导MSC 静息状态的维持,是MSC 静息生态位关键组成成分[11-12]。
课题组前期研究发现[13],推拿可上调一次性大负荷运动骨骼肌损伤的Collagen V表达,促进损伤修复。然而,推拿对长期大负荷运动骨骼肌损伤的干预效果及机制仍不明晰。本实验旨在观察长期大负荷运动后推拿对Collagen V表达及损伤修复的影响,探讨推拿能否介导Collagen V表达促进MSC 自我更新。
1 材料与方法
1.1 实验动物及分组8 周龄健康SPF 级雄性SD 大鼠共32 只,初始体重185±6g,由成都达硕实验动物有限公司提供,许可证号:SYXK(川)2020-030。实验动物在成都体育学院标准动物房内分笼饲养,整个实验过程中保持自由饮食、饮水,室温20℃~24℃,相对湿度30%~60%,12h 光照/黑暗模拟昼夜交替环境。适应性喂养3 天后,所有大鼠按随机数字表法分为空白对照组(C 组,n=8)、长期大负荷运动组(E 组,n=8)、长期大负荷运动+推拿组(ET 组,n=8)、长期大负荷运动+假推拿组(ES组,n=8)。本实验过程中对动物所有处理均遵循动物伦理学标准,并得到成都体育学院动物伦理委员会批准。
1.2 试剂与器材免疫染色封闭液、DAB辣根过氧化物酶显色试剂盒、ECL试剂盒:碧云天。反转录试剂盒(PrimeScript RT reagent Kit)、荧光定量试剂盒(TB Green TM Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)):宝日医。BCA 蛋白浓度测定试剂盒:博士德。Collagen V 抗体:Thermo Fisher Scientific。Pax7 抗体:圣克鲁斯。MyoD1 抗体、Myf5 抗体:Affinity Biosciences。HRP 标记抗兔二抗:成都正能。TSAPLus 荧光双重染色试剂盒、Fitc 标记抗兔二抗、Cy3 标记抗小鼠二抗:赛维尔。Finger-8-TR 型推拿量化仪:苏州长显光电科技。YLS-13A 大小鼠抓力测定仪:徐州利华电子科技。
1.3 造模方案所有大鼠进入动物房后适应性喂养3天,其中E、ES、ET 组大鼠进行1 周适应性运动并参考张学林[14]所用方法建立4 周大负荷运动损伤模型,C组不进行运动作为对照,运动方案见表1。
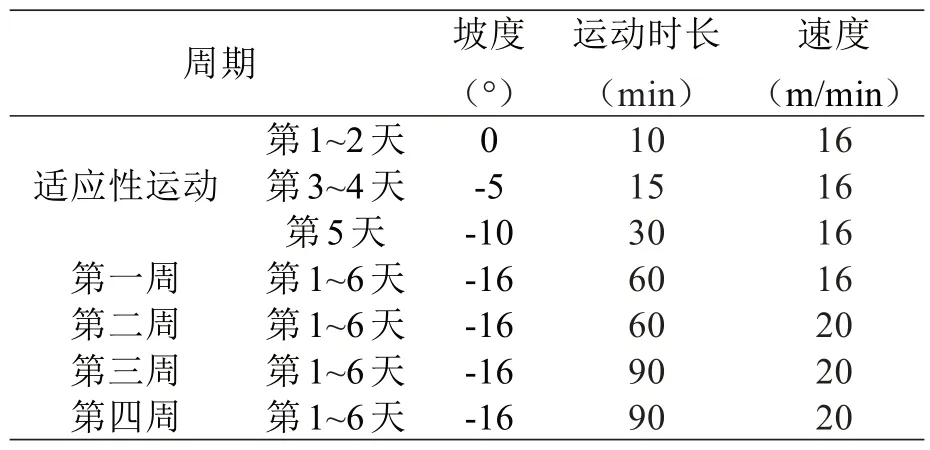
表1 大鼠大负荷运动方案
1.4 干预措施根据《灵枢·经筋》中“以痛为腧”,推拿操作主要利用阿是穴原理,对损伤部位进行揉按,将机械力刺激传递至损伤部位。自正式运动起,每日运动结束后6h,除E组不予处理外,高年资中医推拿科主治医师参照郑氏手法操作要求[15]对ET 组大鼠小腿三头肌施以揉法为主的推拿手法,每侧5min,每天1次,每周6天,休息1天,操作过程中借助Finger-8-TR 型FSR 薄膜式压力传感器对推拿参数进行量化和监测,根据团队前期实验结果[13],并参照文献[16],控制推拿力度为4N 左右,频率为120 次/min。仅对ES 组大鼠于小腿三头肌处皮肤施以轻抚,频率和时间同ET组。
1.5 样本采集与处理于末次干预后24h 采用1%戊巴比妥钠30mg/kg 腹腔麻醉,剥离两侧腓肠肌组织,左侧腓肠肌内侧头采用3%戊二醛固定用于透射电子显微镜检测;右侧腓肠肌组织分为两份,一份采用环保型GD 肌肉固定液固定用于后续免疫组化和免疫荧光染色,另一份以-80℃保存用于后续Western Bolt和实时荧光定量PCR检测。
1.6 观察指标
1.6.1 后肢抓力测试参照Wang H等[17]的方法,使用YLS-13A 大小鼠抓力测定仪进行检测:右手抓住大鼠背部将其放于网格抓杆,使其下肢抓住抓杆,左手托起大鼠上半身缓缓将其放平,然后右手握该大鼠尾部,将抓力仪推至前端,踩踏板清零,待大鼠抓牢后,缓缓拉动大鼠尾部,直至其脱落或计数截止。抓力测定仪能够准确记录大鼠后肢抓力的最大值,每只大鼠重复测试3次,取平均值。
1.6.2 透射电镜 腓肠肌组织于3%戊二醛预固定后,1%四氧化锇再固定。丙酮逐级脱水后,将样品先经脱水剂处理,又用环氧树脂包埋,再经加温聚合后切片。采用超薄切片机制备约50nm切片后,漂浮于刀槽液面上,再捞至铜网。室温下用醋酸铀和枸橼酸铅染色液染色,运用JEM-1400PLUS 透射电镜观察超微结构并采集图像。
1.6.3 免疫组织化学染色将固定后的组织经全自动脱水机脱水,石蜡包埋,7µm 切片,脱蜡后的切片经3%甲醇双氧水阻断内源性过氧化物酶,滴加免疫染色封闭液进行抗原修复,室温封闭20min,加入一抗Collagen V(1:100),4℃孵育过夜。于次日PBS 水洗后,加入山羊抗兔二抗(1:1000),37℃孵育30min,再次PBS水洗。使用DAB显色试剂盒显色,苏木素复染,中性树胶封片。使用BA200Digital 数码显微摄像系统对切片进行图像采集。采用Imagepro Plus 6.0 分析同一参数下总和光密度值,根据图片总面积计算平均光密度值。
1.6.4 实时荧光定量PCR 各大鼠取100mg骨骼肌组织,采用Trizol法提取mRNA,并将获得的mRNA 经超微量分光光度计(Thermo)检验纯度和浓度。使用PrimeScript RT reagent Kit 试剂盒进行基因组DNA 除去反应和逆转录反应,获得样品cDNA。按照TB Green TM Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)建立20µL 预混液反应体系,95℃预变性30s,95℃变性5s,55℃退火30s,72℃充分延伸30s,45 循环,并用PIKORed 96实时荧光定量仪进行扩增和采集荧光。使用PikoReal 软件分析各检测样本的CT(Threshold cycle)值,通过2-△△CT计算Col5a1 和Col5a3 相对mRNA 表达水平。引物均由上海生工生物工程股份有限公司设计合成,序列如下:Col5a1:5'-GGACTCCGACTCCAATGTCTCTCC-3';Col5a1:5'-GGCTCAATGATGGCTGGTTCTCC-3';Col5a3:5'-TGAGAAGCTGCCGGAGACTGG-3';Col5a3:5'-CCCTATGCACACCCAAGGTTTCC-3';β-actin:5'-GAAGATCAAGATCATTGCTCC-3';β-actin:5'-TACTCCTGCTTGCTGATCCA-3'。
1.6.5 Western Blot 各大鼠取20mg 腓肠肌组织与裂解液混合并匀浆,4℃、12000r/min离心5min,取上清液采用BCA 法测定蛋白浓度,加热变性制作蛋白样品。获得样品后加入十二烷基硫酸钠聚丙烯酰胺凝胶进行电泳(浓缩:80V 30min;分离:120V 90min),再以200mA 转膜90min。用含5% 脱脂奶粉的TBST 封闭2h,分别加入Pax7(1:600)、MyoD1(1:1000)、Myf5(1:500)、β-actin(1:50000)一抗,4℃孵育过夜,TBST 充分洗涤,加入山羊抗兔二抗(1:10000),37℃孵育2h,TBST 再次充分洗涤,使用增强ECL 化学发光液显影、定影,采用Image-J 软件分析目标蛋白及内参蛋白的灰度值并计算比值。
1.6.6 免疫荧光共定位将固定后的组织经全自动脱水机脱水,石蜡包埋,7µm 切片。经梯度乙醇脱蜡后,使用EDTA(pH 8.0)对玻片进行抗原修复。滴加免疫染色封闭液室温封闭10min 后,分别添加一定比例Collagen V(1:500)、Pax7(1:300)一抗混合液,室温孵育1~2h 后转移至4℃过夜。次日PBS 水洗后,滴加Fitc 标记山羊抗兔和Cy3 标记山羊抗小鼠二抗,室温孵育2h。再次PBS 水洗,滴加DAPI,室温孵育10min,用抗荧光淬灭封片剂封片。采用Pannoramic 250 全自动数字扫描显微镜进行拍照观察,随机选取视野采集。
1.7 统计方法采用SPSS 25.0 软件进行统计分析,实验数据均以均值加减标准差(±s)表示,组间比较采用单因素方差分析。方差齐性检验采用Brown-Forsythe test和Bartlett's test,方差齐时,采用LSD检验;方差不齐时,采用Tamhan's T2检验。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠后肢抓力测试各组间初始后肢抓力无显著性差异(P>0.05)。E 组、ES 组与ET 组4 周后抓力较C 组均显著增加(P<0.01)。经校准,E 组与ES 组在完成运动方案后抓力增加值较C组具有显著性差异(P<0.05),ET 组也具有显著性差异(P<0.01);同时,ET 组较E 组和ES 组抓力增加值也具有显著性差异(P<0.05);E组与ES组无显著性差异(P>0.05),见图1。
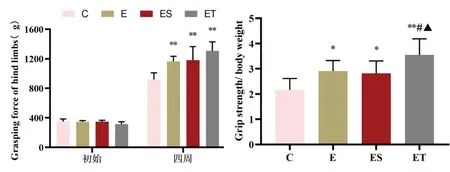
图1 各组大鼠后肢抓力变化(g)
2.2 透射电镜观察腓肠肌超微结构C 组大鼠腓肠肌肌原纤维排列整齐,肌节明暗带清晰可见,线粒体完整且有规律地排列在Z 线两侧。E 组与ES 组大鼠腓肠肌超微结构发生改变,肌原纤维发生断裂和降解、Z 线断裂、肌浆网肿胀、线粒体结构不清且肿胀。ET 组大鼠腓肠肌超微结构较E 组和ES 有明显改善,肌原纤维排列整齐、肌浆网完整,但仍有部分线粒体结构不清,见图2。
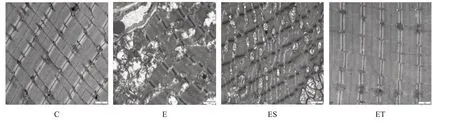
图2 各组大鼠腓肠肌超微结构(×20000)
2.3 免疫组织化学染色各组大鼠腓肠肌组织均出现深棕色颗粒阳性表达,其中C组和ET组深棕色颗粒显著多于E 组和ES 组。E 组与ES 组Collagen V表达水平较C 组均呈下降趋势,其中E 组降低具有显著性(P<0.05);ET 组Collagen V表达较其余三组均显著升高(P<0.01);E 组与ES 组无显著性差异(P>0.05),见图3。
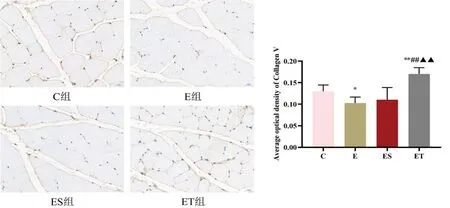
图3 各组大鼠Collagen V表达(×400)
2.4 实时荧光定量PCR E 组、ES 组与ET 组Col5a1mRNA 表达水平较C 组均显著降低(P<0.01);ET 组表达较E 组和ES 组呈上升趋势,其中较E 组升高具有显著性(P<0.05)。E 组与ES 组Col5a3 mRNA 表达水平较C 组均显著降低(P<0.01);ET 组表达较C组显著升高(P<0.05),同时较E 组与ES 组也显著升高(P<0.01);E 组与ES 组无显著性差异(P>0.05),见图4。2.5 Western Blot E 组Pax7 蛋白表达水平较C 组降低(P<0.01),同时ES 组Pax7 蛋白表达较C 组也降低(P<0.05),两组MyoD 和Myf5 蛋白表达较C 组均降低(P<0.01);而ET 组较C 组除Pax7 蛋白表达无显著差异(P>0.05)外,其Pax7蛋白表达较E组和ES组显著升高(P<0.01),且MyoD 和Myf5 蛋白表达较另三组均显著升高(P<0.01);ES 组较E 组除MyoD蛋白表达升高显著(P<0.05)外,其余蛋白表达均无显著差异(P>0.05),见图5。

图4 各组大鼠Col5a1和Col5a3 mRNA表达
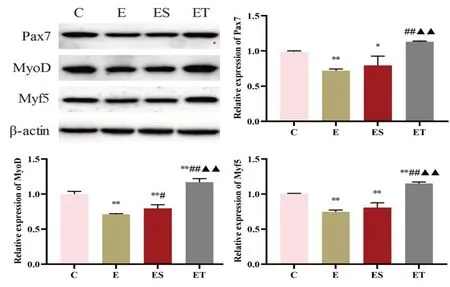
图5 各组大鼠Pax7、MyoD和Myf5蛋白表达
2.6 免疫荧光共定位红色荧光标记Pax7,绿色荧光标记Collagen V,Pax7 与Collagen V共定位呈现黄色荧光。E组和ES组黄色荧光信号较C组减少;ET组黄色荧光信号较C 组无明显差异,而较E 组和ES组增加;E 组和ES 组黄色荧光信号无明显差异,见图6。E 组与ES 组Pax7 与Collagen V的Overlap 系数较C 组均显著降低(P<0.01);ET 组较C 组无显著性差异(P>0.05),而较E 组和ES 组均显著升高(P<0.01);E组与ES组无显著性差异(P>0.05),见图7。

图6 各组大鼠Collagen V与Pax7免疫荧光共定位结果(×400)
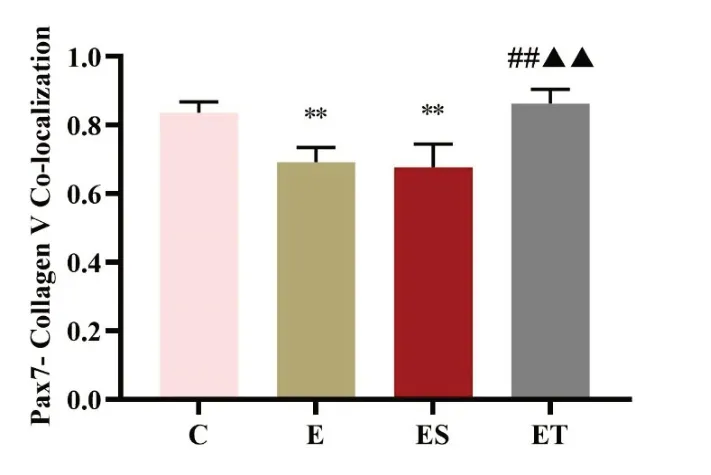
图7 各组大鼠Collagen V与Pax7共定位表达
3 讨论
推拿作为中国传统疗法之一,常应用于治疗长期过度使用骨骼肌引起的慢性肌肉劳损,缓解肌肉酸痛和疲劳无力等症状[18]。竞技运动中,运动员平日反复进行的高强度训练导致骨骼肌重复性微损伤积累,造成骨骼肌过度使用,久之则易形成慢性劳损[19-20]。有研究证实,离心大负荷运动易造成骨骼肌超微结构变化,导致骨骼肌微损伤[21-22]。而长期大负荷运动过程中,为适应骨骼肌的过度使用,其超微结构损伤及重复性微损伤会累积,出现组织炎症浸润及纤维化等现象[23]。推拿已被证实具有加速运动所致骨骼肌损伤修复的作用[24],与团队前期研究发现推拿可加速一次性大负荷运动骨骼肌超微结构损伤修复结果一致[13]。且有研究表明,通过推拿给予机体一定机械力刺激可诱导细胞骨架蛋白重塑[25],这也对骨骼肌超微结构损伤修复具有重要意义。本研究运用大鼠四周递增连续离心下坡跑模拟运动员长期大负荷运动状态,通过透射电镜观察到大鼠腓肠肌超微结构发生了肌原纤维断裂及降解、Z线断裂等改变,而经推拿干预的大鼠腓肠肌超微结构有明显改善,提示推拿可促进长期大负荷运动所致骨骼肌损伤修复。此外,另有研究表明推拿在促进损伤修复的同时还能有效改善肌肉力量[26]。本研究结果显示,推拿组大鼠后肢抓力的提升远超单纯运动大鼠,这进一步说明推拿促进损伤修复的同时,能更有效地巩固并增强长期大负荷运动产生的肌肉力量。
MSC 自我更新是骨骼肌损伤修复的内源性动力,该过程受MSC 生态位严格调控。Pax7 是MSC及其自我更新的关键标志物,参与维持MSC 生态位、调控其自我更新且持续表达抑制成肌细胞肌源性分化程序[27]。与此同时,骨骼肌再生修复依赖肌源性调节因子来调节分化程序[28]。MSC 通常处于静息状态,稳定表达Pax7,当受到损伤刺激活化后,则开始表达MyoD 和Myf5,参与肌肉中成纤维细胞等非肌肉细胞向肌肉的转化过程。本研究检测了大鼠腓肠肌中Pax7、MyoD 和Myf5 蛋白表达情况,以探究推拿对MSC自我更新的影响。有证据证明,运动引起的重复性损伤会降低MyoD 和Myf5 表达[29],本研究发现单纯运动组中Pax7、MyoD 和Myf5蛋白表达均降低,这说明长期大负荷运动可能导致重复性损伤。而推拿组相较于空白对照组MyoD 和Myf5 蛋白表达显著升高,提示骨骼肌损伤后推拿有助于MSC自我更新。另一方面,推拿组三种蛋白表达较单纯运动组和假推组均显著升高,结合透射电镜结果,提示推拿可能因促进MSC自我更新而加速长期大负荷运动所致骨骼肌损伤修复。
Collagen V是MSC 生态位关键组成成分,对维持MSC静息态起重要作用。Baghdadi MB等[11]发现Collagen V缺失时,会导致MSC进入异常细胞周期,消耗干细胞池,影响MSC 生态位稳定,进而导致自我更新受损。为验证推拿能否通过干预Collagen V表达,影响MSC 自我更新,本研究采用免疫组织化学染色法检测Collagen V表达,发现长期大负荷运动后Collagen V表达显著降低,而介入推拿会上调Collagen V表达,与团队前期研究推拿对一次性大负荷运动所致骨骼肌损伤Collagen V表达变化趋势一致[13]。与此同时,本研究还检测了Collagen V主要基因Col5a1和Col5a3 mRNA表达,推拿干预下两基因mRNA 表达升高,与免疫组织化学染色结果类似,这提示长期推拿有助于上调Collagen V表达。为进一步探究Collagen V在推拿干预下对MSC 自我更新的作用,本研究就Collagen V与Pax7 进行免疫荧光共定位,结果显示长期大负荷运动后Collagen V与Pax7 共定位程度降低,而长期推拿使共定位程度有所提高,这说明Collagen V参与推拿促进MSC 自我更新过程。由此推测,推拿的确可能通过上调Collagen V表达,促进长期大负荷运动大鼠骨骼肌损伤中所进行的MSC自我更新。
综上所述,本研究探究了推拿可能通过上调Collagen V表达的方式,促进MSC自我更新,从而加速长期大负荷运动导致骨骼肌损伤的修复,并增强肌肉力量。但由于MSC生态位成分复杂,是否还有其他细胞和因子参与推拿修复骨骼肌损伤过程,或参与调控Collagen V来间接影响其损伤修复,仍有待进一步研究。
