食管癌患者外周血中白细胞介素-1β和组织中程序性死亡分子1的表达对预后的影响及临床意义
2024-01-03王献尚自强杨冬杨惠
王献,尚自强,杨冬,杨惠
(1.河南科技大学第一附属医院,河南科技大学临床医学院胸外科,河南 洛阳 471003;2.河南省人民医院,郑州大学人民医院胸外科,郑州 450003;3.河南省人民医院,郑州大学人民医院消化内科,郑州 450003)
我国是食管癌的高发国家,其中鳞状细胞癌约占食管癌的90%,食管癌造成的伤残调整寿命年位居所有恶性肿瘤第4位[1]。食管早期症状隐匿,确诊时大多处于晚期阶段,70%~80%患者无法手术,严重影响患者的生存率[2],因此探讨促进食管鳞状细胞癌进展的分子生物学机制具有重大意义。
肿瘤的发生、发展与其所在的微环境密切相关,研究[3]显示肿瘤微环境可通过调控肿瘤免疫微环境释放细胞因子,影响肿瘤的进展。炎症促进肿瘤细胞的侵袭并可诱导免疫抑制,是进展性肿瘤微环境的标志之一。白细胞介素(interleukin,IL)-1β是上游促炎细胞因子,可激活适应性免疫反应。已有研究[4-5]显示IL-1β能够促进肿瘤发生、肿瘤侵袭和免疫抑制。程序性死亡受体1(programmed death receptor 1,PD-1)是众所周知的免疫检查点,T细胞活化后可刺激CD4+和CD8+T细胞的表达。研究[6]显示,PD-1在食管癌中的表达水平增加,PD-1抑制剂在食管癌中具有临床价值。本研究旨在探讨IL-1β和PD-1在食管癌组织中的表达情况及对患者临床病理特征和预后的影响。
1 材料与方法
1.1 研究对象
选取2018年1月至2020年5月于河南科技大学第一附属医院接受手术治疗的食管癌患者127例,根据术后3年患者的存活情况,将患者分为存活组(n=95)和死亡组(n=32)。纳入标准:(1)术后病理确诊为食管癌;(2)接受手术联合放化疗治疗。排除标准:(1)合并其他肿瘤;(2)资料不完整。收集患者的一般临床资料,包括年龄、性别、肿瘤位置、肿瘤直径、TNM分期、淋巴结转移和浸润深度。本研究获得河南科技大学第一附属医院伦理委员会批准(批准文号:2016012),所有患者知情同意。
1.2 方法
1.2.1 免疫组织化学检测食管癌患者组织中PD-1、程序性死亡配体1(programmed death ligand 1,PDL1)的表达:将食管癌组织至于4%多聚甲醛中固定,石蜡包埋后制备成厚度约4 μm的切片,经脱蜡、水化、渗透和封闭后,滴加抗PD-1抗体或抗PD-L1抗体(1 ∶200),置于4 ℃冰箱孵育过夜。PBS冲洗,滴加相应种属二抗(1 ∶400),室温下孵育60 min,PBS冲洗3遍。滴加显色液,置于显微镜下观察,呈淡黄色、棕黄色和棕褐色为阳性表达。
1.2.2 肿瘤坏死因子(tumor necrosis factor,TNF)-α、IL-6和IL-1β的水平:根据ELISA试剂盒说明检测外周血中细胞因子、TNF-α、IL-6和IL-1β水平。正常范围内为正常表达,高于正常范围为高表达。
1.2.3 术后随访:患者出院后以电话和门诊相结合的方式进行随访,术后第1年,每半年随访1次,自第2年起每1年随访1次,最短随访时间为5个月,最长随访时间为36个月,失访患者5例。
1.3 统计学分析
采用SPSS 21.0软件进行统计学分析,利用Kaplan-Meier生存曲线计算不同组间的生存率,并采用log-rank检验进行分析。组间一般临床资料比较采用χ2检验,利用单因素和多因素Cox回归分析影响患者术后生存的独立危险因素。计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 2组一般临床资料比较
结果显示,死亡组年龄≥60岁、淋巴结转移、浸润至肌层、肿瘤直径>3 cm、PD-1阳性表达、IL-1β高水平和TNF-α高水平患者比例均高于生存组,IL-6高水平患者比例低于生存组,组间比较均有统计学差异(P<0.05),见表1。
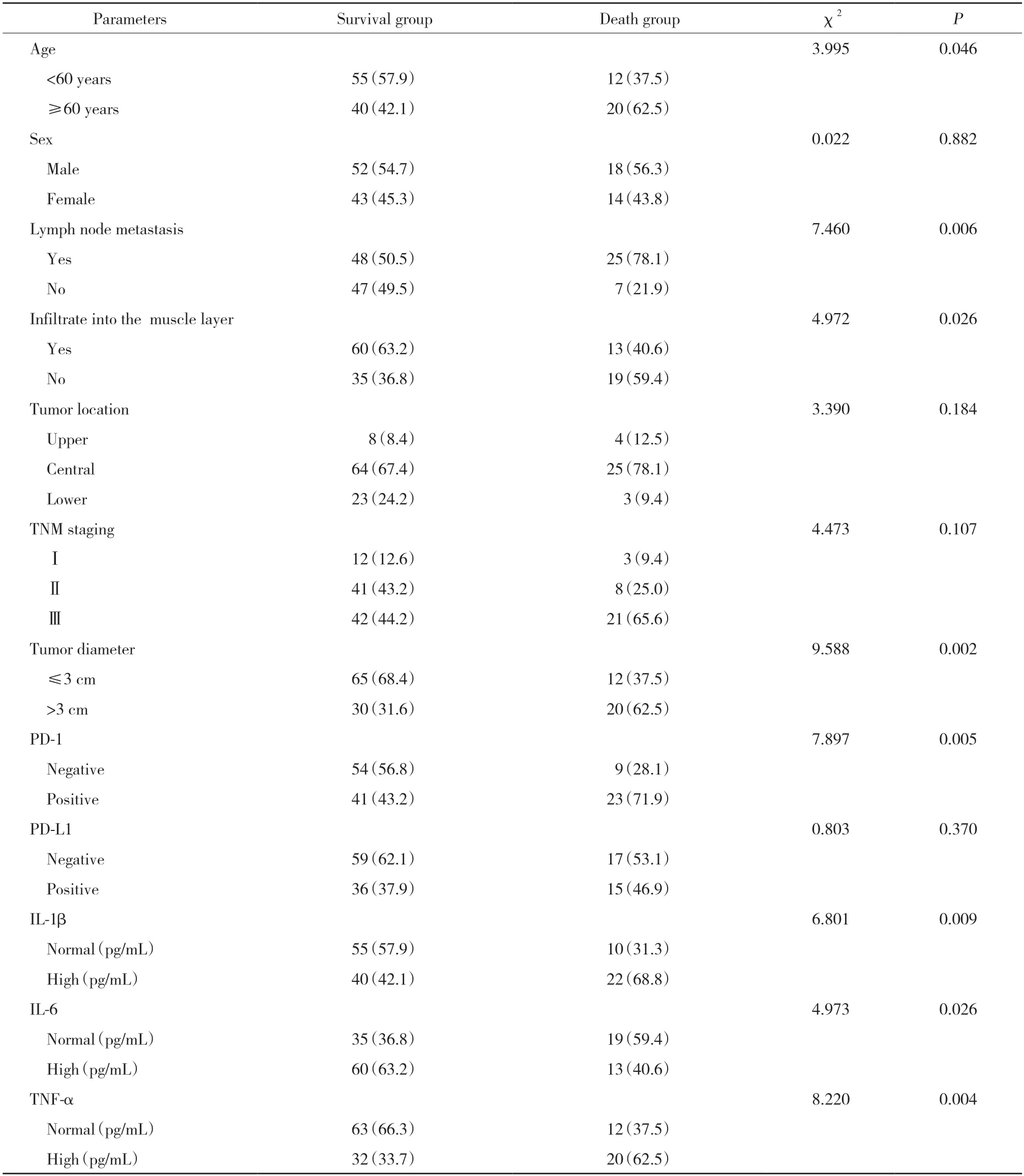
表1 2组一般临床资料的比较[n(%)]Tab.1 Comparison of general clinical data between the two groups[n(%)]
2.2 Cox多因素回归分析影响患者术后死亡的危险因素
将表1中2组间有统计学差异的因素带入Cox多因素回归分析模型中分析,结果显示,浸润至肌层、肿瘤直径>3 cm、IL-1β高水平和PD-1阳性表达为影响患者术后死亡的危险因素。见表2。
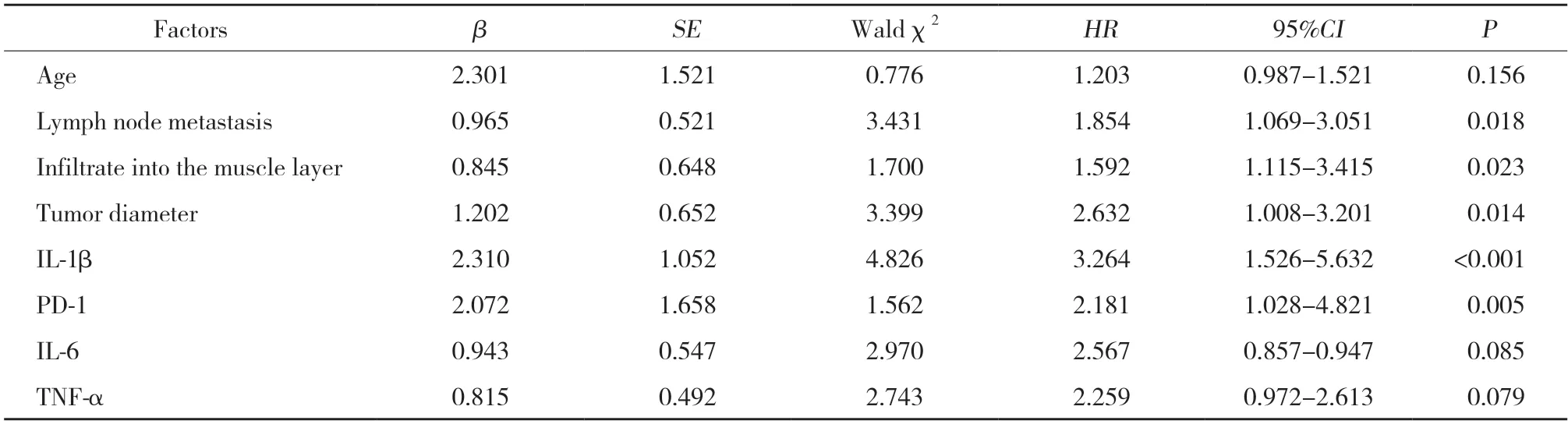
表2 Cox多因素回归分析影响患者术后死亡的危险因素Tab.2 Cox multivariate regression analysis of risk factors for postoperative mortality in patients
2.3 IL-1β高水平且PD-1阳性表达对患者生存率的影响
IL-1β正常水平+PD-1阴性组、IL-1β高水平+PD-1阳性组和IL-1β正常水平+PD-1阳性组/IL-1β高水平+PD-1阴性组患者的3年生存率分别为92.4%、13.3%和84.2%,组间比较有统计学差异(χ2=82.318,P<0.01),且IL-1β高水平+PD-1阳性组患者生存率最低,见图1。
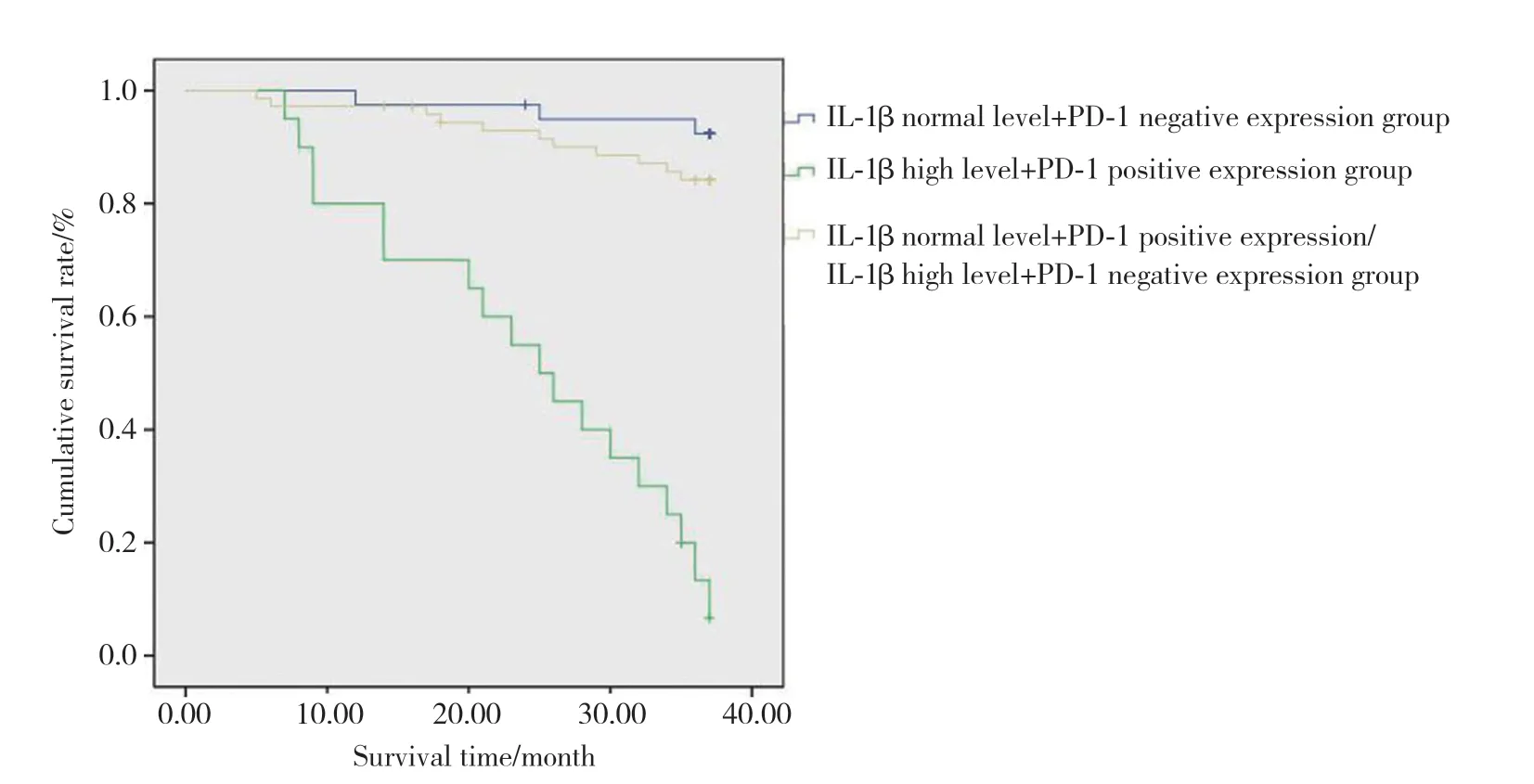
图1 IL-1β高水平且PD-1阳性表达对患者生存率的影响Fig.1 The effect of high level of IL-1β and positive expression of PD-1 on the survival rate of patients
3 讨论
食管癌是最严重的消化系统恶性肿瘤之一,恶性潜能高,预后较差,我国亦是食管癌的高发国家[7]。研究[8]显示,晚期食管癌接受标准化疗的有效性仅为20%~35%,中位生存时间为6~10个月,而PD-1抑制剂的3期临床试验显示其有望成为食管癌患者的标准治疗方法。探究适用于食管癌靶向治疗的方案,对改善患者预后具有重要的临床价值。
IL-1家族通过影响抗原识别模式和淋巴细胞功能对炎症和免疫反应发挥关键作用。由IL-1β编码的IL-1β蛋白在人体的急性和慢性炎症过程中作为一种分泌蛋白发挥作用。慢性炎症被认为是致癌、肿瘤进展和转移的标志之一,可引发各种肿瘤的发展,如肝细胞癌、胃癌及肺癌[9-10]。IL-1β在慢性阻塞性肺病患者的小气道上皮细胞中上调约2~3倍,且影响慢性阻塞性肺病的气道炎症,促进肺癌的发生[11]。IL-1β在慢性炎症向肿瘤诱导的转变中已经发挥了重要作用。本研究中死亡组患者IL-1β高水平患者比例显著高于生存组,可见IL-1β高水平是影响患者术后死亡的危险因素。
最初,PD-1被确定在凋亡细胞中高表达,随着研究的深入发现其是一个关键的免疫检查点,调节T细胞和B细胞的抗原反应。随后的研究[12]发现临床肿瘤样本中PD-L1 异常升高与预后不良呈正相关,支持将PD-1通路阻断应用于癌症治疗。PD-L1/PD-1通路是抗肿瘤免疫中的关键免疫检查点,PD-L1蛋白通常在免疫细胞和免疫组织中表达,其表达在许多癌症中上调。癌细胞表达的PD-L1可以与癌症特异性细胞毒性T淋巴细胞表达的PD-1结合,诱导细胞凋亡,针对检查点的免疫疗法在临床上取得了巨大的成功。本研究结果显示,PD-1阳性表达为影响食管癌患者术后3年死亡的危险因素,生存分析结果显示,IL-1β高表达+PD-1阳性的患者生存率仅为13.3%,提示IL-1β高表达和PD-1阳性表达促进肿瘤的恶性进展。
KAPLANOV等[13]研究结果显示,IL-1β抑制与抗PD-1可恢复T 细胞介导的肿瘤免疫,增强抗肿瘤细胞免疫,发挥抗肿瘤活性。研究[14-15]显示,心血管高风险患者每3个月接受一次抗IL-1β抗体(卡那单抗)治疗,持续4年,与安慰剂组相比,治疗组的肺癌发病率降低67%,死亡率降低77%。在携带 BALB/c的4T1肿瘤中,微环境IL-1β可减少肿瘤生长并改善抗肿瘤细胞免疫参数,但并未导致完全消退。使用抗IL-1β或抗 PD-1 作为单一药物治疗仅略微减少了肿瘤生长。阻断PD-1抗体已被广泛用于治疗上皮癌患者,但只有小部分患者肿瘤持久消退,而抗IL-1β治疗与抗PD-1治疗相结合可能是一个新的治疗方向。
综上所述,IL-1β高水平和PD-1阳性表达为影响食管癌患者术后死亡的危险因素,IL-1β高水平且PD-1阳性患者术后3年生存率最低,抗IL-1β联合抗PD-1治疗可能是一个新的治疗方向。
